化学元素炭素は、非金属として分類されます。 古くから知られている。 発見者、発見年代は不明です。

Data Zone
| Classification: | Carbon is a nonmetal |
| Color: | 黒(グラファイト)、透明(ダイヤモンド) |
| 原子量: | 12.011 |
| 状態: | 固体 |
| 融点: | 3550 oC, 3823 K |
| 注:通常の大気圧では、加熱されても溶けない、昇華してしまう。 つまり、固体から気体へ直接相変化する。 | |
| 沸点: | 3825 oC, 4098 K |
| 沸点は昇華した黒鉛の上の蒸気圧が1気圧になったときに記録される。 | |
| 電子: | 6 |
| プロトン: | 6 |
| 最も多い同位体で中性子数です。 | 6 |
| 電子殻: | 2,4 |
| 電子配置: | 1s2 2s2 2p2 |
| 20℃での密度: | 2.0(℃)、2℃、2.0(℃)。267 g/cm3 (gr), 3.513 g/cm3 (di) |
以下を含む、もっと表示。 熱、エネルギー、酸化、反応、
化合物、半径、導電率
| 原子容: | 5.31 cm3/mol (gr), 3.42 cm3/mol (di) |
| 構造: | 六角形層(グラファイト)、四面体(ダイヤモンド) |
| 硬度: | 0.5モース(グラファイト)、10.0モース(ダイヤモンド) |
| 比熱 | 0.71J g-1 K-1 (グラファイト)、 0.9J g-1 K-1 (ダイヤモンド)。5091 J g-1 K-1 (ダイヤモンド) |
| 融解熱 | 117 kJ mol-1 (黒鉛) |
| 原子化熱 | 717 kJ mol-1 |
| 気化熱 | 710.1 kJ mol-1 (黒鉛) |
| 1番目のイオン化エネルギー | 1086.5 kJ mol-1 |
| 第2イオン化エネルギー | 2352.6 kJ mol-1 |
| 第3イオン化エネルギー | 4620.5 kJ mol-1 |
| 電子の親密度 | 121.0 kJ mol-1 |
| 第2イオン化エネルギー | 260.5 kJ mol-155 kJ mol-1 |
| 最小酸化数 | -4 |
| 最小共通酸化数. | -4 |
| 最大酸化数 | 4 |
| 最大共通酸化数。 | 4 |
| 電気陰性度(Pauling Scale) | 2.55 |
| 分極率体積 | 1.8 Å3 |
| 空気との反応 | 激しい, ⇒ CO2 |
| 15 M HNO3との反応 | 穏やかな, w/ht ⇒ C6(CO2H)6 (メリト酸/グラファイト酸) |
| 6 M HClとの反応 | なし |
| 6 M NaOHとの反応 | なし |
| 酸化物(S) | CO , CO2 |
| ヒドリド(s) | CH4 および多くの CxHy |
| クロライド(s) | CCl4 |
| 原子半径 | 70 pm |
| – | |
| イオン半径 (2+イオン) | – |
| イオン半径 (3+ イオン) | – |
| イオン半径 (1-> | |
| – | |
| イオン半径(3-イオン) | – |
| 熱伝導率 | 25-470 W m-1 K-1 (Graphite). 470 W m-1 K-1 (ダイヤモンド) |
| 電気伝導率 | 0.07 x 106 S m-1 |
| 凝固点/融点: | 3550 oC, 3823 K |

カーボンナノチューブの構造の模型を作成。

燃焼実験で巨大なレンズを使用するラヴォアジエ
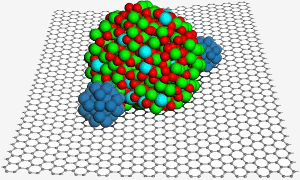
グラフェンの表面でインジウムスズ酸化物ナノ粒子をホストし、燃料電池で触媒作用を高めるために白金のナノ粒子(青)2つを固定できるようにする。 画像はイメージです。 PNL.
Discovery of Carbon
炭素は古くから、すす、炭、黒鉛、ダイヤモンドの形で知られていました。 フランスの科学者アントワーヌ・ラヴォアジエは炭素を命名し、その性質を明らかにするためにさまざまな実験を行いました。 彼らは巨大な虫眼鏡を使って太陽の光をダイヤモンドに当て、ダイヤモンドが燃えて消えるのを見た。
ラヴォアジエは、瓶の全体の重さは変わらず、燃えたときにダイヤモンドが酸素と結合して二酸化炭素を形成していたことに気づいた。 (1), (2) 彼は、ダイヤモンドと木炭は同じ元素である炭素でできていると結論づけた。
1779年、スウェーデンの科学者カール・シェーレは、黒鉛が燃焼して二酸化炭素を生成することを示し、別の形態の炭素であることを証明しました。
1796年、イギリスの化学者スミソン・テナントは、ダイヤモンドが炭素の化合物ではなく純炭素で、燃焼して二酸化炭素を生成するだけであると立証しました。 (4)
1855年、イギリスの化学者ブロディが炭素から純黒鉛を作り、黒鉛が炭素の一形態であることを証明した。 (4)
これまでも試みはあったが成功しなかったが、55年にアメリカの科学者バンディとゼネラルエレクトリック社の同僚が高温・高圧下で黒鉛からダイヤモンドができることをついに実証した。(5)
1985年、ロバート・カール、ハリー・クロート、リチャード・スマレーの3人は、原子がサッカーボール状に配列した新しい形の炭素、フラーレンを発見した。 フラーレンの中で最もよく知られているのは、60個の炭素原子からなるバックミンスターフラーレン(別名C60)である。 フラーレンは、C20から始まり、C540までの大きなファミリーが存在する。 (6), (7)
最近発見された炭素の同素体としては、炭素原子が六角形に配列した単層からなるグラフェンがある。 この層が互いに積み重なると、グラファイトになる。 グラフェンの厚さはわずか原子1個分である。
グラフェンの発見は、2004年にKostya Novoselov氏とAndre Geim氏によって発表されました。彼らは粘着テープを使ってグラファイトから原子の単層を剥がし、新しい同素体を作り出しました。
- ダイヤモンドは、一般的に最も硬い物質で、熱伝導率が最も高いので、優れた研磨剤である。 どんな物質でも研磨することができ、摩擦によって発生した熱は速やかに伝導します。
- あなたの体の中の炭素原子はすべて、かつて大気中の二酸化炭素の一部だったのです。
- グラフェンは、これまでで最も薄く、強い物質です。
- グラフェンは2次元の原子結晶でできており、このような構造が見られるのは初めてのことです。 これは、200万層のグラフェンに相当します。
- 車のタイヤが黒いのは、約30%がカーボンブラックで、ゴムを強化するために加えられるからです。 カーボンブラックには、紫外線によるタイヤの損傷を防ぐ効果もあります(8)
- 炭素は、星の中で核融合反応によりヘリウムを燃やすと作られます。 炭素は、ヘリウムが燃えてできた「灰」の一部です。
- 炭素は重い星の中で核融合反応を起こし、ネオン、マグネシウム、酸素を作ります。




左:空気中の石炭(主に非晶質炭素)の燃焼。 右は ダイヤモンド(結晶性炭素)。 約800℃で燃焼するダイヤモンドの写真を撮ろうと思いましたが、そんな余裕はありませんでした!

このような炭素ベースの生命体が、私たちの地球を支配しているのです

DNA. 有名な二重らせん分子は、長い分子鎖を形成する炭素の能力によって可能になりました。
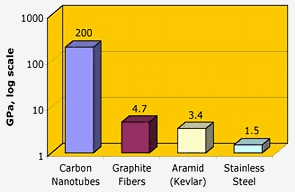
Nasa: カーボンナノチューブは、グラファイト繊維、ケブラー、または鋼鉄よりも2桁も高い、卓越した引張強度を有しています。
カーボンの周期表近傍
| Group 13 |
Group 14 |
Group 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
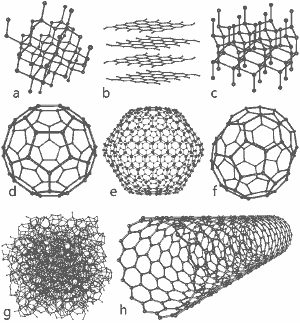
GNU Free Documentation LicenseのもとMichael Ströck氏が公開したすばらしい画像です。 a) ダイヤモンド b) グラファイト c) ロンズデライト d) C60 (バックミンスターフラーレン) e) C540 フラーレン f) C70 フラーレン g) アモルファスカーボン h) 単層カーボンナノチューブ。
外観・特性
有害作用。
純カーボンの毒性は非常に低い。 大量のカーボンブラックの粉塵(煤塵・炭塵)を吸入すると、肺に刺激や損傷を与えることがある。
特徴:
炭素は原子の並び方が異なる複数の立体構造(同素体)を持つことがある。
一般的な結晶性の同素体としては、グラファイト、ダイヤモンド、(通常は)フラーレンの3つがある。 グラフェンは2次元の結晶構造を持つ。(フラーレンは非晶質で存在することもある)(9)
炭素も非晶質で存在することがある。 しかし、ガラス状炭素、煤、カーボンブラックなど、一般にアモルファスと呼ばれる多くの同素体は、通常、十分な構造を持ち、真のアモルファスとは言えない。 (10)
8つの同素体の構造をこのページの下に示した。興味深いことに、グラファイトは最も柔らかい物質の一つであり、ダイヤモンドは最近まで最も硬い自然発生物質と考えられていた。
非常に珍しい炭素の同素体であるロンズデライトは、純粋な状態ではダイヤモンドより58%強いと計算されている。 ロンズデライトは、グラファイトの六角形構造を持つ、ダイヤモンドのような炭素のネットワークである。 黒鉛を含む隕石が地球などの別の天体に衝突したときに作られる。
炭素は元素の中で最も融点・昇華点が高く、ダイヤモンドの形では元素の中で最も高い熱伝導率を持っています。 一般的な室温では、あなたの体温は部屋の温度よりも高い。たまたまその辺に転がっている大きなダイヤモンドも含めて、である。 ダイヤモンドに触れると、その高い熱伝導性により、他のどの素材よりも早く皮膚から熱が奪われます。 脳は、この皮膚からの熱エネルギーの急速な移動を、非常に冷たいものに触れていると解釈するため、室温のダイヤモンドを氷のように感じることがあるのです。
炭素の用途
炭素(主に炭素である石炭)は燃料として使われます。
黒鉛は鉛筆の芯や高温るつぼ、乾電池、電極、潤滑剤に使われます。
ダイヤモンドは宝飾品や、硬いので工業用として切断、穴あけ、研削、研磨に使われる。
カーボンブラックは印刷インクの黒い顔料として使用される。
14C放射性同位体は考古学的年代測定に使用される。
化学工業の多くの分野で炭素化合物は重要で、炭素は水素、酸素、窒素、その他の元素と膨大な数の化合物を形成する。
Abundance and Isotopes
Abundance earth’s crust: 200 parts per million weight, 344 parts per million by moles
Abundance solar system.All Rights Reserved: 重量で3000ppm、モル数で300ppm
コスト、純粋:100gあたり2.4ドル
コスト、バルク:100gあたりドル
ソースはこちら。 炭素は、有機化合物を酸素不足で燃焼させることで得ることができる。 炭素の主な同素体は、黒鉛、ダイヤモンド、非晶質炭素、フラーレンの4つ。
天然ダイヤモンドは、古代火山のキンバーライトで見つかる。
黒鉛も天然の堆積物で見つかる。
フラーレンは1980年代に分子ビーム実験の副産物として見つかった。
同位体:半減期がわかっているのは13種類で、質量数は8~20である。 自然界に存在する炭素は2つの同位体の混合物であり、それらは示された割合で存在する。 12C (99%)と13C (1%)である。
半減期5730年の同位体14Cは、木材や考古学的標本などの炭素質物質の年代測定に広く用いられ、約4万年までの年代を測定できる。

- Robert E. Krebs, The history and use of our earth chemical elements: a reference guide., (2006) p192.Netscape.net. Greenwood Publishing Group
- Mary Elvira Weeks, The discovery of the elements. I. Elements known to the ancient world(古代に知られていた元素), J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses., (2006) p507.より引用。 SME.
- Amanda S. Barnard, The diamond formula: Diamond synthesis-a gemological perspective., (2000) p3. バターワース・ハイネマン
- ロバート・M・ヘイゼン「ダイヤモンド・メーカーズ」, (1999) p145. ケンブリッジ大学出版局
- ジョナサン・W・スティード、ジェリー・L・アトウッド、超分子化学、(2009)p423. Wiley.
- Nobel Prize for Chemistry, 1996
- タイヤを作るために必要なものは何か?
- Ming Gao and Hui Zhang, Preparation of an amorphous fullerene film., Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6.
Cite this Page
For online linking, copy and paste one of the following:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
or
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
To cite this page in an academic document, please use the following MLA compliant citation:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.