Kwasowość fenolu
Związki takie jak alkohole i fenol, które zawierają grupę -OH dołączoną do węglowodoru są bardzo słabymi kwasami. Alkohole są tak słabo kwaśne, że dla zwykłych celów laboratoryjnych ich kwasowość może być praktycznie ignorowana. Jednak fenol jest wystarczająco kwaśny, aby mieć rozpoznawalne właściwości kwasowe – nawet jeśli jest to nadal bardzo słaby kwas. Jon wodorowy może oderwać się od grupy -OH i przejść do zasady. Na przykład, w roztworze wodnym:

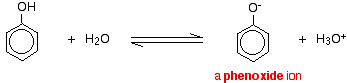
Fenol jest bardzo słabym kwasem, a położenie równowagi leży po lewej stronie. Fenol może tracić jon wodorowy, ponieważ powstały jon fenoksydowy jest w pewnym stopniu ustabilizowany. Ujemny ładunek na atomie tlenu jest zdelokalizowany wokół pierścienia. Im bardziej stabilny jest jon, tym większe jest prawdopodobieństwo jego powstania. Jedna z par samotnych na atomie tlenu nakłada się na zdelokalizowane elektrony na pierścieniu benzenu.
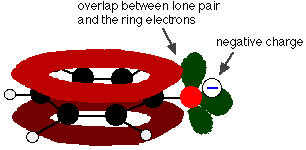
Zachodzenie to prowadzi do delokalizacji, która rozciąga się od pierścienia na atom tlenu. W rezultacie, ujemny ładunek nie jest już całkowicie zlokalizowany na tlenie, ale jest rozproszony wokół całego jonu.
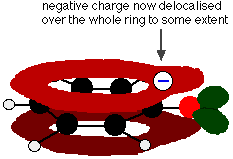
Rozproszenie ładunku wokół sprawia, że jon jest bardziej stabilny niż byłby, gdyby cały ładunek pozostał na tlenie. Jednak tlen jest najbardziej elektronegatywnym elementem w jonie i zdelokalizowane elektrony będą przyciągane w jego kierunku. Oznacza to, że nadal będzie dużo ładunku wokół tlenu, który będzie miał tendencję do przyciągania jonu wodorowego z powrotem. Dlatego fenol jest tylko bardzo słabym kwasem.
Dlaczego fenol jest znacznie silniejszym kwasem niż cykloheksanol? Aby odpowiedzieć na to pytanie, musimy ocenić sposób, w jaki podstawnik tlenowy oddziałuje z pierścieniem benzenowym. Jak zauważono w naszym wcześniejszym opracowaniu dotyczącym reakcji elektrofilowego podstawienia aromatycznego, podstawnik tlenowy zwiększa reaktywność pierścienia i sprzyja atakowi elektrofilowemu w miejscach orto i para. Zaproponowano, że za ten efekt podstawnika odpowiedzialna jest rezonansowa delokalizacja pary elektronowej niezwiązanej z tlenem do układu pi-elektronowego pierścienia aromatycznego. Podobny zestaw struktur rezonansowych dla anionu fenolanowego sprzężonej bazy pojawia się poniżej struktur fenolu.
Stabilizacja rezonansowa w tych dwóch przypadkach jest bardzo różna. Ważną zasadą rezonansu jest to, że separacja ładunku zmniejsza znaczenie kanonicznych czynników przyczyniających się do hybrydy rezonansowej i zmniejsza ogólną stabilizację. Wszystkie struktury wchodzące w skład hybrydy fenolowej ulegają separacji ładunków, co skutkuje bardzo skromną stabilizacją tego związku. Z drugiej strony, anion fenolanowy jest już naładowany, a czynniki kanoniczne działają w celu rozproszenia ładunku, co skutkuje znaczną stabilizacją tego gatunku. Sprzężone zasady prostych alkoholi nie są stabilizowane przez delokalizację ładunku, więc kwasowość tych związków jest podobna do kwasowości wody. Diagram energetyczny pokazujący wpływ rezonansu na kwasowość cykloheksanolu i fenolu jest pokazany po prawej stronie. Ponieważ rezonansowa stabilizacja sprzężonej zasady fenolanowej jest znacznie większa niż stabilizacja samego fenolu, kwasowość fenolu w stosunku do cykloheksanolu jest zwiększona. Dowody na to, że ujemny ładunek fenolanu jest zdelokalizowany na orto- i para-węglach pierścienia benzenowego pochodzą z wpływu podstawników odbierających elektrony w tych miejscach.

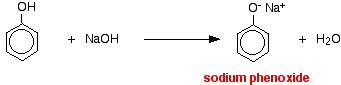
W tej reakcji jon wodorowy został usunięty przez silnie zasadowy jon wodorotlenkowy w roztworze wodorotlenku sodu.
Kwasy reagują z bardziej reaktywnymi metalami dając wodór gazowy. Fenol nie jest wyjątkiem – jedyną różnicą jest powolna reakcja, ponieważ fenol jest tak słabym kwasem. Fenol ogrzewa się w suchej probówce aż do uzyskania stanu stopionego, a następnie dodaje się niewielki kawałek sodu. W trakcie reakcji wydziela się gazowy wodór. Mieszanina pozostała w probówce będzie zawierała fenoksyd sodu.

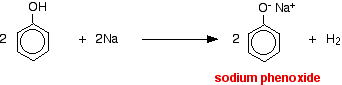
.