Ciência > Química > Elementos da Terceira Linha > Conceito de Ligação Metálica e Sólidos Metálicos
Neste artigo, estudaremos o conceito de ligação metálica e ligações metálicas em cristais de sódio, magnésio e alumínio.
Conceito de Ligação Metálica:
A ligação metálica é definida como a força de atração que liga os cátions metálicos a um número de elétrons móveis ou deslocalizados dentro de sua esfera de influência que mantém os cátions metálicos juntos em um padrão definido. Para explicar a natureza da ligação metálica, muitas teorias foram propostas. A teoria dos electrões livres ou teoria dos electrões marinhos é uma das teorias mais simples propostas por Drude e Lorentz. Alguns dos postulados importantes desta teoria são os seguintes:
Teoria da Ligação Metálica Livre de Electrões:
Atomos metálicos têm menos número de electrões de valência, por isso têm muitos orbitais de valência vagos. Na, Mg e Al têm 3p orbitais vazios.
| Nome | Símbolo | Nº Atómico. | Configuração electrónica | Configuração detalhada |
| Sódio | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnésio | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Alumínio | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Os valores potenciais de ionização dos metais são baixos, portanto os elétrons de valência são soltos e podem ser facilmente removidos. A estrutura do cristal metálico, estreitamente embalado, consiste nos átomos do metal que são idênticos em todos os aspectos.
Os orbitais desocupados dos átomos do metal, estreitamente embalados, sobrepõem-se ao orbital semelhante dos átomos adjacentes através da malha do cristal. Os electrões de valência retirados das suas órbitas e podem mover-se livremente de órbitas de valência vazias de um átomo para outro. Como estes elétrons de valência não pertencem a nenhum átomo individual, mas ao cristal como um todo, são chamados elétrons deslocados ou móveis. Os íons metálicos (cátions) produzidos devido à deslocalização são chamados de núcleos. Os íons metálicos têm posições fixas na malha de cristal enquanto os elétrons deslocados são livres para se moverem na malha de cristal. Assim, o metal pode ser considerado como um agregado de cátions metálicos imersos num mar de elétrons móveis.
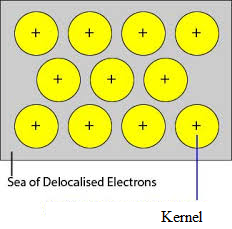
Desde que os elétrons nos metais são deslocalizados, assume-se que eles estão uniformemente distribuídos ao longo da estrutura cristalina. As forças de atração entre os íons metálicos e os elétrons deslocalizados são uniformes em toda a direção. Assim a ligação metálica é não-direcional.
As unidades que ocupam os pontos da malha em Sódio, Magnésio, Alumínio são íons positivos deles respectivamente e são cercados por elétrons móveis. Assim, Sódio, Magnésio e Alumínio são sólidos metálicos.
As propriedades como condutividade elétrica e térmica, brilho metálico, maleabilidade e ductilidade podem ser explicadas com base na teoria dos elétrons livres.
Características das ligações metálicas:
- A ligação metálica é definida como a força de atração que liga os cátions metálicos a um número de elétrons móveis ou deslocalizados dentro da sua esfera de influência que mantém os cátions metálicos juntos em um padrão definido.
- A ligação metálica não é direccional.
- São mais fracos que a ligação covalente mas mais fortes que as forças de van der Waal.
- As ligações não são rígidas.
- A força da ligação metálica está directamente relacionada com a carga positiva sobre o ião metálico. Assim a força da ligação metálica aumenta conforme Na < Mg < Al.
Sólidos metálicos:
Sólidos metálicos são sólidos cristalinos nos quais as unidades que ocupam pontos de malha são íons positivos rodeados por uma piscina de elétrons. (Conceito de ligação metálica)
Estruturas Cristalinas de Metais:
Análise de raios X de diferentes cristais metálicos mostraram que os metais adotam uma das seguintes estruturas cristalinas.
- Estrutura cúbica centrada no corpo. (BCC)
- Estrutura cúbica centrada na face. (FCC)
- Estrutura hexagonal fechada. (HCP)
Sódio (Na):
Metal de sódio tem estrutura cúbica centrada no corpo (BCC) de cristal aberto. A colagem é a colagem metálica não direcional.
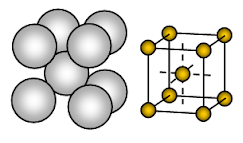
O arranjo de íons em um plano – Estrutura cúbica – aberta ou quadrada embalada. Neste arranjo, cada íon metálico está tocando quatro íons adjacentes em um plano. A sequência das camadas é AB, AB, AB, ……….
Sódio é um sólido metálico. Na célula unitária de sódio, cada íon de sódio é rodeado por outros oito íons de sódio equidistantes. Assim o número de coordenação é 8. Esses íons de sódio estão dispostos nos cantos de um cubo imaginário e no centro do cubo, um íon de sódio está presente. Há 2 íons presentes em uma unidade de célula de sódio.
Os íons sódio ocupam apenas cerca de 68% do espaço disponível em uma unidade de célula. Portanto, 32% da célula unitária permanece vazia (vazia). Como esta estrutura tem mais espaço vazio, os metais que adotam esta estrutura são macios. O sódio é assim metal macio por causa de mais espaço vazio (cerca de 32%) em sua estrutura cristalina e uma ligação metálica bastante fraca devido a apenas um elétron de valência por átomo de Na em seu cristal.
Magnésio (Mg):
Magnésio tem uma estrutura cristalina hexagonal fechada (HCP). A ligação é metálica não direcional.
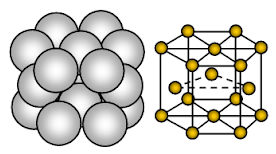
Magnésio é sólido metálico. As unidades que ocupam os locais da malha são íons Mg e estes íons são cercados por elétrons móveis ou deslocalizados.
A disposição dos íons em um plano a disposição dos íons é uma matriz hexagonal ou uma camada de embalagem fechada. Assim, cada íon metálico está tocando seis íons adjacentes em um plano. Cada íon de magnésio toca em seis íons de magnésio em sua própria camada, três na camada acima e três na camada abaixo. Na estrutura embalada hexagonal, as camadas fechadas de íons são empilhadas em uma seqüência alternada normalmente chamada AB ABA ….. Cada terceira camada de íons é exatamente a mesma e fica diretamente acima da primeira camada.
Cada átomo de Mg é cercado por 12 outros íons Mg equidistantes. Portanto, o número de coordenação é 12. Na célula da unidade, cerca de 26% do espaço disponível está vazio (vazio). Esta estrutura está mais próxima do espaço vazio. Devido a menos espaço vazio na estrutura cristalina, mais nuvem de elétrons devido ao Mg+2 e forte ligação metálica, o magnésio é mais duro que o metal de sódio. É mais maleável e dúctil que o sódio.
Alumínio (Al):
Alumínio tem uma estrutura cristalina centrada na face (FCC). A ligação é metálica não direcional.

Alumínio é sólido metálico. As unidades que ocupam os locais da malha são íons Al e estes íons são cercados por elétrons móveis ou deslocalizados.
A disposição dos íons em um plano a disposição dos íons é uma matriz hexagonal ou uma camada de embalagem fechada. Assim, cada íon metálico está tocando seis íons adjacentes em um plano.
Em uma estrutura de cristal cúbico fechado ou centrado na face, a sequência de camadas de íons fechadas repete a cada quarta camada. Ou seja, cada quarta camada de íons é exatamente a mesma e está diretamente acima da primeira camada. É assim chamado de ABC, ABC, ABC, ….. embalagem fechada cúbica. A embalagem cúbica fechada também é chamada de estrutura centrada na face, porque se vista de um ângulo particular, os iões podem ser considerados como estando nos oito cantos do cubo e no centro de cada uma das seis faces do cubo, ou seja, célula unitária.
Cada ião de alumínio (Al+3) é rodeado por 12 outros átomos de alumínio equidistantes. Assim, o número de coordenação é 12. Na célula unitária de alumínio, cerca de 26% do espaço disponível está vazio (vazio). Devido ao menor espaço vazio na estrutura cristalina, forte ligação metálica, o alumínio é mais duro, maleável e dúctil que o sódio e o magnésio.
Silício (Si):
Sólidos covalentes são sólidos cristalinos em que os pontos da malha unitária são átomos. A maior força de ligação é a ligação covalente entre os átomos. O silício é um sólido covalente em que os pontos da grelha são ocupados pelos átomos do elemento. O silício é um sólido de rede. Existe uma rede de ligações Si-Si covalentes.
O número atómico do Silício é 14. A configuração electrónica do silício no seu estado de terra é 1s2, 2s22p6, 3s2 3p2. Tem quatro elétrons de valência em suas orbitais de valência. O silício sofre hibridação sp3 formando quatro orbitais hibridizados sp3 de igual energia. Cada átomo de silício forma quatro ligações covalentes com quatro outros átomos de silício vizinhos devido a SP3- SP3 Assim se forma a unidade tetraédrica Si4 que se estende para formar uma molécula gigante tridimensional.

As ligações Si -Si correm continuamente ao longo do cristal. Assim, um cristal de silício é considerado como uma molécula tridimensional gigante com uma rede tetraédrica de átomos de silício ligados entre si por fortes ligações covalentes. O sólido que contém tal estrutura é chamado de sólido de rede. O ângulo de ligação Si-Si é 109 o 28 ‘ enquanto o comprimento da ligação é 2,35 o
Due a sobreposição de orbitais híbridos, as ligações Si-Si covalentes são muito fortes e são direccionais. A presença de rede de ligações fortes covalentes é responsável pela dureza e pelo seu elevado ponto de fusão.
Os electrões da ligação covalente estão localizados, pelo que o silício não é um bom condutor de electricidade e calor. Mas é um semicondutor. Devido à indisponibilidade de elétrons livres, o silício é um isolante à temperatura zero absoluta. No entanto, o silício é um semicondutor. Se a temperatura for aumentada, ligações covalentes quebram elétrons livres que podem conduzir eletricidade. Assim a condutividade aumenta com o aumento da temperatura.