O elemento químico carbono é classificado como um não metálico. Ele é conhecido desde a antiguidade. O seu descobridor e data de descoberta são desconhecidos.

Zona de dados
| Classificação: | Carbono é um não-metal |
| Cor: | Preto (grafite), transparente (diamante) |
| Peso atómico: | 12.011 |
| Estado: | sólido: |
| Ponto de fusão: | 3550 oC, 3823 K |
| Nota: À pressão atmosférica normal, o carbono não derrete quando aquecido, ele sublima. Ou seja, ele sofre uma mudança de fase diretamente do sólido para o gás. Se a pressão for aumentada para 10 atmosferas, o carbono (grafite) funde a 3550 °C. | |
| Ponto de ebulição: | 3825 oC, 4098 K |
| O ponto de ebulição citado é registrado quando a pressão do vapor de grafite acima da sublimação da grafite atinge 1 atmosfera. | |
| Electrões: | >6 |
| Protões: | 6 |
| Neutrons em isótopos mais abundantes: | >6 |
| Conchas de electrões: | 2,4 |
| Configuração de electrões: | 1s2 2s2 2p2 |
| Densidade @ 20oC: | 2.267 g/cm3 (gr), 3,513 g/cm3 (di) |
Mostrar mais, incluindo: Aquecimento, Energias, Oxidação, Reações,
Compostos, Raios, Condutividades
| Volume atômico: | 5,31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Estrutura: | camadas hexagonais (grafite), tetraédricas (diamante) |
| Dureza: | 0,5 mohs (grafite), 10,0 mohs (diamante) |
| Capacidade térmica específica | 0,71 J g-1 K-1 (grafite), 0.5091 J g-1 K-1 (diamante) |
| Calor de fusão | 117 kJ mol-1 (grafite), |
| Calor de atomização | 717 kJ mol-1 |
| Calor de vaporização | 710.9 kJ mol-1 |
| 1ª energia de ionização | 1086.5 kJ mol-1 |
| 2ª energia de ionização | 2352.6 kJ mol-1 |
| 3ª energia de ionização | 4620.5 kJ mol-1 |
| afinidade electrónica | 121.55 kJ mol-1 |
| Número mínimo de oxidação | -4 |
| Número mínimo de oxidação comum. | -4 |
| Número máximo de oxidação | 4 |
| Número máximo de oxidação comum. | 4 |
| Electronegatividade (Escala de Paulagem) | 2.55 |
| Volume de Polarização | 1.8 Å3 |
| Reacção com ar | vigorosa, ⇒ CO2 |
| Reacção com 15 M HNO3 | suave, c/ht ⇒ C6(CO2H)6 (ácido melítico/gráfico) |
| Reacção com HCl 6 M | nenhum |
| Reacção com NaOH 6 M | nenhum |
| Óxido(s) | CO , CO2 |
| Hidreto(s) | CH4 e muitos CxHy |
| Cloreto(s) | CCl4 |
| Raio atómico | 70 pm |
| Raio iónico (1+ião) | – |
| Raio iónico (2+ião) | – |
| Raio iónico (3+ião) | – |
| Raio iónico (1- ião) | – |
| Raio iónico (2-ião) | – |
| Raio iónico (3-ião) | – |
| Condutividade térmica | 25-470 W m-1 K-1 (grafite), 470 W m-1 K-1 (diamante) |
| Condutividade eléctrica | 0.07 x 106 S m-1 |
| Ponto de fusão/congelação: | 3550 oC, 3823 K |

Modelos de estrutura nanotubular de carbono.

Lavoisier usando uma lente gigante em experiências de combustão
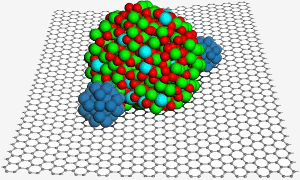
A superfície de grafeno hospeda uma nanopartícula de óxido de estanho índico, que ajuda a fixar duas nanopartículas de platina (azul) para uma melhor catálise numa célula de combustível. Imagem: PNL.
Descoberta de Carbono
O carbono é conhecido desde os tempos antigos na forma de fuligem, carvão, grafite e diamantes. As culturas antigas não percebiam, é claro, que estas substâncias eram diferentes formas do mesmo elemento
Cientista francês Antoine Lavoisier chamado carbono e ele realizou uma variedade de experiências para revelar a sua natureza.
Em 1772 ele juntou recursos com outros químicos para comprar um diamante, que eles colocaram num frasco de vidro fechado. Eles focalizaram os raios solares no diamante com uma lupa gigante notável e viram o diamante queimar e desaparecer.
Lavoisier notou que o peso total do frasco não foi alterado e que quando queimou, o diamante tinha combinado com oxigênio para formar dióxido de carbono. (1), (2) Ele concluiu que o diamante e o carvão vegetal eram feitos do mesmo elemento – o carbono.
Em 1779, o cientista sueco Carl Scheele mostrou que o grafite queimou para formar dióxido de carbono e assim deve ser outra forma de carbono.(3)
Em 1796, o químico inglês Smithson Tennant estabeleceu que o diamante era puro carbono e não um composto de carbono; ele queimou para formar apenas dióxido de carbono.
Tennant também provou que quando se queimavam pesos iguais de carvão e diamantes, eles produziam a mesma quantidade de dióxido de carbono. (4)
Em 1855, o químico inglês Benjamin Brodie produziu grafite pura a partir do carbono, provando que a grafite era uma forma de carbono.(4)
Apesar de ter sido previamente tentado sem sucesso, em 1955 o cientista americano Francis Bundy e colegas de trabalho da General Electric finalmente demonstraram que a grafite podia ser transformada em diamante a alta temperatura e alta pressão.(5)
Em 1985, Robert Curl, Harry Kroto e Richard Smalley descobriram fullerenes, uma nova forma de carbono em que os átomos são dispostos em formas de bola de futebol. O fullerene mais conhecido é o buckminsterfullerene, também conhecido como C60, que consiste em 60 átomos de carbono. Existe uma grande família de fullerenes, começando em C20 e atingindo até C540. (6), (7)
A allotrope de carbono mais recentemente descoberta é o grafeno, que consiste numa única camada de átomos de carbono dispostos em hexágonos. Se estas camadas fossem empilhadas umas sobre as outras, grafite seria o resultado. O grafeno tem uma espessura de apenas um átomo.
A descoberta do grafeno foi anunciada em 2004 por Kostya Novoselov e Andre Geim, que usaram fita adesiva para separar uma única camada de átomos de grafite para produzir a nova alotrópica.
Fatos interessantes sobre o carbono
- Sobre 20% do peso dos organismos vivos é carbono.
- Mais compostos são conhecidos que contêm carbono do que não contêm.
- O carbono é o quarto elemento mais abundante no universo.
- Apesar da sua alta abundância, devemos a existência do carbono a um conjunto improvável de circunstâncias
- O Diamante é um excelente abrasivo porque é o material mais duro comum e também tem a maior condutividade térmica. Ele pode moer qualquer substância, enquanto o calor gerado pelo atrito é rapidamente conduzido para longe.
- Os átomos de carbono no seu corpo foram todos uma vez parte da fração de dióxido de carbono da atmosfera.
- O grafeno é o material mais fino e forte jamais conhecido.
- O grafeno é feito de cristais atómicos bidimensionais, a primeira vez que tais estruturas foram vistas.
- O grafito num lápis mecânico típico tem um diâmetro de 0,7 mm. Isto é igual a 2 milhões de camadas de grafeno.
- Os pneus de carro são pretos porque são cerca de 30% de negro de fumo, que é adicionado à borracha para reforçá-la. O preto de carbono também ajuda a proteger contra danos UV nos pneus.(8)
- Carbono é feito dentro das estrelas quando queimam hélio em reações de fusão nuclear. O carbono é parte da ‘cinza’ formada pela queima de hélio.
- O carbono sofre reações de fusão nuclear em estrelas pesadas para fazer néon, magnésio e oxigênio.




Esquerda: Combustão de carvão (principalmente carbono amorfo) no ar. Direita: Diamantes (carbono cristalino). Pensamos em tirar uma foto de diamantes em combustão – eles queimam a cerca de 800oC – mas não podíamos pagar!

Formas de vida baseadas em carbono, como estas, dominam o nosso planeta.

DNA. A famosa molécula de dupla hélice é possível pela capacidade do carbono de formar longas cadeias moleculares.
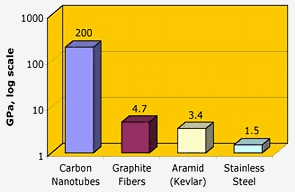
Nasa: Os nanotubos de carbono têm uma resistência à tracção excepcional – duas ordens de magnitude superior às fibras de grafite, kevlar ou aço.
Bairro da Tabela Periódica do Carbono
| Grupo 13 |
Grupo 14 |
Grupo 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
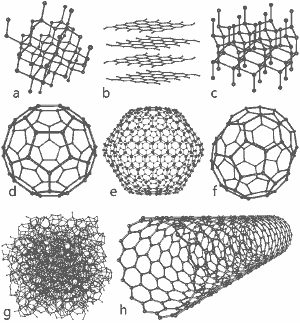
Uma imagem maravilhosa lançada por Michael Ströck sob a Licença de Documentação Livre GNU: As estruturas de oito alotrópodes de carbono: a) Diamante b) Grafite c) Lonsdaleite d) C60 (Buckminsterfullerene) e) C540 Fullerene f) C70 Fullerene g) Carbono amorfo h) Nanotubo de carbono de parede única. Clique aqui para ampliar a imagem.
Aspecto e Características
Efeitos nocivos:
O carbono puro tem uma toxicidade muito baixa. A inalação de grandes quantidades de pó de negro de fumo (fuligem/poeira de carvão) pode causar irritação e danos nos pulmões.
Características:
O carbono pode existir com várias estruturas tridimensionais diferentes nas quais os seus átomos estão dispostos de forma diferente (allotropes).
Três alotrópodes cristalinos comuns são grafite, diamante, e (geralmente) fulerenos. O grafeno tem uma estrutura cristalina 2D.(Fulerenos podem às vezes existir na forma amorfa.)(9)
O carbono também pode existir em estado amorfo. Muitas alotrópodes comumente descritas como amorfas, no entanto, como carbono vítreo, fuligem ou negro-de-fumo geralmente têm estrutura suficiente para não serem verdadeiramente amorfas. Embora tenham sido observados nanotubos cristalinos, eles são geralmente amorfos.(10)
As estruturas de oito alotrópodes são mostradas no final desta página.
Curiosamente, a grafite é uma das substâncias mais macias e o diamante era considerado, até recentemente, a substância mais dura que ocorre naturalmente.
Uma allotropo de carbono, lonsdaleite, extremamente rara, foi calculada, em forma pura, como sendo 58% mais forte que o diamante. Lonsdaleite é uma rede de carbono semelhante a um diamante que tem uma estrutura hexagonal de grafite. Ela é feita quando meteoritos contendo grafite atingem outro corpo, como a Terra. As altas temperaturas e pressões do impacto transformam o grafite em lonsdaleite.
O carbono tem o maior ponto de fusão/sublimação de todos os elementos e, na forma de diamante, tem a maior condutividade térmica de qualquer elemento.
A alta condutividade térmica do diamante é a origem do termo calão ‘gelo’. Em temperaturas ambientes típicas, a temperatura do seu corpo é mais alta do que a do ambiente – incluindo quaisquer diamantes grandes que você possa ter por acaso. Se você tocar em qualquer um desses diamantes, sua alta condutividade térmica leva o calor para longe de sua pele mais rapidamente do que qualquer outro material. O seu cérebro interpreta esta rápida transferência de energia térmica para longe da sua pele como significando que está a tocar em algo muito frio – por isso os diamantes à temperatura ambiente podem sentir-se como gelo.
Usos de carbono
Carbono (na forma de carvão, que é principalmente carbono) é usado como combustível.
Grafite é usado para pontas de lápis, cadinhos de alta temperatura, células secas, eléctrodos e como lubrificante.
Diamantes são usados em jóias e – por serem tão duros – na indústria para corte, perfuração, moagem e polimento.
Negro de fumo é usado como pigmento preto na tinta de impressão.
Carbono pode formar ligas com ferro, das quais a mais comum é o aço carbono.
O isótopo radioativo 14C é usado em datação arqueológica.
Os compostos de carbono são importantes em muitas áreas da indústria química – o carbono forma um vasto número de compostos com hidrogênio, oxigênio, nitrogênio e outros elementos.
Abundância e Isótopos
Abundância da crosta terrestre: 200 partes por milhão em peso, 344 partes por milhão por moles
Abundância do sistema solar: 3000 partes por milhão por peso, 300 partes por milhão por toupeiras
Custo, puro: $2.4 por 100g
Custo, grosso: $ por 100g
Fonte: O carbono pode ser obtido pela queima de compostos orgânicos com oxigênio insuficiente. Os quatro principais alotrópodes de carbono são grafite, diamante, carbono amorfo e fullerenes.
Diamantes naturais são encontrados em kimberlitos de antigos vulcões.
Grafite também pode ser encontrada em depósitos naturais.
Fullerenes foram descobertos como subprodutos de experimentos com feixes moleculares nos anos 80.
Carbono amorfo é o principal constituinte do carvão vegetal, fuligem (negro de fumo), e carbono ativado.
Isótopos: 13 cujas meias-vidas são conhecidas, com números de massa de 8 a 20. O carbono que ocorre naturalmente é uma mistura de dois isótopos e são encontrados nas percentagens apresentadas: 12C (99%) e 13C (1%).
Isotopo 14C, com uma meia-vida de 5730 anos, é amplamente utilizado para datar materiais carbonáceos como madeira, espécimes arqueológicos, etc. para idades até cerca de 40 000 anos.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide., (2006) p192. Greenwood Publishing Group
- Mary Elvira Weeks, The discovery of the elements. I. Elementos conhecidos do mundo antigo, J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Minerais industriais & rochas: commodities, mercados, e usos, (2006) p507. SME.
- Amanda S. Barnard, The diamond formula: diamond synthesis-a gemological perspective., (2000) p3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers., (1999) p145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) p423. Wiley.
- Prémio Nobel da Química, 1996
- O que é preciso para fazer um pneu?
- Ming Gao e Hui Zhang, Preparação de um filme amorfo de fullerene, Physics Letters A Volume 213, Edições 3-4, 22 de Abril de 1996, Páginas 203-206
- Ron Dagani, Nanotube Magic, Materials Research , 16 de Abril de 2001 Volume 79, Número 16 CENEAR 79 16 pp.6.
Cite esta página
Para criar um link online, por favor copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
ou
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Para citar esta página em um documento acadêmico, por favor use a seguinte citação compatível com a MLA:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.