Cuvintele cheie
hipermobilitate, displazia țesutului conjunctiv, sindromul ehlers-danlos, scala beighton, disautonomie, sindromul de tahicardie ortostatică posturală, sindromul intestinului iritabil, tulburarea de activare a mastocitelor, displazia articulo-autonomică
Introducere
Mult prea puțin recunoscuți și tragic de prost tratați sunt cei 20% dintre femei și 10% dintre bărbați ale căror țesuturi sunt mai flexibile și mai fragile decât media . Puține oportunități de prevenire și tratament o depășesc pe cea a recunoașterii hipermobilității, ușor de depistat cerându-i pacientului să își împingă degetul mare împotriva antebrațului (figura 1). Acest semn revelator poate indica drumul către o evaluare mai detaliată, care se află în sfera de competență a medicului generalist, cunoștințele clinice vaste ale acestuia potrivindu-se bine cu problemele multisistemice care pot apărea din cauza țesutului conjunctiv lax. Aici trec în revistă natura tulburărilor de hipermobilitate, demonstrez că cunoștințele generale, mai degrabă decât cele de subspecialitate, pot duce la terapii care să le schimbe viața acestor pacienți și arăt cum testele genetice aduc descrieri simptomatice precum fibromialgia sau sindromul de oboseală cronică în lumina discernitoare a medicinei de precizie.
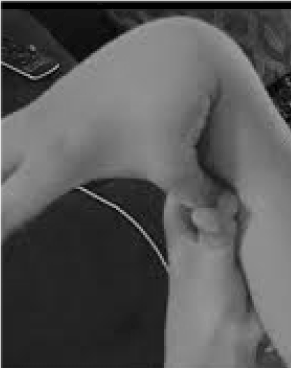
Figură 1. Hipermobilitate.
Câteva bariere trebuie depășite înainte ca pacienții cu hipermobilitate să poată beneficia de avantajele medicinei generale. Prima derivă implică accentul de pionierat, dar miop al dermatologilor Ehlers și Danlos care imprimă întinderea incredibilă și exotică a pielii ca simbol înșelător al tulburărilor de laxitate a țesutului conjunctiv. O a doua barieră este prăpastia tot mai mare dintre medicina practică și cea genetică, prima concentrându-se în mod corespunzător pe bolile comune, în timp ce cea de-a doua, până de curând, folosea tehnologia specializată pentru a le descrie pe cele rare. Eponimele obscure, cu subtipuri și termeni tehnici descurajanți, sunt ca niște mici provincii ale unei țări străine neprimitoare pe care niciun călător global nu-și va face timp să le cartografieze. Contracararea acestor obstacole este o abordare practică a tulburărilor de hipermobilitate care se concentrează pe recunoașterea prin anamneză și examen fizic, lăsând aspectele tehnice ale eponimelor, subtipurilor și testelor genetice pe seama subspecialiștilor contactați după primul pas vital al diagnosticului prezumtiv. Odată recunoscut și îndrumat, pacientul flexibil rămâne dependent de medicul său primar, deoarece numai acesta poate integra recomandările și rezultatele testelor în cadrul căminului medical general.
Terminologie
Creșterea amplitudinii de mișcare la mai multe locuri de articulare (articulații) apare într-un număr mare de boli, de la tulburări cromozomiale, cum ar fi sindromul Down, până la tulburări precum sindromul Ehlers-Danlos (EDS), cunoscute pentru hipermobilitatea lor. McKusick a popularizat această categorie de afecțiuni cunoscute pentru laxitatea tisulară, grupându-le sub denumirea de afecțiuni ereditare ale țesutului conjunctiv, inclusiv sindromul Marfan asupra căruia s-a concentrat în calitate de cardiolog. În 1977, Dr. Peter Beighton, cunoscut pentru scara sa de măsurare a flexibilității, a organizat literatura de specialitate intervenită prin postularea a 6-7 tipuri de EDS, acum simplificate de ghidurile recente ca EDS clasic, vascular și hipermobil . Acum este clar că aceste tipuri au o suprapunere considerabilă a simptomelor între ele și a tulburărilor înrudite, cum ar fi osteogeneza imperfectă (cu numeroase fracturi), sindromul Marfan (dilatarea/dizecție a vaselor mari), sindromul Stickler (modificări oculare și artritice) și multe altele.
În loc să fiu preocupat de anumite boli, consider că este mai util să mă concentrez asupra a două procese majore de boală din displaziile țesutului conjunctiv, ilustrate de numeroasele simptome enumerate în tabelul 1. Prima este durerea articulară de uzură (osteoartrita) care diferă de articulațiile umflate și roșii ale artritei inflamatorii (autoimune sau inflamatorii) întâlnite în artrita reumatoidă, lupus, sindromul Sjogren sau spondilita anchilozantă. În al doilea rând, este dezechilibrul sistemului nervos autonom (disautonomie) cauzat de vasele de sânge elastice din tulburările de hipermobilitate . Vasele distensibile determină acumularea sângelui în pelvis și în picioare, cu scăderea tensiunii arteriale și amețeli/falseală în picioare (hipotensiune ortostatică). În timp, scăderea fluxului sanguin la nivelul capului activează brațul simpatic al sistemului nervos autonom (brațul „fuga sau lupta” al adrenalinei), ceea ce duce la mai multe probleme: 1) sindromul de tahicardie ortostatică posturală (POTS) cu tahicardie, anxietate, oboseală cronică și „ceață cerebrală” (intervale de diminuare a concentrării și memoriei), 2) sindromul colonului iritabil datorat inhibării motilității intestinale (supresie parasimpatică) cu constipație care alternează cu diaree, balonare, reflux, dureri de stomac, disfagie, greață și 3) tulburare de activare a mastocitelor cu erupții cutanate trecătoare, urticarie/piele reactivă, astm/respirație dificilă și intoleranțe la alimente/medicamente. Am conceput un termen mai larg care facilitează recunoașterea oricărei tulburări de hipermobilitate, recunoscând cele două consecințe principale ale laxității articulare/țesutale: displazia articulo-autonomică sau complexul articulație-fatigă.
Tabel 1. Constatări tipice și frecvența lor în sindroamele de hipermobilitate. *Din 320 de pacienți de sex feminin și 54 de pacienți de sex masculin cu vârsta peste 12 ani, evaluați prin chestionare detaliate în 2017; ATM, articulația temporomandibulară; POTS, sindromul de tahicardie ortostatică posturală. Listă de simptome adaptată parțial din Wilson GN, Cooley WC: Preventive Health Care for Children with Genetic Condition: Providing a Medical Home. Ediția a 2-a. Cambridge, MA. Cambridge University Press, 2006.
HISTORIE (procente)*
Infanță: Colici (28), dificultăți de hrănire (19,4); neîndemânatic, multe căzături (29,1)
Copil/ adolescent: Creștere lentă în greutate (12); conștient de flexibilitate (55,6); s-a dat mare cu trucuri articulare (53,6)
dureri articulare timpurii (42,1); activități ale adolescentului limitate de dureri-leziuni (55,4); ochelari timpurii (46,8)
ortodonție (61,4%) boli gingivale (11,3); smalț slab/multe carii (31,6)
Probleme articulare: pocnituri (81,6); subluxații (62); pocnituri, prinderi, dureri în ATM (51,2)
dureri în cel puțin 2 articulații (80,3); operații articulare (33); multe entorse (26); fracturi >2 (31,5)
hernie de disc la nivelul coloanei vertebrale (29,3)
Probleme scheletice: Scolioză (31); pectus (2,2); mers – mers înăuntru/afară (9,3); picioare plate (15,5)
Pielea: Vânătăi ușoare (61); piele elastică (15); catifelată (18); cicatrici neobișnuite (36,3)
striații înainte de sarcină (73); vindecare lentă (32,4)
Genitourinare (femei): Menoragie (61,2); endometrioză (11,3); chisturi ovariene (55)
sindromul ovarelor polichistice (8,5); probleme cu vezica urinară (46,1); hernie inghinală/femurală (11,5)
Neuromusculare: Migrene (51,7); dureri de cap zilnice (62,3); a avut nevoie de medicamente pentru dureri de cap (45)
Deformare Chiari (10,6); neurochirurgie (2,9); amorțeală/înțepături (48,7); echilibru deficitar (48,6)
dureri de împușcături neuropatice (37,3); dureri musculare/spasme (51,7); slăbiciune musculară (32,4)
GI/bolțuri: Constipație-diaree (67,1); balonare-reflux-dureri stomacale (57,3)
probleme cu vezica biliară (12,9); înghițituri dificile (23); greață frecventă (44,9)
Ceafă: Prolapsul valvei mitrale (8,7); anevrism (0,9); aritmie, alta decât tahicardia (6,8)
POTS: Amețeli la ridicarea în picioare (69,8); sincopă (34,5); oboseală cronică (81,8); dificultăți de somn (43,5)
ceață cerebrală (memorie sau concentrare slabă uneori-70,8); sensibilitate la căldură/frig (77,5); transpirație anormală (25); tahicardie (72,8); atacuri de anxietate-panică (61,3); fantezie cu sare (51,2)
Imunitate/celule de mase: Erupții cutanate tranzitorii (33,4%); urticarie/piele reactivă (45,9%); astm/stres respirator (39,3); intoleranțe la alimente-medicamente (61,5%)
Laborator/Imagistică: Densitate osoasă scăzută (2,1); vitamina D scăzută (28,7); vitamina B12 scăzută (2,7); hipotiroidie (11,5); feritină scăzută (1,7); fier scăzut (6,7); anticorpi antinucleari crescuți (7.1)
Numărul mediu de constatări din 80: femei >12 (35,4 constatări) bărbați >12 (21,5 constatări)
Fizic (procentual)
Buc: Tall-height >90th percentile (55,2); heavy-BMI >28 (21,3); thin-BMI <19 (14,2)
Habitus marfanoid (44); arachnodactilie (46,4); semnul Walker-Murdoch prezent (40,2)
Face: Lungă (25,7); partea inferioară a feței strânsă (5,4); sclera albastră-cenușie (1,6); palat înalt (53,5)
Piatra: Moale (81,4); translucidă (23,8); elastică-lift >Pliu de 1 inch în jurul maxilarului pe mijlocul antebrațului (51,3)
Pliurile constau din stratul exterior (epidermic) (35.4); cicatrici neobișnuite (42,1%)
Scoring Beighton: 0-3 puncte (8,4); 4-6 puncte (32,6); 7-8 puncte (38,8); 9 din 9 puncte (20,2)
Alte manevre: Unirea mâinilor peste umăr-în spatele spatelui (68)
semnul rugăciunii în sus în spatele spatelui (71,3); aducerea mâinii în jurul spatelui pentru a atinge ombilicul (19,5)
Scheletul: Cifoza gâtului (41,2); scolioză (22,3); lordoză (32,8); picioare plate (39,6)
mers – mers înăuntru sau afară (28,3)
Neurologic: Slăbiciune musculară (11,2); scăderea masei musculare (8,8)
echilibru deficitar prin mers în tandem (33,4)
Număr mediu de constatări din 40: femei >12 (17,9 constatări) bărbați >12 (15.7 constatări)
Displazia articulo-autonomică (DAA)
Un termen precum „displazie articulo-autonomică” sau DAA poate unifica abordarea tulburărilor de laxitate a țesutului conjunctiv/hipermobilitate și poate contracara trei probleme care complică recunoașterea lor: 1) mulți medici și geneticieni privesc displaziile țesutului conjunctiv ca pe niște boli rare și extreme, când, de fapt, acestea afectează aproximativ 1% din populație 2) ghidurile de diagnosticare a SED , deși simplifică tipurile majore de SED ca fiind clasice, vasculare și de hipermobilitate, încă mai creează confuzie prin referirea la multe tipuri minore care formează un spectru de simptome care se suprapun și 3) disautonomia aproape obligatorie care însoțește SED și tulburările înrudite (tabelul 1) este omisă ca și criteriu de diagnostic, analog cu descrierea unui elefant fără a-i menționa trompa. AAD denotă legătura fiziologică inevitabilă dintre țesutul liber și disautonomie în același mod în care sindroamele metabolice sau hepatorenale descriu modul în care obezitatea duce la boala hepatică/diabet sau insuficiența hepatică determină boala renală.
Ca majoritatea tiparelor sau sindroamelor medicale, inclusiv EDS, AAD este un complex de simptome cu multe cauze subiacente. „Articulo” se referă la articulație, recunoscând că afectarea oricărei componente articulare – piele, nerv, mușchi, os, țesut conjunctiv, vas de sânge – cauzează un model similar de laxitate a țesutului articular cu dezechilibru autonom. Vor exista fragilitate cutanată, densitate osoasă scăzută cu predispoziție la fracturi, slăbiciune musculară cu durere (mialgie), neuropatie cu amorțeală/înțepături, tunel carpian sau sindroame dureroase regionale, modificări autonome, inclusiv tahicardie, anxietate, somn nerestaurator, imotilitate intestinală, urticarie/urticarie, intoleranțe la medicamente și alimente, toate prezente în măsură variabilă chiar și în cadrul unor „tipuri” specifice de SED. Nu am găsit mari diferențe între pacienții care se încadrează în anumite tipuri de SED, ilustrate de modificările cutanate mai frecvente în cazul cEDS clasic de tip I față de o mai mare flexibilitate articulară în cazul hEDS hipermobil de tip III. Frecvențele simptomelor la 374 de pacienți înregistrați prin interogare sistematică nu au variat semnificativ între cei pe care i-am diagnosticat ca fiind cEDS versus hEDS, și chiar și cei 8 pacienți identificați ca fiind posibili vEDS vasculare prin faptul că prezentau mutații ale genei colagenului de tip III nu au fost distinctivi (anevrismele prezente la unul dintre cei 8 pacienți aveau aceeași frecvență scăzută în alte categorii de EDS). Cel mai important este conceptul de spectru EDS, cel mai bine reprezentat, în opinia mea, ca AAD.
Recunoașterea complexului de simptome AAD, cauzat de EDS și de displaziile țesutului conjunctiv înrudite, va preveni drumurile triste ale pacienților de la un specialist la altul, diagnosticele simptomatice precum vertij, leșin, fibromialgie sau oboseală cronică și suferința tragică atunci când sunt disponibile multe strategii preventive și tratamente. Mai mult, recunoașterea disautonomiei explică anxietatea provocată de POTS și depresia care însoțește frecvent durerea cronică sau limitarea activității , diferențe de comportament care pot fi recunoscute ca fiind consecințe ale unei boli medicale mai degrabă decât psihiatrice.
Testările genetice susțin conceptul de displazie articulo-autonomică
Implicit prin caracterizarea lor ca tulburări ereditare ale țesutului conjunctiv , s-a constatat că formele mai extreme ale EDS și tulburările înrudite prezintă o moștenire autosomal dominantă, ceea ce înseamnă că indivizii afectați au o formă normală și una anormală a genei (alela). Moștenirea dominantă are sens deoarece proteina defectuoasă produsă de alela anormală, analogă unei cărămizi deformate, s-ar amesteca cu cărămizile normale de la cealaltă alelă și ar face o structură șubredă. Recunoașterea articulației sau a articulației ca o structură cu mai multe componente, constrânsă de pielea suprapusă, susținută de osul și cartilajul din interior și acționând prin intermediul nervilor intrinseci, mușchiului, tendonului, căptușelii articulare și vaselor, implică, la rândul său, faptul că oricare dintre aceste elemente poate fi afectat pentru a produce displazie, o perturbare tisulară distinctă de malformațiile cauzate de alte tulburări genetice. Dezvoltarea clonării și secvențierea ADN-ului ar confirma funcționarea moștenirii autosomale dominante și capacitatea genelor care modifică orice element al structurii articulare de a provoca modelul simptomatic al DAA.
Testarea genetică a început cu un accent pe o genă „candidată” selectată din cauza simptomelor pacientului, ilustrată de testarea genei fibrilin-1 pentru sindromul Marfan . Secvențierea literelor AGCT din ADN-ul genei, „textul” nucleotidelor, ar putea dezvălui substituții sau „greșeli de scriere” care au alterat aminoacidul proteinei codificate și funcția sa preconizată. Apoi a apărut noua tehnologie numită NextGen sau secvențierea rapidă paralelă a ADN-ului, analogă cu citirea tuturor paginilor unei cărți deodată, mai degrabă decât de la un capăt la altul . Aceasta a permis secvențierea unor grupuri de gene (paneluri), cum ar fi cele care cauzează cardiomiopatia sau displazia țesutului conjunctiv sau chiar a tuturor celor 23.000 de gene din fiecare celulă umană (genomul nostru) în 2-3 luni . Secvențierea regiunilor genetice codificatoare de proteine sau exonice, numită secvențierea întregului exom (WES), poate fi comandată de la multe companii și, în practica mea, a fost obținută pentru mai puțin de 200-300 de dolari din buzunarul propriu la jumătate dintre pacienții mei (prețul de listă este de 9000 de dolari, iar suma facturată asigurărilor este de aproximativ 20.000 de dolari).
Deși interpretarea mediei de 12.000 de variante ADN detaliate de WES rămâne o problemă, diminuată de o epidemiologie în creștere a variantelor în populațiile normale și bolnave, randamentul modificărilor genetice care contribuie la simptomele AAD în rândul celor 620 de pacienți supuși WES în practica mea este de peste 60%. Pe lângă cele peste 80 de mutații ale genelor colagenului, inclusiv cele ale colagenului de tip I asociat de obicei cu osteogeneza imperfectă, colagenul de tip V asociat adesea cu EDS clasic, colagenii de tip VI, IX și XII descriși inițial cu miopatii și temutul colagen de tip III asociat cu EDS vascular, sunt mutații recurente în genele care afectează componentele cutanate, nervoase, musculare, fibrilare și vasculare care întăresc un concept de DAA în care alterarea oricărei componente articulare produce modelul de semne și simptome prezentat în tabelul 1. Recunoașterea acum a EDS și a tulburărilor înrudite înglobate în conceptul AAD poate întări impresia clinică cu dovezi ADN obiective care permit consilierea pacientului și a familiei.
Diagnosticul și terapia tulburărilor de hipermobilitate/AAD
Atenția la principalele simptome de durere/fragilitate articulară și autonomă (tulburări intestinale, cardiace, imune) poate duce la teste rapide pentru hipermobilitate, așa cum se arată în figura 1. Semnul de la degetul mare la antebraț poate prefața întreaga scală Beighton, acordând un punct bilateral pentru degetele apăsate în spate dincolo de 90 de grade pe mână, atingerea degetelor mari cu antebrațele, hiperextensia cotului cu brațele întinse, hiperextensia genunchilor pentru a forma o curbă a picioarelor în spate și 1 punct pentru capacitatea de a atinge cu palmele de podea . Un scurt studiu al simptomelor precum cele din tabelul 1 poate confirma suspiciunea, ajutat poate de includerea în examinările fizice a unora dintre evaluările enumerate în partea inferioară a tabelului 1. Rețineți că nu toți pacienții cu DAA sunt înalți sau slabi și că o parte substanțială va fi supraponderală din cauza restricțiilor de activitate din cauza durerii și a oboselii. Mulți vor avea pielea elastică, examinată prin tragerea în sus a pliurilor din jurul maxilarului sau de pe antebraț, în special atunci când acestea sunt pliurile subțiri și superficiale ale epidermei. Acumularea de țesut alb sau formarea de cheloide în jurul cicatricilor este frecventă, iar evaluarea lui Beighton sau a altor manevre de hipermobilitate enumerate în tabelul 1 poate fi utilă. Se poate observa o postură prăbușită cu curbură a gâtului în față, scolioză și lordoză, împreună cu picioare plate sau călcâi în afară (mai mult decât înăuntru) la mers. Forța musculară va fi scăzută la unii pacienți, împreună cu un echilibru deficitar prin mersul în tandem, dar generalistul cu timp limitat trebuie să se ocupe doar de câteva dintre aceste semne fizice; referirea va stabili restul.
Cel mai important va fi ortopedul familiarizat cu osteoartrita și modificările însoțitoare în EDS, cum ar fi modificările degenerative ale articulațiilor, deteriorarea cartilajului, benzi plica și regiuni de os mort. Este de dorit un ortoped experimentat și conservator care să recunoască rezultatele slabe ale intervențiilor chirurgicale de „strângere” sau de înlocuire a articulațiilor. Un cardiolog poate documenta POTS folosind testul tilt-table pentru modificări ortostatice ale ritmului cardiac și ale tensiunii arteriale, efectuând, de asemenea, studii electro- și ecocardiografice pentru a exclude dilatarea aortei sau anevrismele. Neurologia poate evalua migrenele obișnuite sau durerile de cap zilnice, deformarea Chiari care apare prin alunecarea și hernierea țesutului cerebral lax, neuropatia datorată constricției în cadrul articulațiilor laxe și modificările musculare denotate prin descrierea simptomului fibromialgie și evidențiate de modificările genetice miopatice frecvente care favorizează un nou termen de EDS miopatic . Alergologii familiarizați cu activarea mastocitelor și gastroenterologii care pot documenta motilitatea intestinală scăzută sunt completări valoroase pentru echipa de subspecialitate și nimeni nu este mai valoros decât medicul primar pentru gestionarea numeroaselor recomandări și medicamente care pot fi necesare. Deși poate părea ciudat venind din partea unui genetician, cred că evaluările de subspecialitate care duc la terapie au o cotă mai mare decât evaluarea și testarea genetică, dar aceasta din urmă poate fi utilă în dezamorsarea presupunerilor despre boala psihiatrică .
Tratamentul începe cu un program de exerciții fizice care poate fi benefic atât pentru artrita datorată hipermobilității articulare, cât și pentru disautonomia sa reflexă. Atenția la durerile articulare (durerile de creștere apar noaptea) sau la leziuni/deformități scheletice poate institui prevenția prin conștientizarea pacientului de starea sa (a se observa în tabelul 1 că mulți nu-și recunosc flexibilitatea ca fiind anormală). Leziunile provocate de uzură pot fi prevenite prin susținerea articulațiilor susceptibile, prin benzi de talie pentru susținerea spatelui și prin alegerea unor activități care protejează articulațiile, cum ar fi înotul în locul joggingului. Pacienții ar trebui să rămână activi cu ridicarea moderată de greutăți și alte activități rezonabile pentru a dezvolta mușchii din jurul articulațiilor, prevenind ciclurile de inactivitate care exacerbează oboseala cronică sau fibromialgia. Terapia fizică adecvată, managementul durerii, îndrumarea exercițiilor fizice și medicamentele anecdotice, cum ar fi preparatele pe bază de glucozamină/condroitină, i-au ajutat pe mulți, dar trebuie evitate relaxantele care înlătură protecția musculară a articulațiilor și injecțiile cu steroizi care maschează leziunile, favorizează osteoporoza/degenerarea și oferă doar o ameliorare temporară.
Principalul pilon al terapiei disautonomiei este hidratarea (8-10 pahare de lichid pe zi), sarea (în absența hipertensiunii labile) și o dietă bogată în proteine, toate acestea având ca scop creșterea volumului de lichid sanguin și îmbunătățirea circulației cerebrale. Terapia nutrițională suplimentară poate include vitamina C (2 g pe zi) vitamina D (>2000 unități pe zi, mai mult decât cele 400-800 din multivitamine), vitamina B12 (1-2,5 mg pe zi). Motilitatea intestinală scăzută sau gastropareza este ajutată prin evitarea lichidelor înainte de mese, mese mai mici și mai frecvente, probiotice, preparate enzimatice și, după spusele multora, scăderea glutenului și a produselor lactate care sunt iritanți comuni. Programele de exerciții în decubit dorsal, biofeedback și multe opțiuni de medicație sunt disponibile prin cardiologi pentru POTS (de exemplu, beta-blocante, Midodrine, Florinef), prin neurologi sau experți în managementul durerii (de exemplu, Gabapentin, Lyrica) sau prin alergologi care pot oferi protocoale antihistaminice pentru a suprima mastocitele (de exemplu, Zyrtec, Zantac, Cromolyn, Singulair). Avantajele testelor genomice, cum ar fi WES, care merg dincolo de genele cunoscute ca fiind cauza displaziei țesutului conjunctiv, sunt descoperirile noi, cum ar fi genele legate de mușchi, cunoscute acum ca fiind cauza EDS, și documentarea descoperirilor accidentale sau secundare, cum ar fi mutațiile genelor cancerului mamar-ovarian. Descoperirea genelor asociate cu simptome mai severe le permite pacienților să cunoască riscurile pentru descendenți și să aleagă strategii de diagnostic genetic prenatal sau preimplantațional compatibile cu valorile lor.
Prezentare de caz
Eve a venit la medicul ei la vârsta de 18 ani, amețită, leșinată, neliniștită și bolnavă de stomac, atât de epuizată încât se retrăgea vineri seara pentru a se odihni tot weekendul. Fusese sănătoasă, activă la gimnastică și la majorete, o fată curajoasă și inteligentă a cărei perseverență în ciuda rănilor i-a atras aplauzele antrenorilor ei. Apoi gripă din care nu și-a mai revenit niciodată, greață atât de severă încât nu mai putea mânca, pierdere în greutate, leșin în clasă, trezirea noaptea cu inima bătând cu putere, trezirea dimineața fără somn odihnitor. Eve a fost la mulți medici, chiar și la Urgențe când palpitațiile și panica îi tăiau respirația. Nimic în neregulă, în afară de stres, au spus ei, totul în mintea ei. Calmată, dar nu vindecată de pastile, munca eșuând din cauza oboselii și a confuziei, s-a întrebat dacă nu cumva a înnebunit. Nerecunoscute erau pielea ei moale și fragilă, menstruațiile dure și abundente, durerile de cap zilnice și, cel mai frapant dintre toate, hipermobilitatea pe care ea și familia ei o presupuneau normală: „Da, suntem îndoiți și cu articulații duble, nu-i așa că toată lumea este?”. ar fi răspuns Eve dacă ar fi fost întrebată.
Din fericire, Eve a căutat un nou medic primar care a putut documenta multe dintre semnele și simptomele enumerate în Tabelul I. Eve a avut colici timpurii și reflux cu dificultăți de alăptare, era foarte flexibilă, numită de mama ei bebelușul „fără oase”, iar când a crescut se așeza pe genunchi cu picioarele întinse în spatele ei (poziția „W”), spunând că era mai confortabil. La început mergea greu, cădea frecvent și părea neîndemânatică, dar în curând a devenit activă și se cățăra peste tot, făcându-și părinții să tresară punându-și un picior în jurul gâtului sau făcând cu ușurință șpagatul. Dar când a intrat în școala primară a început să se plângă de artralgie, picioarele o dureau noaptea, iar genunchii și gleznele o deranjau după activitate. Medicul pediatru i-a liniștit pe părinții ei că avea doar „dureri de creștere”, dar aceștia au devenit mai îngrijorați când a încercat să joace fotbal și își tot răsucea gleznele, o entorsă necesitând o cizmă timp de 2 luni după ce a fost constatată o fractură de stres.
Eve a trebuit să se oprească din fotbal, dar a descoperit că excela la gimnastică pe măsură ce creștea, alegând exercițiile la sol din cauza echilibrului precar pe bârnă și a tendinței de a-și smulge umărul la barele paralele. Ea a observat că articulațiile îi pocneau la mișcare și adesea le pocnea intenționat pentru că părea să elibereze tensiunea și durerea. A încercat să devină majoretă și a avut succes la manevre, dar a constatat că era prea sensibilă la căldură. Celelalte fete îi spuneau „fața de roșie” pentru că se supraîncălzea în timpul exercițiilor și obosea ușor, având adesea nevoie de o zi de odihnă după exercițiu. Problemele ei digestive au reapărut, cu constipație frecventă și dureri de stomac, simțindu-se adesea balonată și având nevoie de laxative. Până în clasa a 6-a a lipsit de la școală din cauza problemelor intestinale și a durerilor articulare, simțindu-se adesea obosită și amețită. Nu se simțea odihnită dimineața și deseori făcea sieste în weekenduri, ceea ce o îndepărta de stilul de viață activ și entuziast pe care îl avea anterior. Se simțea deseori anxioasă, fără a putea să o pună pe seama vreunui stres specific de la școală sau din familie, și a început să aibă dureri de cap dimineața, pe care credea că se datorează somnului ei slab. Părinții ei au dus-o din nou la pediatru și li s-a spus din nou că nu era nimic în neregulă, ci doar stresul școlar obișnuit.
Când avea 14 ani, Eve a avut o boală gravă asemănătoare gripei și a lipsit de la școală timp de o lună cu oboseală severă, dureri de cap, greață, vărsături și pierdere în greutate. A avut amețeli groaznice și unele dureri în piept, simțind că inima îi bătea cu putere uneori (avea palpitații). Părinții ei au cerut sfatul unui alt pediatru, iar acesta a trimis-o pe Eve la un cardiolog, care a crezut că are tahicardie din cauza stresului și a anxietății legate de boala ei. Acesta i-a administrat Evei propranolol, un beta-blocant, pentru a-i încetini ritmul cardiac, dar ea a devenit și mai obosită și acum era țintuită la pat o mare parte din zi. Durerile articulare s-au accentuat după boală și ea zăbovea în pat cea mai mare parte a zilei, fiind tristă și devenind anxioasă atunci când părinții ei încercau să o scoată afară sau să o ducă la plimbare. Aceștia au dus-o din nou la cel de-al doilea pediatru, care a trimis-o la psihiatrie și s-a început administrarea de Zoloft pentru a o ajuta cu anxietatea și depresia. După câteva zile, Eve a făcut o erupție cutanată cu urticarie și a trebuit să întrerupă acest medicament. Ea a continuat să aibă amețeli și a fost văzută de încă doi specialiști, un gastroenterolog care a crezut că ar putea avea boala celiacă și un otorinolaringolog care a diagnosticat vertij și a trimis-o la neurologie. Ea i-a spus acelui medic despre durerile de cap care emanau din spatele capului și a fost obținut un studiu RMN al capului în decubit dorsal care a fost normal.
Aprecierea diagnosticului probabil de DAA de către medicul ei primar a instituit o rundă diferită de trimiteri la subspecialități, inclusiv la neurologie, unde un studiu RMN al capului în poziție verticală a demonstrat hernierea deformării Chiari. Un cardiolog a documentat un test tilt-table anormal împreună cu o motilitate intestinală scăzută și a dovedit că anxietatea și oboseala de stres se datorau disautonomiei. Strategiile nutriționale de hidratare-sare-proteine cu conținut ridicat de proteine, împreună cu terapia cu beta-blocante și antihistaminice i-au ameliorat oboseala și simptomele intestinale și i-au diminuat durerile de cap. S-a decis că hernia Chiari de 4-5 mm nu era suficientă pentru a necesita o intervenție chirurgicală, iar managementul ei psihiatric a fost recunoscut ca tratând simptomele secundare ale unei tulburări medicale. Unii dintre subspecialiștii ei, sceptici cu privire la diagnosticul ei clinic, au fost convinși de testele genetice care au documentat o modificare a genei pentru lanțul alfa-1 al colagenului de tip V, prescurtat COL5A1, o constatare frecventă la pacienții cu EDS. Eve moștenise mutația de la mama ei, care avusese simptome mai ușoare de EDS și care acum era capabilă să le gestioneze mai bine.
În decurs de câteva luni, sănătatea și vitalitatea lui Eve au fost restabilite și ea „și-a recăpătat viața”, așa cum ar spune ea și părinții ei. Încă mai avea dureri articulare, anxietate și oboseală ocazional, dar „exercițiile înțelepte” pentru a construi o protecție musculară în jurul articulațiilor, abordările nutriționale pentru disautonomie și abordările de biofeedback pentru a alunga anxietatea i-au schimbat viața . Toate aceste tratamente s-au datorat recunoașterii de către medicul ei de familie, acum capabil să coordoneze îngrijirea pentru Eve și mama ei și să ofere resurse pentru înțelegerea atât a EDS, cât și a modificărilor genetice care stau la baza acesteia . Trecerea la următoarea generație a fost abilitatea de a o informa pe Eve despre riscul ei de 50% de a transmite mutația COL5A și unele riscuri de travaliu timpuriu și hemoragie postpartum în orice sarcină viitoare .
- Remvig L, Jensen DV, Ward RC (2007) Epidemiologia hipermobilității articulare generale și baza pentru criteriile propuse pentru sindromul de hipermobilitate articulară benignă: revizuirea literaturii. J Rheumatol 34: 804-809.
- Steinman B, Royce PM, Superti-Furga A (1993) The Ehlers-Danlos syndrome. În: E: Connective Tissue and its Heritable Disorders. B Steinman, PM Royce (Eds) Wiley-Liss: New York pp. 351-407.
- McKusick VA (1956) Heritable disorders of connective tissue. CV Mosby: St. Louis.
- Bloom L, Byers P, Francomano C, Tinkle B, Malfait F (2017) The International Consortium on the Ehlers-Danlos Syndromes. Am J Med Genet Part C Semin Med Genet 175: 5-7.
- Gazit Y1, Nahir AM, Grahame R, Jacob G (2003) Dysautonomia în sindromul de hipermobilitate articulară. Am J Med 115: 33-40.
- Pizzo PA1 (2013) Lecții de ameliorare a durerii – o experiență personală postuniversitară. N Engl J Med 369: 1092-1093.
- Pyeritz RE (2008) O moleculă mică pentru o boală mare. N Engl J Med 358: 2829-2831.
- 8. Wyandt HE, Wilson GN, Tonk VS. Capitolul 11: Secvențierea genelor și a genomului: Interpretarea variației genetice la nivel de nucleotide. În: In: Human Chromosome Variation: Heteromorphism, Polymorphism, and Pathogenesis, Ed.2. Springer Nature, Singapore
- Mefford HC (2012) Diagnostic exome sequencing–are we there yet? N Engl J Med 367: 1951-1953.
- http://hypermobility.org/help-advice/hypermobility-syndromes/beighton-score/
- Castori M, Morlino S, Celletti C (2013) Rewriting the natural history of pain and related symptoms in the joint hypermobility syndrome/Ehlers-Danlos syndrome, hypermobility type. Am J Med Genet A 12: 2989-3004.
- Simpson MR (2006) Sindromul de hipermobilitate articulară benignă: evaluare, diagnostic și management. J Am Osteopath Assoc 106: 531-536.
- Kirk JA, Ansell BM, Bywaters EG (1967) Sindromul de hipermobilitate. Afecțiuni musculo-scheletice asociate cu hipermobilitatea articulară generalizată. Ann Rheum Dis 26: 419-425.
- Wilson GN (2014) Diagnosticul genetic presimptomatic și de preimplantare: Neurologie, NextGenetics și următoarea generație. JAMA Neurol 71: 403-404.
- Castori M, Morlino S, Celletti C (2012) Managementul durerii și al oboselii în sindromul de hipermobilitate articulară (a.k.a. Sindromul Ehlers-Danlos, tip hipermobilitate): principii și propunere pentru o abordare multidisciplinară. Am J Med Genet A 158: 2055-2070.
- Castori M, Morlino S, Celletti C (2013) Rescrierea istoriei naturale a durerii și a simptomelor asociate în sindromul de hipermobilitate articulară/sindromul Ehlers-Danlos, tip hipermobilitate. Am J Med Genet A 161A: 2989-3004.
- Bathen T, Hangmann AB, Hoff M (2013) Tratamentul multidisciplinar al dizabilității în sindromul Ehlers-Danlos de tip hipermobilitate/ sindromul de hipermobilitate Ehlers-Danlos: un studiu pilot care utilizează o combinație de terapie fizică și cognitiv-comportamentală pe 12 femei. Am J Med Genet A 161A: 3005-3011.
- EDS (2018) Ehlers-Danlos Syndrome National Foundation.
- OMIM (2018) Online Mendelian Inheritance in Man.
- Wilson GN (2014) Exome analysis of connective tissue dysplasia: death and rebirth of clinical genetics? Am J Med Genet A 164A: 1209-1212.