Was ist Gerinnung?
In der Kochkunst ist Gerinnung das Aufbrechen einer Emulsion oder eines Kolloids in große Teile unterschiedlicher Zusammensetzung durch die physikalisch-chemischen Prozesse des Ausflockens, Aufrahmens und Zusammenfließens. Bei der Herstellung von Käse und Tofu ist die Gerinnung beabsichtigt und erwünscht, bei der Herstellung von Soßen und Puddings ist sie unbeabsichtigt und unerwünscht. Gerinnung tritt natürlich in Milch auf, wenn die Milch nicht bis zum Verfallsdatum verbraucht wird oder wenn die Milch bei warmen Temperaturen gelagert wird.
Milch besteht aus mehreren Bestandteilen, hauptsächlich Fett, Eiweiß und Zucker. Das Eiweiß in der Milch ist normalerweise in einer kolloidalen Lösung suspendiert, was bedeutet, dass die kleinen Eiweißmoleküle frei und unabhängig umherschwimmen. Diese schwimmenden Eiweißmoleküle brechen das Licht und tragen (zusammen mit dem suspendierten Fett) zum weißen Aussehen der Milch bei. Normalerweise stoßen sich diese Eiweißmoleküle gegenseitig ab, so dass sie umherschwimmen können, ohne zu verklumpen, aber wenn sich der pH-Wert ihrer Lösung ändert, können sie sich gegenseitig anziehen und verklumpen. Dies geschieht, wenn Milch gerinnt: Wenn der pH-Wert sinkt und saurer wird, ziehen sich die Eiweißmoleküle (Kasein und andere) gegenseitig an und werden zu „Gerinnseln“, die in einer Lösung aus durchsichtiger Molke schwimmen. Diese Verklumpungsreaktion läuft bei wärmeren Temperaturen schneller ab als bei kalten Temperaturen.
Welche Bestandteile der Milch lassen sie gerinnen?
Milch ist eine Emulsion oder ein Kolloid aus Butterfettkügelchen in einem Gemisch aus Wasser, Kohlenhydraten, Mineralien und Proteinen.
Die Hauptbestandteile der Milch sind Wasser, Fett, Proteine, Laktose (Milchzucker) und Mineralien (Salze). Milch enthält auch Spuren anderer Stoffe wie Pigmente, Enzyme, Vitamine, Phospholipide (Stoffe mit fettähnlichen Eigenschaften) und Gase.
Wie hoch ist der Fettgehalt von Milch?
Nach Angaben des Dairy Council hat Vollmilch 3,9 % Fett (d. h. sie enthält 3,9 g Fett pro 100 g), teilentrahmte Milch hat 1,7 % Fett, Milch mit 1 % Fett hat 1 % Fett und entrahmte Milch hat 0,3 % Fett.
Welche Proteine sind in der Milch enthalten?
Die meiste Milch, die in den USA getrunken wird, stammt aus den Milchdrüsen von Kühen. Die wichtigsten Proteine in der Milch sind einzigartig und kommen in keinem anderen Gewebe als in den Milchdrüsen vor. Milchproteine, insbesondere die Kaseine, haben eine Aminosäurenzusammensetzung, die für das Wachstum und die Entwicklung des Nachwuchses hilfreich ist. Zu den anderen Proteinen in der Milch gehören eine Reihe von Enzymen, Proteine, die am Transport von Nährstoffen beteiligt sind, Proteine, die zur Krankheitsabwehr beitragen (Antikörper und andere), Wachstumsfaktoren usw. (siehe Referenz 1). Kasein macht 79,5 % der in Kuhmilch enthaltenen Proteine aus.
Milch enthält 3,3 % Gesamtprotein. Milchproteine enthalten alle 9 essentiellen Aminosäuren, die der Mensch benötigt. Milchproteine werden in der Milchdrüse synthetisiert, aber 60 % der Aminosäuren, die zum Aufbau der Proteine verwendet werden, stammen aus der Nahrung der Kuh. Der Gesamtproteingehalt der Milch und die Aminosäurezusammensetzung variieren je nach Kuhrasse und Genetik der einzelnen Tiere.(2)
Molkenprotein macht 19,3 % des Proteingehalts der Milch aus. In der Milch der meisten Tierarten gibt es 3 oder 4 Kaseine; die verschiedenen Kaseine sind unterschiedliche Moleküle, die sich jedoch in ihrer Struktur ähneln. Alle anderen Proteine, die in der Milch vorkommen, werden unter dem Namen Molkenproteine zusammengefasst. Die wichtigsten Molkenproteine in Kuhmilch sind Beta-Lactoglobulin und Alpha-Lactalbumin.
β-Lactoglobulin ist das wichtigste Molkenprotein in Kuh- und Schafsmilch und kommt auch in vielen anderen Säugetierarten vor; eine bemerkenswerte Ausnahme ist der Mensch.

Das Casein-Molekül
Eine Familie verwandter Phosphoproteine (αS1, αS2, β, κ).
Casein enthält eine hohe Anzahl von Prolin-Resten, die nicht miteinander interagieren. Es gibt auch keine Disulfidbrücken. Folglich hat es relativ wenig Tertiärstruktur. Es ist relativ hydrophob und daher schlecht in Wasser löslich. In der Milch liegt es in Form einer Suspension von Partikeln vor, die als Kaseinmizellen bezeichnet werden,
Kasein enthält eine große Anzahl von Prolinresten, die nicht miteinander wechselwirken. Es gibt auch keine Disulfidbrücken. Folglich hat es relativ wenig Tertiärstruktur. Es ist relativ hydrophob und daher schlecht in Wasser löslich. In der Milch liegt es in Form einer Suspension von Partikeln vor, die als Kaseinmizellen bezeichnet werden
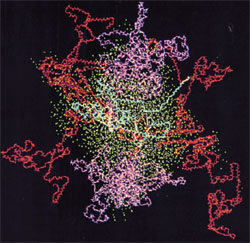
Bild: Kaseinmizelle, Kappa-Kasein in blau, Alpha-Kasein in rot, Beta-Kasein in magenta, Sauerstoff aus Wasser in cyan. Quelle: Kumosinski, T.F., King, G. und Farrell, H.M., Jr. (1994).Comparison of the three dimensional molecular models of bovine submicellar caseins with small-angle X-ray scattering.
Die Kaseine in Kuhmilch können verschiedene Formen enthalten, wobei Kuhmilch typischerweise eine von zwei Arten von Beta-Kasein enthält. Je nach dem genetischen Profil einer einzelnen Kuh enthält die produzierte Milch entweder A1-Beta-Kaseine oder A2-Beta-Kaseine.
Alle Kaseinmoleküle haben mindestens ein estergebundenes Phosphat. Keines der Molkenproteine hat dies.
Der isoelektrische Punkt von Kasein liegt bei 4,6. Da der pH-Wert der Milch 6,6 beträgt, ist Kasein in der Milch negativ geladen.
Die Caseine haben eine sehr ungleichmäßige Verteilung der Ladungen entlang des Moleküls, während die Ladungen in den großen Molkenproteinen gleichmäßiger verteilt sind. Dies erklärt eine der wichtigsten Eigenschaften der Kaseine in der Milch, ihre amphiphile Natur. Geladene Bereiche sind im Allgemeinen wasserliebend oder hydrophil und die ungeladenen Bereiche entlang des Moleküls sind eher hydrophob oder wasserabweisend. Da diese Bereiche ungleichmäßig über das Molekül verteilt sind, sind diese Bereiche stärker exponiert.
In Proteinen mit gleichmäßiger Verteilung heben sich die hydrophilen und hydrophoben Bereiche im Grunde gegenseitig auf. Durch die amphiphile Natur der Kaseinmoleküle entsteht eine der wichtigsten Eigenschaften des Kaseins, die Kaseinmizelle. Die meisten Kaseine in der Milch liegen in komplizierten losen Aggregaten vor, die Mizellen genannt werden.
Die Caseinmizelle wird auf zwei Arten stabilisiert. Erstens kommt Kalziumphosphat in hohen Konzentrationen in der Milch und in der Kaseinmizelle selbst vor. Die Konzentration ist so hoch, dass sich kleine Aggregate des Phosphats bilden. Ein Teil des Phosphats kann relativ frei in die Mizelle ein- und aus ihr austreten, während ein anderer Teil des Phosphats fest an das Protein gebunden ist. Dieses gebundene Phosphat liegt in winzigen Aggregaten von ungelöstem (kolloidalem) Calciumphosphat vor. Diese neigen dazu, die Mizelle zusammenzukitten und ihre Struktur zu stabilisieren.
K-Casein und Gerinnung der Milch
Die andere stabilisierende Wirkung ist auf eine Eigenschaft von K-Casein zurückzuführen. K-Kasein hat in seiner Struktur eine Kohlenhydratgruppe, die mit Threonin im Protein verestert ist. Diese Kohlenhydratgruppe enthält einige negativ geladene Gruppen. Das Ergebnis ist, dass K-Kasein an einem Teil des Moleküls hydrophiler wird. In der Mizelle siedelt sich K-Kasein und in gewissem Maße auch B-Kasein in der Nähe der Wassergrenzfläche der Mizelle an oder erstreckt sich in diese hinein. Dies stabilisiert die Mizelle, indem es die Aggregation der Mizellen durch sterische Abstoßung verhindert (indem es eine enge Annäherung zwischen den Kaseinmizellen verhindert). Beim K-Kasein ist die Peptidbindung zwischen der 105. und 106. Aminosäure anfällig für die Hydrolyse durch proteolytische Enzyme (mikrobieller Koagulator oder Lab). Dies ist der Mechanismus für die Quarkbildung (durch Entfernung des kohlenhydrathaltigen Teils des Proteins und damit Verringerung der sterischen Stabilität). Durch den Verlust des Schutzes des K-Kaseins können die Kaseinmizellen aggregieren und einen kohärenten Käsebruch bilden.
Um zu verstehen, wie Chymosin die Milch gerinnen lässt, muss man etwas über Milchproteine wissen. Der größte Teil des Milchproteins ist Kasein, und es gibt vier Haupttypen von Kaseinmolekülen: alpha-s1, alpha-s2, beta und kappa. Die Alpha- und Beta-Kaseine sind hydrophobe Proteine, die leicht durch Kalzium ausgefällt werden – die normale Kalziumkonzentration in der Milch übersteigt bei weitem die zur Ausfällung dieser Proteine erforderliche Konzentration. Das Kappa-Kasein ist jedoch ein ganz anderes Molekül – es ist nicht mit Kalzium ausfällbar. Wenn die Kaseine ausgeschieden werden, assoziieren sie sich selbst zu Aggregaten, den so genannten Mizellen, in denen die Alpha- und Beta-Kaseine durch ihre Wechselwirkungen mit dem Kappa-Kasein an der Ausfällung gehindert werden. Das Kappa-Kasein sorgt normalerweise dafür, dass der größte Teil des Milcheiweißes löslich bleibt und verhindert, dass es spontan gerinnt.
Eintrag von Chymosin
Chymosin schneidet das Kappa-Kasein proteolytisch und inaktiviert es, indem es es in Para-Kappa-Kasein und ein kleineres Protein namens Makropeptid umwandelt. Para-Kappa-Casein hat nicht die Fähigkeit, die mizellare Struktur zu stabilisieren, und die kalziumunlöslichen Caseine fallen aus und bilden einen Bruch.
Die Kaseinmoleküle können auch von der Molke getrennt werden, indem das Kasein mit Säure ausgefällt wird (ähnlich wie es im Magen geschieht, wenn Milch getrunken wird) oder indem die Mizellenstruktur durch teilweise Hydrolyse der Eiweißmoleküle mit einem proteolytischen Enzym aufgebrochen wird. Im Magen von Jungtieren vieler Spezies befindet sich ein Enzym namens Labin, das spezifisch einen Teil der Kaseinmizellen hydrolysiert, was zur Bildung eines Quarks führt. Eine klassische Fällungsmethode für Kasein in Kuhmilch, die im Labor durchgeführt wird, besteht darin, langsam HCl (0,1 N) hinzuzufügen, um den pH-Wert der Milch auf 4,6 zu senken. Das Kasein fällt allmählich aus, während die anderen Milchproteine relativ wenig ausfallen. Verschiedene Kombinationen von kontrollierter Säureausfällung und enzymatischer Hydrolyse von Kasein bilden die Grundlage für die Käseherstellung. Häufig werden spezifische Bakterienkulturen verwendet, um die Bedingungen für die Absenkung des pH-Wertes und die Sekretion von proteolytischen Enzymen zu schaffen, die die verschiedenen Käsesorten bilden.
Was ist Molke?
Molke ist die Flüssigkeit, die übrig bleibt, nachdem die Milch geronnen ist und abgeseiht wurde. Molkenproteine bestehen aus α-Lactalbumin, β-Lactoglobulin, Serumalbumin, Immunglobulinen,
Molkenprotein ist ein hochwertiges Protein, das natürlich in Milchprodukten vorkommt. Es ist ein „vollständiges“ Protein, das alle essentiellen Aminosäuren enthält, die der menschliche Körper benötigt, und ist leicht verdaulich.
Molkenproteine, auch Serumproteine genannt, enthalten kein Phosphor und gerinnen nicht bei einem pH-Wert von 4,6.
Molke kann zur Herstellung von Ricotta-Käse verwendet werden. Traditionell wird die Molke aus Schafsmilch eingekocht, bis sie zu weichem, flauschigem Käsebruch wird.
Auswirkung des pH-Wertes
Wenn der pH-Wert sinkt und saurer wird, ziehen sich die Eiweißmoleküle (Kasein) gegenseitig an und werden zu „Gerinnseln“, die in einer Lösung aus durchsichtiger Molke schwimmen. Diese Verklumpungsreaktion geht bei wärmeren Temperaturen schneller vonstatten als bei kalten Temperaturen.
Gerinnung ist ein Milchprodukt, das durch Gerinnung der Milch in einem Prozess namens Gerinnung gewonnen wird. Die Gerinnung kann durch Zugabe von Lab oder einer essbaren sauren Substanz wie Zitronensaft oder Essig und anschließendes Ruhenlassen erfolgen.