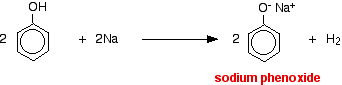Acidez del Fenol
Compuestos como los alcoholes y el fenol que contienen un grupo -OH unido a un hidrocarburo son ácidos muy débiles. Los alcoholes son tan débilmente ácidos que, para fines normales de laboratorio, su acidez puede ser prácticamente ignorada. Sin embargo, el fenol es lo suficientemente ácido como para tener propiedades ácidas reconocibles, aunque siga siendo un ácido muy débil. Un ion hidrógeno puede desprenderse del grupo -OH y transferirse a una base. Por ejemplo, en solución en agua:

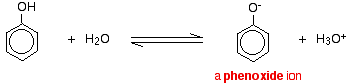
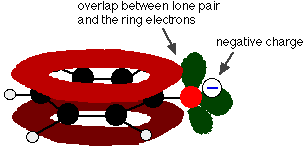
El fenol es un ácido muy débil y la posición de equilibrio se encuentra bien a la izquierda. El fenol puede perder un ion hidrógeno porque el ion fenóxido formado está estabilizado hasta cierto punto. La carga negativa del átomo de oxígeno está deslocalizada alrededor del anillo. Cuanto más estable es el ion, más probable es que se forme. Uno de los pares solitarios del átomo de oxígeno se solapa con los electrones deslocalizados del anillo de benceno.
Este solapamiento conduce a una deslocalización que se extiende desde el anillo hacia el átomo de oxígeno. Como resultado, la carga negativa ya no está totalmente localizada en el oxígeno, sino que se reparte por todo el ion.
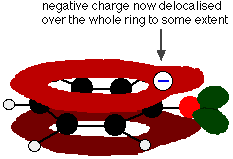
La distribución de la carga hace que el ion sea más estable que si toda la carga permaneciera en el oxígeno. Sin embargo, el oxígeno es el elemento más electronegativo del ion y los electrones deslocalizados serán atraídos hacia él. Esto significa que seguirá habiendo mucha carga alrededor del oxígeno, que tenderá a atraer de nuevo al ion hidrógeno. Por eso el fenol es sólo un ácido muy débil.
¿Por qué el fenol es un ácido mucho más fuerte que el ciclohexanol? Para responder a esta pregunta debemos evaluar la forma en que un sustituyente de oxígeno interactúa con el anillo de benceno. Como hemos señalado en nuestro tratamiento anterior de las reacciones de sustitución aromática electrofílica, un sustituyente de oxígeno aumenta la reactividad del anillo y favorece el ataque electrófilo en los sitios orto y para. Se propuso que la deslocalización de resonancia de un par de electrones no enlazados del oxígeno en el sistema de electrones pi del anillo aromático era responsable de este efecto del sustituyente. Un conjunto similar de estructuras de resonancia para la base conjugada del anión fenolato aparece debajo de las estructuras del fenol.
La estabilización de la resonancia en estos dos casos es muy diferente. Un principio importante de la resonancia es que la separación de cargas disminuye la importancia de los contribuyentes canónicos al híbrido de resonancia y reduce la estabilización global. Todas las estructuras que contribuyen al híbrido de fenol sufren una separación de carga, lo que resulta en una estabilización muy modesta de este compuesto. Por otro lado, el anión fenolato ya está cargado, y los contribuyentes canónicos actúan para dispersar la carga, dando como resultado una estabilización sustancial de esta especie. Las bases conjugadas de los alcoholes simples no se estabilizan por deslocalización de carga, por lo que la acidez de estos compuestos es similar a la del agua. A la derecha se muestra un diagrama de energía que muestra el efecto de la resonancia en las acideces del ciclohexanol y del fenol. Dado que la estabilización por resonancia de la base conjugada del fenolato es mucho mayor que la estabilización del propio fenol, la acidez del fenol respecto al ciclohexanol aumenta. Las pruebas de que la carga negativa del fenolato está deslocalizada en los carbonos orto y para del anillo de benceno provienen de la influencia de los sustituyentes que retiran electrones en esos sitios.

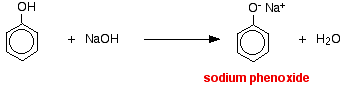
En esta reacción, el ion hidrógeno ha sido eliminado por el ion hidróxido fuertemente básico en la solución de hidróxido de sodio.
Los ácidos reaccionan con los metales más reactivos para dar gas hidrógeno. El fenol no es una excepción – la única diferencia es la lentitud de la reacción porque el fenol es un ácido muy débil. El fenol se calienta en un tubo seco hasta que se funde y se añade un pequeño trozo de sodio. Se produce una efervescencia al desprenderse gas de hidrógeno. La mezcla que queda en el tubo contendrá fenóxido de sodio.