Acidité du phénol
Les composés comme les alcools et le phénol qui contiennent un groupe -OH attaché à un hydrocarbure sont des acides très faibles. Les alcools sont si faiblement acides que, pour les besoins normaux du laboratoire, leur acidité peut être pratiquement ignorée. Cependant, le phénol est suffisamment acide pour avoir des propriétés acides reconnaissables, même s’il s’agit toujours d’un acide très faible. Un ion hydrogène peut se détacher du groupe -OH et passer à une base. Par exemple, en solution dans l’eau :

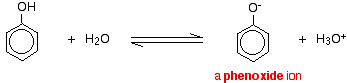
Le phénol est un acide très faible et la position d’équilibre se situe bien à gauche. Le phénol peut perdre un ion hydrogène car l’ion phénoxyde formé est stabilisé dans une certaine mesure. La charge négative de l’atome d’oxygène est délocalisée autour de l’anneau. Plus l’ion est stable, plus il a de chances de se former. L’une des paires solitaires sur l’atome d’oxygène chevauche les électrons délocalisés sur le cycle benzénique.
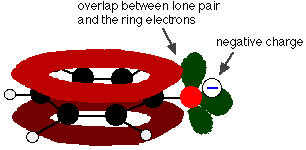
Ce chevauchement conduit à une délocalisation qui s’étend du cycle vers l’atome d’oxygène. En conséquence, la charge négative n’est plus entièrement localisée sur l’oxygène, mais est répartie autour de l’ion entier.
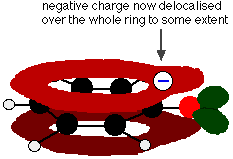
La répartition de la charge rend l’ion plus stable qu’il ne le serait si toute la charge restait sur l’oxygène. Cependant, l’oxygène est l’élément le plus électronégatif de l’ion et les électrons délocalisés seront attirés vers lui. Cela signifie qu’il restera beaucoup de charges autour de l’oxygène, ce qui aura tendance à attirer à nouveau l’ion hydrogène. C’est pourquoi le phénol n’est qu’un acide très faible.
Pourquoi le phénol est-il un acide beaucoup plus fort que le cyclohexanol ? Pour répondre à cette question, nous devons évaluer la manière dont un substituant oxygène interagit avec le cycle benzénique. Comme nous l’avons noté dans notre traitement précédent des réactions de substitution aromatique électrophile, un substituant oxygène augmente la réactivité du cycle et favorise l’attaque électrophile aux sites ortho et para. Il a été proposé que la délocalisation par résonance d’une paire d’électrons non liée à l’oxygène dans le système d’électrons pi- du cycle aromatique était responsable de cet effet de substitution. Un ensemble similaire de structures de résonance pour la base conjuguée de l’anion phénolate apparaît sous les structures du phénol.
La stabilisation de la résonance dans ces deux cas est très différente. Un principe important de la résonance est que la séparation des charges diminue l’importance des contributeurs canoniques à l’hybride de résonance et réduit la stabilisation globale. Les structures contribuant à l’hybride phénolique subissent toutes une séparation de charge, ce qui entraîne une stabilisation très modeste de ce composé. D’autre part, l’anion phénolate est déjà chargé, et les contributeurs canoniques agissent pour disperser la charge, ce qui entraîne une stabilisation substantielle de cette espèce. Les bases conjuguées des alcools simples ne sont pas stabilisées par la délocalisation de la charge, l’acidité de ces composés est donc similaire à celle de l’eau. Un diagramme énergétique montrant l’effet de la résonance sur les acidités du cyclohexanol et du phénol est présenté à droite. Comme la stabilisation par résonance de la base conjuguée du phénolate est beaucoup plus importante que la stabilisation du phénol lui-même, l’acidité du phénol par rapport au cyclohexanol est augmentée. Des preuves à l’appui que la charge négative du phénolate est délocalisée sur les carbones ortho et para du cycle benzénique proviennent de l’influence des substituants attracteurs d’électrons sur ces sites.

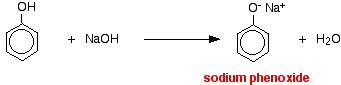
Dans cette réaction, l’ion hydrogène a été éliminé par l’ion hydroxyde fortement basique dans la solution d’hydroxyde de sodium.
Les acides réagissent avec les métaux plus réactifs pour donner de l’hydrogène gazeux. Le phénol ne fait pas exception – la seule différence est la lenteur de la réaction car le phénol est un acide si faible. Le phénol est chauffé dans un tube sec jusqu’à ce qu’il soit fondu, et un petit morceau de sodium est ajouté. Un petit morceau de sodium est ajouté. Il y a quelques pétillements lorsque de l’hydrogène se dégage. Le mélange laissé dans le tube contiendra du phénoxyde de sodium.

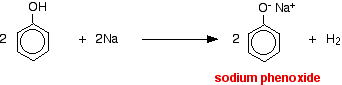
.