Introduction
Les espèces d’Acanthamoeba sont l’agent causal d’une infection de la cornée menaçant la vue, connue sous le nom de kératite à Acanthamoeba, causée par l’amibe libre Acanthamoeba spp, et est une infection de la cornée menaçant la vue qui se présente avec des ulcérations cornéennes. Elle a été signalée pour la première fois en 1973. Les acanthamoeba sont des protozoaires ubiquitaires qui existent sous deux formes : Les trophozoïtes (la forme active) et les kystes (la forme inactive). Les kystes sont notoirement difficiles à tuer et c’est l’une des raisons pour lesquelles cette infection est si difficile à éradiquer. Une seule classe de médicaments est connue pour avoir une activité cystocide, les biguanides. L’incidence de la kératite Acanthamoeba dans cette étude était de 1,04% et l’incidence dans d’autres séries indiennes rapportées varie de 0,34 à 1,4% .
L’incidence de la kératite Acanthamoeba semble augmenter en raison de son association fréquente avec le port de lentilles de contact, qui représente la cause de >85% des cas de kératite Acanthamoeba, en particulier dans les pays développés . Les membres du genre Acanthamoeba sont omniprésents et peuvent être isolés de l’eau de puits, du robinet, de l’eau en bouteille et de l’eau de piscine, ainsi que du sable, de la poussière, des sécrétions nasales et pharyngées de l’homme et des selles des animaux. Le cycle de vie de l’Acanthamoeba consiste en un trophozoïte et un stade de kyste .
Diagnostic et détection
La détection peut être faite en laboratoire en utilisant une plaque de gélose saline non nutritive ensemencée avec des bactéries gram négatives comme Escherichia coli. La PCR est utilisée pour confirmer le diagnostic surtout lorsque les lentilles de contact sont impliquées. Des méthodes moléculaires sont également disponibles pour la détection et l’identification de l’Acanthamoeba, ces méthodes sont également adaptées à des fins cliniques et épidémiologiques. La technique d’hybridation fluorescente in situ a également été employée avec succès pour la détection de but . La figure 1 montre l’œil infecté.
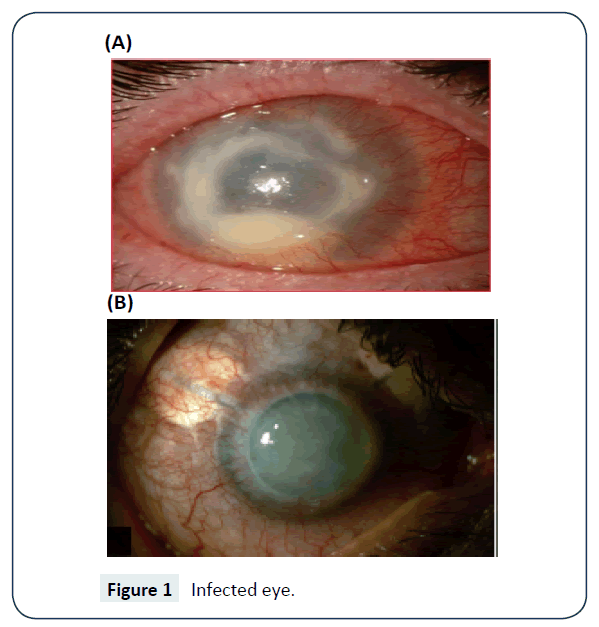
Figure 1 : œil infecté.
Traitement et études de cas
L’Acanthamoeba est difficile à traiter, mais une gestion efficace peut sauver un œil. Des agents anti-infectieux topiques utilisés dans les stades précoces, une intervention chirurgicale est nécessaire dans les stades ultérieurs. La propamidine 0,1% et la néomycine 1% montrent une bonne activité contre l’AK Depuis, deux ou plusieurs agents antiamibiens topiques sont utilisés tout au long de la journée. Le polyhexaméthylène biguanide (PHMB, 0,02%) et la chlorhexidine (0,02%), sont efficaces en monothérapie et en thérapie combinée avec une diamidine.
Des études de cas montrent que la kératite à Acanthamoeba est traitée avec succès chez la personne ayant la lentille de contact en utilisant une thérapie de six mois avec le Miconazole topique, le Metronidazole, la Prednisolone et la néomycine ainsi que le ketokonazole oral. Dans un autre cas de personne sans lentille de contact ayant une sensation de brûlure, l’utilisation supplémentaire de Propamidine dans la thérapie ci-dessus montre une amélioration de l’ulcère cornéen. Dans un autre cas où la Tobramycine et la Céfazoline topiques ont été ajoutées à la thérapie. La combinaison de Dibromopropamidine et Propamidine iséthionate pommade et gouttes et néomycine gouttes sont utilisés avec succès dans le patient de 44 ans ayant une infection cornéenne de l’espèce Acanthamoeba .
Une kératite bilatérale à Acanthamoeba a été traitée avec succès avec de la Chlorhexidine, du Polyhexaméthylène biguanide, de l’iséthionate de Propamidine en combinaison avec de l’Atropine et de la Dibromopropamidine une amélioration a été notée à quel point l’Atropine et la Dibromopropamidine ont été arrêtées tandis que l’acétate de Fluorométholone, l’Acyclovir et la Ciprofloxacine ont été prescrits et le patient a été libéré . Quelques études affirment que l’ajout de la néomycinepolymyxine B donne également le bon résultat .
Prévention
Les porteurs de lentilles de contact doivent surtout prendre des précautions lors du nettoyage des lentilles ne doivent jamais utiliser l’eau du robinet et la solution saline pour nettoyer. Comme le traitement est toxique et long, ils doivent consulter s’ils constatent un signe d’inflammation. Et ceux qui n’ont pas de lentilles, ils ne doivent pas se laver les yeux avec l’eau du lac ou de la mer.
- Illingworth CD, Cook SD (1998) Acanthamoeba keratitis. Surv Ophthalmol 42 : 493-508.
- Manikandan P, Bhaskar M, Revathy R, John RK, Narendran V, et al. (2004) Acanthamoeba keratitis : A six year epidemiological review from a tertiary care eye hospital in South India. Indian J Med Microbiol 22 : 226-230.
- Srinivasan M, Gonzales CA, George C, Cevallos V, Mascarenhans JM, et al . (1997) Épidémiologie et diagnostic étiologique de l’ulcération cornéenne à Madurai, Inde du Sud. Br J Ophthalmol 81 : 965-971.
- Leck AK, Thomas PA, Hagan M, Kalimurthy J, Ackuaku E, et al . Étiologie des ulcères cornéens suppuratifs au Ghana et en Inde du Sud et épidémiologie des kératites fongiques. Br J Ophthalmol86 : 1211-1215.
- Basak SK, Basak S, Mohanta A, Bhowmick A (2005) Diagnostic épidémiologique et microbiologique de la kératite suppurative dans le Gange du Bengale occidental, en Inde orientale. Indian J Ophthalmol 53 : 17-22.
- Patel A, Hammersmith K (2008) Contact lens-related microbial keratitis : recent outbreaks. Curr Opin Ophthalmol 19 : 302-306.
- Thebpatiphat N, Hammersmith KM, Rocha FN (2007) Acanthamoeba keratitis : a parasite on the rise. Cornea 26 : 701-706.
- Verani JR, Lorick SA, Yoder JS (2009) National outbreak of Acanthamoeba keratitis associated with use of a contact lens solution, United States. Emerg Infect Dis 15 : 1236-1242.
- DE Jonckheere (1991) JF : Ecology of Acanthamoeba. Rev Infect Dis 13 : S385-S387.
- Pasricha G, Sharma S, Garg P, Aggarwal R (2003) Utilisation du test PCR basé sur le gène de l’ARNr 18S pour le diagnostic de la kératite à Acanthamoeba chez les porteurs de lentilles non-contact en Inde journal of Clinical Microbiology 41 : 3206-3211.
- Schroeder JM, Booton GC, Hay J, Niszl IA, Seal DV, et al. (2001) Utilisation de la PCR et du séquençage de l’ADN ribosomique 18S subgénique pour l’identification du genre et du génotype des acanthamoebae provenant d’humains atteints de kératite et de boues d’épuration. J Clin Microbiol 39 : 1903-1911.
- Stothard DR, Hay J, Schroeder-Diedrich JM, Seal DV, Byers TJ (1999) Sondes oligonucléotidiques fluorescentes pour la détection clinique et environnementale d’Acanthamoeba et du type de séquence du gène de l’ARNr T4 18S. J Clin Microbiol 37 : 2687-2693.
- Wright P, Warhurst D, Jones BR (1985) Acanthamoeba keratitis successfully treated medically. Br J Ophthalmol 69 : 778-782.
- Duff D, Horne MD, Mary EF (1994) Acanthamoeba keratitis : an emerging clinical Problem. Can Med Assoc J 150 : 1.
- Wright P, Warhurst D, Barrie R (1985) Acanthamoeba keratitis successfully treated medically. Br J Ophthalmol 69 : 778-782.
- Hassanlou M, Bhargava A, Hodge WG (2006) Kératite à Acanthamoeba et stratégie de traitement basée sur la profondeur des lésions. Can J Ophthalmol 41 : 71-73.
- Wang IJ, Hong JP, Hu FR (1997) Caractéristiques cliniques et résultats de la kératite à Acanthamoeba. J Formosan Med Assn 96 : 895-900.