Introduction
Acanthamoeba-Spezies sind die Erreger einer sehkraftbedrohenden Infektion der Hornhaut, die als Acanthamoeba-Keratitis bekannt ist und durch die freilebende Amöbe Acanthamoeba spp. verursacht wird, eine sehkraftbedrohende Hornhautinfektion, die sich durch Hornhautgeschwüre äußert. Sie wurde erstmals im Jahr 1973 beschrieben. Acanthamoeba sind ubiquitäre Protozoen, die in 2 Formen vorkommen: Trophozoiten (die aktive Form) und Zysten (die inaktive Form). Zysten sind bekanntermaßen schwer abzutöten, was ein Grund dafür ist, dass diese Infektion so schwer auszurotten ist. Nur von einer Medikamentenklasse ist bekannt, dass sie zystentötend wirkt: den Biguaniden. Die Inzidenz der Acanthamoeba-Keratitis lag in dieser Studie bei 1,04 %, und die Inzidenz in anderen berichteten indischen Serien reicht von 0,34 bis 1,4 %.
Die Inzidenz der Acanthamoeba-Keratitis scheint aufgrund der häufigen Assoziation mit dem Tragen von Kontaktlinsen, die die Ursache für >85 % der Acanthamoeba-Keratitis-Fälle darstellen, vor allem in den entwickelten Ländern zuzunehmen. Mitglieder der Gattung Acanthamoeba sind allgegenwärtig und können aus Brunnen-, Leitungs-, Flaschen- und Schwimmbadwasser sowie aus Sand, Staub, menschlichen Nasen- und Rachensekreten und Tierkot isoliert werden. Der Lebenszyklus von Acanthamoeba besteht aus einem Trophozoiten- und einem Zystenstadium.
Diagnose und Nachweis
Der Nachweis kann im Labor mit einer mit gramnegativen Bakterien wie Escherichia coli besiedelten Nicht-Nährstoffagar-Salzplatte erfolgen. Die PCR wird zur Bestätigung der Diagnose verwendet, insbesondere wenn Kontaktlinsen betroffen sind. Es gibt auch molekulare Methoden zum Nachweis und zur Identifizierung von Acanthamoeba, die sowohl für klinische als auch für epidemiologische Zwecke geeignet sind. Die fluoreszierende In-situ-Hybridisierungstechnik wurde ebenfalls erfolgreich für den Nachweis eingesetzt. Abbildung 1 zeigt das infizierte Auge.
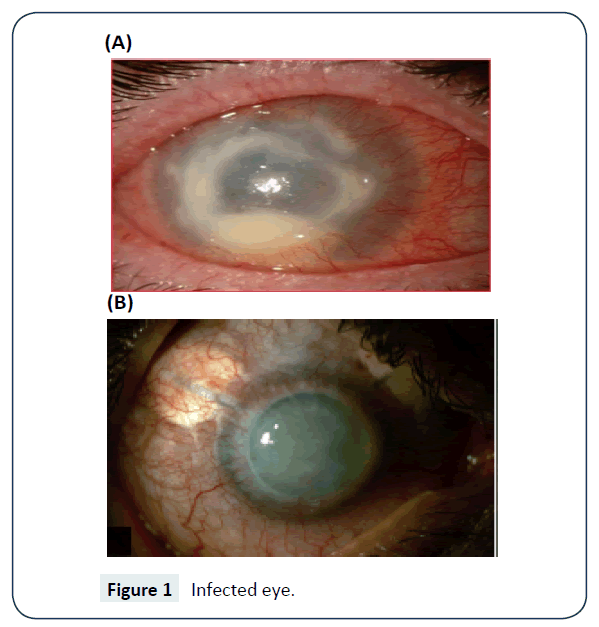
Abbildung 1: Infiziertes Auge.
Behandlung und Fallstudien
Acanthamoeba ist schwer zu behandeln, aber eine wirksame Behandlung kann ein Auge retten. Im Frühstadium werden topische Antiinfektiva eingesetzt, in späteren Stadien ist ein chirurgischer Eingriff erforderlich. Propamidin 0,1 % und Neomycin 1 % zeigen gute Wirkung gegen AK. Seitdem werden zwei oder mehr topische Anti-Amöben-Mittel über den Tag verteilt eingesetzt. Polyhexamethylen-Biguanid (PHMB, 0,02%) und Chlorhexidin (0,02%) sind sowohl in der Monotherapie als auch in der Kombinationstherapie mit einem Diamidin wirksam.
Fallstudien zeigen, dass die Acanthamöben-Keratitis bei Kontaktlinsenträgern durch eine sechsmonatige Therapie mit topischem Miconazol, Metronidazol, Prednisolon und Neomycin sowie oralem Ketokonazol erfolgreich behandelt werden kann. In einem anderen Fall einer Person ohne Kontaktlinsen, die ein brennendes Gefühl hatte, zeigte die zusätzliche Anwendung von Propamidin in der oben genannten Therapie eine Verbesserung des Hornhautgeschwürs. In einem anderen Fall wurden topisches Tobramycin und Cefazolin in die Therapie aufgenommen. Die Kombination von Dibromopropamidin und Propamidin-Isethionat-Salbe und -Tropfen sowie Neomycin-Tropfen werden erfolgreich bei einem 44-jährigen Patienten mit einer Hornhautinfektion durch Acanthamoeba-Arten eingesetzt.
Die beidseitige Acanthamoeba-Keratitis wurde erfolgreich mit Chlorhexidin, Polyhexamethylen-Biguanid und Propamidin-Isethionat in Kombination mit Atropin und Dibromopropamidin behandelt, und es wurde eine Verbesserung festgestellt, woraufhin Atropin und Dibromopropamidin abgesetzt wurden, während Fluorometholonacetat, Acyclovir und Ciprofloxacin verschrieben und der Patient entlassen wurde. Wenige Studien zeigen, dass die Zugabe von Neomycin-Polymyxin B ebenfalls zu guten Ergebnissen führt.
Vorbeugung
Vor allem Kontaktlinsenträger müssen bei der Reinigung der Linsen Vorsicht walten lassen und sollten niemals Leitungswasser oder Kochsalzlösung zur Reinigung verwenden. Da die Behandlung giftig und langwierig ist, sollten sie zum Arzt gehen, wenn sie Anzeichen einer Entzündung feststellen. Und wer keine Linsen trägt, sollte seine Augen nicht mit See- oder Meerwasser waschen.
- Illingworth CD, Cook SD (1998) Acanthamoeba keratitis. Surv Ophthalmol 42: 493-508.
- Manikandan P, Bhaskar M, Revathy R, John RK, Narendran V, et al. (2004) Acanthamoeba keratitis: Ein epidemiologischer Überblick über sechs Jahre in einem Augenkrankenhaus der Tertiärversorgung in Südindien. Indian J Med Microbiol 22: 226-230.
- Srinivasan M, Gonzales CA, George C, Cevallos V, Mascarenhans JM, et al . (1997) Epidemiologie und ätiologische Diagnose von Hornhautulzerationen in Madurai, Südindien. Br J Ophthalmol 81: 965-971.
- Leck AK, Thomas PA, Hagan M, Kalimurthy J, Ackuaku E, et al . Ätiologie von eitrigen Hornhautgeschwüren in Ghana und Südindien und Epidemiologie der Pilzkeratitis. Br J Ophthalmol86: 1211-1215.
- Basak SK, Basak S, Mohanta A, Bhowmick A (2005) Epidemiological and microbiological diagnosis of suppurative keratitis in Gangetic West Bengal, Eastern India. Indian J Ophthalmol 53: 17-22.
- Patel A, Hammersmith K (2008) Contact lens-related microbial keratitis: recent outbreaks. Curr Opin Ophthalmol 19: 302-306.
- Thebpatiphat N, Hammersmith KM, Rocha FN (2007) Acanthamoeba keratitis: a parasite on the rise. Cornea 26: 701-706.
- Verani JR, Lorick SA, Yoder JS (2009) National outbreak of Acanthamoeba keratitis associated with use of a contact lens solution, United States. Emerg Infect Dis 15: 1236-1242.
- DE Jonckheere (1991) JF: Ecology of Acanthamoeba. Rev Infect Dis 13: S385-S387.
- Pasricha G, Sharma S, Garg P, Aggarwal R (2003) Use of 18S rRNA Gene-Based PCR Assay for Diagnosis of Acanthamoeba Keratitis in Non-Contact Lens Wearers in India journal of Clinical Microbiology 41: 3206-3211.
- Schroeder JM, Booton GC, Hay J, Niszl IA, Seal DV, et al. (2001) Use of subgenic 18S ribosomal DNA PCR and sequencing for genus and genotype identification of acanthamoebae from humans with keratitis and from sewage sludge. J Clin Microbiol 39: 1903-1911.
- Stothard DR, Hay J, Schroeder-Diedrich JM, Seal DV, Byers TJ (1999) Fluorescent oligonucleotide probes for clinical and environmental detection of Acanthamoeba and the T4 18S rRNA gene sequence type. J Clin Microbiol 37: 2687-2693.
- Wright P, Warhurst D, Jones BR (1985) Acanthamoeba keratitis successfully treated medically. Br J Ophthalmol 69: 778-782.
- Duff D, Horne MD, Mary EF (1994) Acanthamoeba keratitis: an emerging clinical Problem. Can Med Assoc J 150: 1.
- Wright P, Warhurst D, Barrie R (1985) Acanthamoeba keratitis successfully treated medically. Br J Ophthalmol 69: 778-782.
- Hassanlou M, Bhargava A, Hodge WG (2006) Acanthamoeba keratitis and treatment strategy based on lesion depth. Can J Ophthalmol 41: 71-73.
- Wang IJ, Hong JP, Hu FR (1997) Clinical features and outcome of Acanthamoeba keratitis. J Formosan Med Assn 96: 895-900.