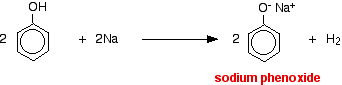A fenol savassága
A szénhidrogénhez kötött -OH csoportot tartalmazó vegyületek, mint az alkoholok és a fenol, nagyon gyenge savak. Az alkoholok olyan gyengén savasak, hogy normál laboratóriumi célokra savasságukat gyakorlatilag figyelmen kívül lehet hagyni. A fenol azonban kellően savas ahhoz, hogy felismerhetően savas tulajdonságokkal rendelkezzen – még akkor is, ha ez egy nagyon gyenge sav. A hidrogénion elszakadhat az -OH csoporttól, és átkerülhet egy bázisba. Például vízben oldva:

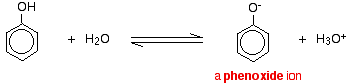
A fenol nagyon gyenge sav, és az egyensúlyi helyzet jóval balra fekszik. A fenol azért veszíthet hidrogéniont, mert a keletkező fenoxidion bizonyos mértékig stabilizálódik. Az oxigénatom negatív töltése delokalizálódik a gyűrű körül. Minél stabilabb az ion, annál nagyobb valószínűséggel képződik. Az oxigénatom egyik magányos párja átfedésben van a benzolgyűrű delokalizált elektronjaival.
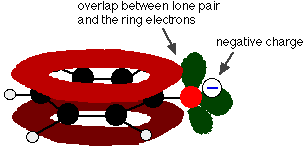
Ez az átfedés olyan delokalizációhoz vezet, amely a gyűrűből az oxigénatomra terjed ki. Ennek eredményeként a negatív töltés már nem lokalizálódik teljesen az oxigénen, hanem szétterül az egész ion körül.
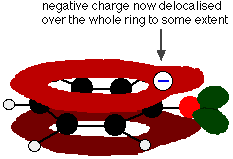
A töltés szétterülése stabilabbá teszi az iont, mintha az összes töltés az oxigénen maradna. Az oxigén azonban a legelektronegatívabb elem az ionban, és a delokalizált elektronok felé vonzódnak. Ez azt jelenti, hogy még mindig sok töltés lesz az oxigén körül, ami hajlamos lesz visszahúzni a hidrogéniont. Ezért a fenol csak nagyon gyenge sav.
Miért sokkal erősebb sav a fenol, mint a ciklohexanol? A kérdés megválaszolásához azt kell értékelnünk, hogy az oxigén-szubsztituens milyen módon lép kölcsönhatásba a benzolgyűrűvel. Amint azt az elektrofil aromás szubsztitúciós reakciók korábbi tárgyalásánál megjegyeztük, az oxigén-szubsztituens fokozza a gyűrű reaktivitását, és kedvez az elektrofil támadásnak az orto- és para-helyeken. Azt javasoltuk, hogy az oxigén nem kötött elektronpárjának rezonancia delokalizációja az aromás gyűrű pi-elektron rendszerében felelős ezért a szubsztituens hatásért. Hasonló rezonanciaszerkezetek a fenolát-anion konjugált bázisára a fenolszerkezetek alatt jelennek meg.
A rezonancia-stabilizáció ebben a két esetben nagyon eltérő. A rezonancia fontos alapelve, hogy a töltésszétválasztás csökkenti a kanonikus hozzájárulók jelentőségét a rezonanciahibridben, és csökkenti a teljes stabilizációt. A fenolhibridhez hozzájáruló szerkezetek mindegyike töltésszétválást szenved, ami ennek a vegyületnek nagyon szerény stabilizációját eredményezi. Másrészt a fenolát-anion már töltött, és a kanonikus járulékos tényezők a töltés szétoszlatására hatnak, ami e faj jelentős stabilizációját eredményezi. Az egyszerű alkoholok konjugált bázisai nem stabilizálódnak töltésdelokalizációval, így e vegyületek savassága a vízéhez hasonló. A rezonancia ciklohexanol és fenol savasságra gyakorolt hatását bemutató energiadiagram a jobb oldalon látható. Mivel a fenolát konjugált bázis rezonancia-stabilizációja sokkal nagyobb, mint magának a fenolnak a stabilizációja, a fenol savassága a ciklohexanolhoz képest megnő. Azt, hogy a fenolát negatív töltése delokalizálódik a benzolgyűrű orto- és para-szénatomjain, alátámasztja az elektronelvonó szubsztituensek hatása ezeken a helyeken.

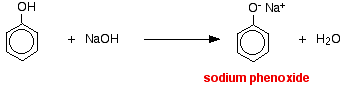
A hidrogéniont ebben a reakcióban a nátrium-hidroxid-oldat erősen bázikus hidroxidionja távolította el.
A savak a reaktívabb fémekkel reagálva hidrogéngázt adnak. A fenol sem kivétel – az egyetlen különbség a lassú reakció, mivel a fenol olyan gyenge sav. A fenolt egy száraz csőben olvadásig melegítjük, és egy kis nátriumot adunk hozzá. Némi sistergés tapasztalható, miközben hidrogéngáz szabadul fel. A csőben maradt keverék nátrium-fenoxidot tartalmaz.