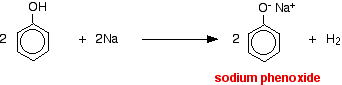Acidity of Phenol
アルコールやフェノールのように炭化水素に -OH 基がついている化合物は、非常に弱い酸です。 アルコールは非常に弱酸性であるため、通常の実験ではその酸性度をほとんど無視することができる。 しかし、フェノールは十分な酸性であるため、たとえ非常に弱い酸であっても、酸の特性を認識することができます。 水素イオンは-OH基から離れ、塩基に移動することができる。 例えば、水溶液の場合、

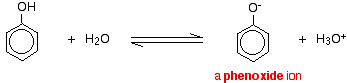
フェノールは非常に弱い酸であり、平衡の位置は左側にある。 フェノキシドイオンがある程度安定化されているため、フェノールは水素イオンを失うことができる。 酸素原子の負電荷は環の周りに非局在化されている。 イオンが安定であればあるほど、形成される可能性は高くなる。 酸素原子上の孤立対の1つは、ベンゼン環上の非局在化した電子と重なり、
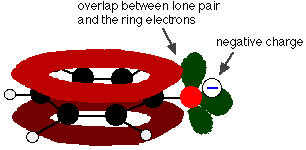
この重なりにより、環から酸素原子の上に広がる非局在化が起こる。 その結果、負の電荷は酸素に完全に局在せず、イオン全体に広がります。
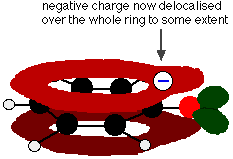
電荷を広げることで、すべての電荷が酸素にある場合よりも、イオンはより安定になるのです。 しかし、酸素はイオンの中で最も電気陰性度の高い元素であり、非局在化した電子は酸素の方に引き寄せられます。 つまり、酸素の周りにはまだ多くの電荷が残っていて、それが再び水素イオンを引き寄せる傾向があるのです。 これがフェノールが非常に弱い酸である理由です。
なぜフェノールはシクロヘキサノールよりはるかに強い酸なのでしょうか。 この疑問に答えるには、酸素置換基とベンゼン環の相互作用の仕方を評価する必要がある。 先の求電子的芳香族置換反応の項で述べたように、酸素置換基は環の反応性を高め、オルト位やパラ位での求電子的攻撃を促進する。 この置換基効果は、酸素の非結合電子対が芳香環のπ電子系に共鳴非局在化することによって起こることが提唱された。 フェノラートアニオン共役塩基の同様の共鳴構造群がフェノール構造の下に現れる。
これら2つのケースの共鳴安定化は非常に異なっている。 共鳴の重要な原理は、電荷分離が共鳴ハイブリッドに対する正規の寄与者の重要性を低下させ、全体の安定化を減少させるということである。 フェノールハイブリッドに寄与する構造はすべて電荷分離を起こし、その結果、この化合物の安定化は非常に控えめなものになった。 一方、フェノール酸アニオンはすでに帯電しており、カノニカルな寄与は電荷を分散させるように作用し、この種の実質的な安定化をもたらす。 単純アルコールの共役塩基は電荷の非局在化によって安定化されないので、これらの化合物の酸性度は水の酸性度と同様である。 シクロヘキサノールとフェノールの酸性度に対する共鳴の影響を示すエネルギー図を右に示す。 フェノール酸共役塩基の共鳴安定化はフェノール自体の安定化よりはるかに大きいので、シクロヘキサノールに対するフェノールの酸性度は増加する。 フェノラート負電荷がベンゼン環のオルトおよびパラ炭素上に非局在化されていることを裏付ける証拠は、それらの部位における電子吸引性置換基の影響から得られる。

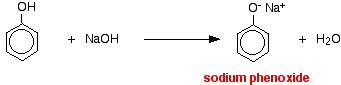
この反応では、水素イオンが水酸化ナトリウム溶液中の強塩基性水酸化物イオンにより除去されている。
酸はより反応性の高い金属と反応して水素ガスを発生する。 フェノールも例外ではなく、フェノールは弱酸なので反応が遅いのが唯一の違いである。 フェノールをドライチューブの中で溶けるまで温め、小さなナトリウムを加える。 水素ガスが発生し、発泡します。 管に残った混合物にはフェノキシド・ナトリウムが含まれる