Wetenschap > Scheikunde > Derde Rij Elementen > Concept van metaalbinding en metaalhoudende vaste stoffen
In dit artikel zullen we het concept van metaalbinding en metaalbindingen in natrium-, magnesium- en aluminiumkristallen bestuderen.
Concept van metaalbinding:
De metaalbinding wordt gedefinieerd als de aantrekkingskracht die metaalkationen bindt aan een aantal mobiele of gedelokaliseerde elektronen binnen zijn invloedssfeer die de metaalkationen in een bepaald patroon bij elkaar houdt. Om de aard van de metaalbinding te verklaren werden vele theorieën voorgesteld. De vrije-elektronentheorie of elektronenzeetheorie is een van de eenvoudigste theorieën die door Drude en Lorentz werd voorgesteld. Enkele belangrijke postulaten van deze theorie zijn als volgt:
Vrije-elektronentheorie van metaalbinding:
Metaalatomen hebben minder valentie-elektronen, zodat zij veel lege valentie-banen hebben. Bij Na, Mg en Al zijn 3p-banen vacant.
| Naam | Symbool | Atomisch nr. | Elektronische configuratie | Gedetailleerde configuratie |
| Natrium | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnesium | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Aluminium | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Ionisatiepotentiaalwaarden van metalen zijn laag, waardoor valentie-elektronen losjes worden vastgehouden en gemakkelijk kunnen worden verwijderd. De dicht opeengepakte structuur van het metaalkristal bestaat uit de atomen van het metaal die in alle opzichten identiek zijn.
De niet-bezette banen van dicht opeengepakte atomen van het metaal overlappen met de gelijksoortige baan van aangrenzende atomen door het kristalrooster. Valentie-elektronen worden uit hun banen verwijderd en kunnen vrij bewegen van onbezette valentiebanen van het ene atoom naar het andere. Aangezien deze valentie-elektronen niet tot een enkel atoom behoren, maar tot het kristal in zijn geheel, worden zij gedelokaliseerde of mobiele elektronen genoemd. De metaalionen (kationen) die door delokalisatie ontstaan, worden korrels genoemd. De metaalionen hebben vaste posities in het kristalrooster, terwijl de gedelokaliseerde elektronen vrij zijn om in het kristalrooster te bewegen. Aldus kan metaal worden beschouwd als een aggregatie van metaalkationen ondergedompeld in een zee van mobiele elektronen.
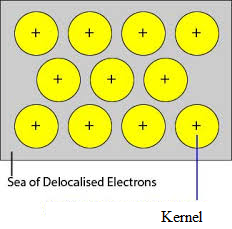
Omdat de elektronen in de metalen gedelokaliseerd zijn, en zij worden verondersteld uniform verdeeld te zijn over het kristalrooster. De aantrekkingskrachten tussen de metaalionen en de gedelokaliseerde elektronen zijn uniform in alle richtingen. Vandaar dat de metaalbinding niet richtingsgebonden is.
De eenheden die roosterpunten bezetten in Natrium, Magnesium, Aluminium zijn positieve ionen van hen respectievelijk en zijn omgeven door mobiele elektronen. Aldus zijn Natrium, Magnesium, en Aluminium metallische vaste stoffen.
Als wij van links naar rechts gaan, d.w.z. van Natrium naar Aluminium, neemt het aantal valentie-elektronen toe en vandaar neemt de sterkte van de binding toe van Natrium naar Aluminium.
De eigenschappen zoals elektrisch en thermisch geleidingsvermogen, metaalglans, smeedbaarheid en taaiheid kunnen op basis van de vrije-elektronentheorie worden verklaard.
Karakteristieken van metaalbindingen:
- De metaalbinding wordt gedefinieerd als de aantrekkingskracht die metaalkationen bindt aan een aantal mobiele of gedelokaliseerde elektronen binnen zijn invloedssfeer die de metaalkationen in een bepaald patroon bijeenhoudt.
- De metaalbinding is niet richtingsgebonden.
- Ze zijn zwakker dan de covalente binding, maar sterker dan de krachten van van der Waal.
- De bindingen zijn niet star.
- De sterkte van de metaalbinding is direct gerelateerd aan de positieve lading van het metaalion. Dus de sterkte van de metaalbinding neemt toe als Na < Mg < Al.
Metallische vaste stoffen:
Metallische vaste stoffen zijn kristallijne vaste stoffen waarin de eenheden die roosterpunten bezetten positieve ionen zijn, omgeven door een pool van elektronen. (Concept van metaalbinding)
Kristalstructuren van metalen:
Röntgenanalyse van verschillende metaalkristallen heeft aangetoond dat metalen een van de volgende kristalstructuren aannemen.
- Lichaamsgecentreerde kubische structuur. (BCC)
- Gecentreerde kubische structuur. (FCC)
- Hexagonale dicht opeen gepakte structuur. (HCP)
Natrium (Na):
Natriummetaal heeft een lichaam gecentreerde kubische (BCC) open gepakte kristalstructuur. De binding is een niet-directionele metaalbinding.
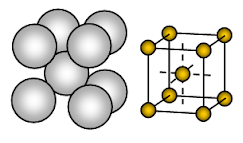
De ordening van ionen in één vlak – Cubic array – open of vierkant verpakte structuur. In deze ordening raakt elk metaalion vier aangrenzende ionen in één vlak. De volgorde van de lagen is AB, AB, AB, ……….
Natrium is een metallische vaste stof. In de eenheidscel van natrium is elk natriumion omgeven door acht andere natriumionen op gelijke afstand van elkaar. Het coordinatienummer is dus 8. Deze natriumionen zijn gerangschikt op de hoeken van een denkbeeldige kubus en in het midden van de kubus is één natriumion aanwezig. Er zijn 2 ionen aanwezig in een eenheidscel van natrium.
De natriumionen nemen slechts ongeveer 68% van de beschikbare ruimte in een eenheidscel in. Dus blijft 32% van de eenheidscel leeg (void). Omdat deze structuur meer lege ruimte heeft zijn metalen die deze structuur aannemen zacht. Natrium is dus een zacht metaal vanwege de grotere lege ruimte (ongeveer 32%) in zijn kristalstructuur en de tamelijk zwakke metaalbinding als gevolg van slechts één valentie-elektron per Na-atoom in zijn kristal.
Magnesium (Mg):
Magnesium heeft een hexagonale dicht opeen gepakte (HCP) kristalstructuur. De binding is een niet-directionele metaalbinding.
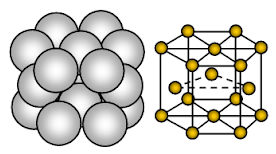
Magnesium is een metallische vaste stof. De eenheden die de roosterplaatsen bezetten zijn Mg-ionen en deze ionen zijn omgeven door mobiele of gedelokaliseerde elektronen.
De ordening van ionen in één vlak de ordening van ionen is een hexagonale array of gesloten gepakte laag. Zo raakt elk metaalion zes aangrenzende ionen in één vlak. Elk magnesiumion raakt zes magnesiumionen in zijn eigen laag, drie in de laag erboven en drie in de laag eronder. In de hexagonale gepakte structuur worden de gesloten gepakte lagen ionen gestapeld in een alternerende volgorde die gewoonlijk AB ABA ….. wordt genoemd. Elke derde laag ionen is precies gelijk aan en ligt direct boven de eerste laag.
Elk Mg-atoom is omgeven door 12 andere Mg-ionen op gelijke afstand van elkaar. Vandaar dat het coordinatiegetal 12 is. In de eenheidscel is ongeveer 26% van de beschikbare ruimte leeg (void). Deze structuur is dichter opeengepakt. Door minder lege ruimte in de kristalstructuur, meer elektronenwolk door Mg+2 en sterke metaalbinding, is magnesium harder dan natriummetaal. Het is kneedbaarder en buigzamer dan natrium.
Aluminium (Al):
Aluminium heeft een face centred cubic (FCC) kristalstructuur. De binding is een niet-directionele metaalbinding.

Aluminium is een metallische vaste stof. De eenheden die de roosterplaatsen bezetten zijn Al-ionen en deze ionen zijn omgeven door mobiele of gedelokaliseerde elektronen.
De ordening van ionen in één vlak de ordening van ionen is een hexagonale array of gesloten gepakte laag. Elk metaalion raakt dus zes aangrenzende ionen in één vlak.
In een kubische dicht opeen gepakte of face centred kubische kristalstructuur, herhaalt de opeenvolging van dicht opeen gepakte ionenlagen zich om de vierde laag. D.w.z. elke vierde ionenlaag is precies hetzelfde als en ligt direct boven de eerste laag. Het wordt dus ABC, ABC, ABC, ….. kubische dichte verpakking genoemd. Kubische dichte verpakking wordt ook wel face centred close-packed structuur genoemd, omdat vanuit een bepaalde hoek gezien, de ionen kunnen worden beschouwd als bevindend op de acht hoeken van de kubus en in het centrum van elk van de zes vlakken van de kubus, d.w.z. eenheidscel.
Elk aluminiumion (Al+3) is omgeven door 12 andere aluminiumatomen op gelijke afstand van elkaar. Vandaar dat het coördinatiegetal 12 is. In de eenheidscel van aluminium is ongeveer 26% van de beschikbare ruimte leeg (void). Door minder lege ruimte in de kristalstructuur, sterke metaalbinding, is aluminium harder, kneedbaarder en buigzamer dan natrium en magnesium.
Silicium (Si):
Covalente vaste stoffen zijn kristallijne vaste stoffen waarin de eenheidspunten van het rooster atomen zijn. De belangrijkste bindende kracht is covalente bindingen tussen atomen. Silicium is een covalent vast lichaam waarin de roosterpunten bezet worden door de atomen van het element. Silicium is een netwerk vast lichaam. Er is een netwerk van Si-Si covalente bindingen.
Het atoomnummer van Silicium is 14. De elektronische configuratie van silicium in zijn grondtoestand is 1s2, 2s22p6, 3s2 3p2. Het heeft vier valentie-elektronen in hun valentie-orbitalen. Silicium ondergaat sp3 hybridisatie waarbij vier sp3 gehybridiseerde orbitalen van gelijke energie worden gevormd. Elk siliciumatoom vormt vier covalente bindingen met vier andere naburige siliciumatomen als gevolg van SP3- SP3 Zo wordt een tetrahedrale Si4-eenheid gevormd die wordt uitgebreid tot een driedimensionale reuzenmolecule.

De Si -Si bindingen lopen ononderbroken door het kristal. Een kristal van silicium wordt dus beschouwd als een reusachtige driedimensionale molecule met een tetrahedraal netwerk van siliciumatomen die door sterke covalente bindingen aan elkaar zijn gebonden. Een vaste stof met een dergelijke structuur wordt een netwerkvaste stof genoemd. De bindingshoek tussen Si-Si is 109 o 28 ‘ terwijl de bindingslengte 2,35 o
Door overlapping van hybride orbitalen zijn de covalente bindingen tussen Si-Si zeer sterk en richtinggebonden. De aanwezigheid van een netwerk van sterke covalente bindingen verklaart de hardheid en het hoge smeltpunt.
De elektronen in de covalente binding zijn gelokaliseerd, vandaar dat silicium geen goede geleider is van elektriciteit en warmte. Maar het is een halfgeleider. Door de onbeschikbaarheid van vrije elektronen is silicium een isolator bij absolute nultemperatuur. Toch is silicium een halfgeleider. Als de temperatuur wordt verhoogd, worden covalente bindingen verbroken en komen elektronen vrij die elektriciteit kunnen geleiden. Het geleidingsvermogen neemt dus toe naarmate de temperatuur stijgt.