Het chemische element koolstof wordt geclassificeerd als een niet-metaal. Het is al sinds de oudheid bekend. De ontdekker en de datum van ontdekking zijn onbekend.

Gegevenszone
| Classificatie: | Koolstof is een niet-metaal |
| Kleur: | zwart (grafiet), transparant (diamant) |
| Atomair gewicht: | 12.011 |
| Toestand: | vast |
| Smeltpunt: | 3550 oC, 3823 K |
| Noot: Bij normale atmosferische druk smelt koolstof niet bij verhitting, maar sublimeert het. D.w.z. het ondergaat een faseverandering rechtstreeks van vast naar gas. Bij verhoging van de druk tot 10 atmosfeer smelt koolstof (grafiet) bij 3550 °C. | |
| Kookpunt: | 3825 oC, 4098 K |
| Het kookpunt wordt genoteerd wanneer de dampdruk van grafiet boven sublimerend grafiet 1 atmosfeer bereikt. | |
| Elektronen: | 6 |
| Protonen: | 6 |
| Neutronen in meest voorkomende isotoop: | 6 |
| Elektronenschillen: | 2,4 |
| Elektronenconfiguratie: | 1s2 2s2 2p2 |
| Dichtheid bij 20oC: | 2.267 g/cm3 (gr), 3.513 g/cm3 (di) |
Toon meer, o.a.: Warmte, Energie, Oxidatie, Reacties,
Samenstellingen, Stralen, Geleidbaarheden
| Atomair volume: | 5,31 cm3/mol (gr), 3.42 cm3/mol (di) | |
| Structuur: | zeshoekige lagen (grafiet), tetraëdervormig (diamant) | |
| Hardheid: | 0,5 mohs (grafiet), 10,0 mohs (diamant) | |
| Specifieke warmtecapaciteit | 0,71 J g-1 K-1 (grafiet), 0.5091 J g-1 K-1 (diamant) |
|
| Smeltwarmte | 117 kJ mol-1 (grafiet) | |
| Smeltwarmte | 717 kJ mol-1 | |
| Verdamptemperatuur | 710.9 kJ mol-1 | |
| 1ste ionisatie-energie | 1086.5 kJ mol-1 | |
| 2e ionisatie-energie | 2352.6 kJ mol-1 | |
| 3e ionisatie-energie | 4620.5 kJ mol-1 | |
| Elektronenaffiniteit | 121.55 kJ mol-1 | |
| Minimum oxidatiegetal | -4 | |
| Min. gangbaar oxidatiegetal | -4 | |
| Maximaal oxidatiegetal | 4 | |
| Max. gemeenschappelijk oxidatiegetal | 4 | |
| Elektronegativiteit (Pauling Schaal) | 2.55 | |
| Polariseerbaarheidsvolume | 1.8 Å3 | |
| Reactie met lucht | krachtig, ⇒ CO2 | |
| Reactie met 15 M HNO3 | mild, w/ht ⇒ C6(CO2H)6 (melliet/grafietzuur) | |
| Reactie met 6 M HCl | geen | |
| Reactie met 6 M NaOH | geen | |
| Oxide(s) | CO , CO2 | |
| Hydride(n) | CH4 en veel CxHy | |
| Chloride(n) | CCl4 | |
| Atomaire straal | 70 pm | |
| Ionstraal (1+ ion) | – | |
| Ionstraal (2+ ion) | – | |
| Ionstraal (3+ ion) | – | |
| Ionstraal (1- ion) | – | |
| Ionstraal (2-ion) | – | |
| Ionstraal (3-ion) | – | |
| Warmtegeleidingscoëfficiënt | 25-470 W m-1 K-1 (grafiet), 470 W m-1 K-1 (diamant) | |
| Elektrisch geleidingsvermogen | 0.07 x 106 S m-1 | |
| Vries-/Smeltpunt: | 3550 oC, 3823 K |

Modellen van koolstofnanobuisstructuur.

Lavoisier gebruikt een reusachtige lens in verbrandingsexperimenten
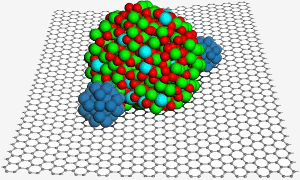
Een grafeenoppervlak herbergt een indiumtinoxide nanodeeltje, dat helpt twee platina nanodeeltjes (blauw) vast te zetten voor verbeterde katalyse in een brandstofcel. Beeld: PNL.
Ontdekking van Koolstof
Koolstof is al sinds de oudheid bekend in de vorm van roet, houtskool, grafiet en diamanten. Oude culturen beseften natuurlijk niet dat deze stoffen verschillende vormen van hetzelfde element waren.
De Franse wetenschapper Antoine Lavoisier gaf koolstof een naam en hij voerde verschillende experimenten uit om de aard ervan te onthullen.
In 1772 kocht hij samen met andere scheikundigen een diamant, die zij in een gesloten glazen pot plaatsten. Ze richtten de zonnestralen op de diamant met een opmerkelijke reuzenloep en zagen de diamant verbranden en verdwijnen.
Lavoisier merkte op dat het totale gewicht van de pot onveranderd was en dat de diamant zich bij het verbranden met zuurstof had gecombineerd tot kooldioxide. (1), (2) Hij concludeerde dat diamant en houtskool uit hetzelfde element bestonden – koolstof.
In 1779 toonde de Zweedse wetenschapper Carl Scheele aan dat grafiet verbrandde tot kooldioxide en dus een andere vorm van koolstof moest zijn.(3)
In 1796 stelde de Engelse scheikundige Smithson Tennant vast dat diamant zuivere koolstof was en geen verbinding van koolstof; hij verbrandde tot uitsluitend kooldioxide.
Tennant bewees ook dat wanneer gelijke gewichten houtskool en diamant werden verbrand, zij dezelfde hoeveelheid kooldioxide produceerden. (4)
In 1855 produceerde de Engelse scheikundige Benjamin Brodie zuiver grafiet uit koolstof, waarmee hij bewees dat grafiet een vorm van koolstof is.(4)
Hoewel dit al eerder zonder succes was geprobeerd, toonden de Amerikaanse wetenschapper Francis Bundy en zijn medewerkers van General Electric in 1955 eindelijk aan dat grafiet bij hoge temperatuur en hoge druk in diamant kon worden getransformeerd.(5)
In 1985 ontdekten Robert Curl, Harry Kroto en Richard Smalley fullerenen, een nieuwe vorm van koolstof waarin de atomen in voetbal-vorm zijn gerangschikt. De bekendste fullereen is buckminsterfullereen, ook bekend als C60, bestaande uit 60 koolstofatomen. Er bestaat een grote familie van fullerenen, beginnend bij C20 en reikend tot C540. (6), (7)
De meest recent ontdekte allotroop van koolstof is grafeen, dat bestaat uit een enkele laag van koolstofatomen, gerangschikt in zeshoeken. Als deze lagen op elkaar gestapeld zouden worden, zou grafiet het resultaat zijn. Grafeen heeft een dikte van slechts één atoom.
De ontdekking van grafeen werd in 2004 bekendgemaakt door Kostya Novoselov en Andre Geim, die plakband gebruikten om een enkele laag atomen van grafiet los te maken en zo de nieuwe allotroop te produceren.
Belangrijke feiten over koolstof
- Bijna 20% van het gewicht van levende organismen bestaat uit koolstof.
- Er zijn meer verbindingen bekend die koolstof bevatten dan die geen koolstof bevatten.
- Koolstof is het op drie na meest voorkomende element in het heelal.
- Ondanks zijn grote overvloed danken we het bestaan van koolstof aan een onwaarschijnlijke reeks omstandigheden
- Diamant is een uitstekend schuurmiddel omdat het het hardste gewone materiaal is en ook de hoogste thermische geleidbaarheid heeft. Het kan elke stof wegslijpen, terwijl de door wrijving opgewekte warmte snel wordt afgevoerd.
- De koolstofatomen in uw lichaam maakten ooit allemaal deel uit van de kooldioxide-fractie van de atmosfeer.
- Grafeen is het dunste, sterkste materiaal dat ooit bekend is geweest.
- Grafeen is gemaakt van 2-dimensionale atoomkristallen, de eerste keer dat dergelijke structuren ooit zijn gezien.
- Het grafiet in een doorsnee mechanisch potlood heeft een diameter van 0,7 mm. Dit is gelijk aan 2 miljoen lagen grafeen.
- Autobanden zijn zwart omdat ze voor ongeveer 30% uit carbon black bestaan, dat aan rubber wordt toegevoegd om het te versterken. De koolstof helpt ook beschermen tegen UV-schade aan de banden.(8)
- Koolstof wordt gemaakt in sterren wanneer ze helium verbranden in kernfusiereacties. Koolstof maakt deel uit van de ‘as’ die wordt gevormd door de verbranding van helium.
- Koolstof ondergaat kernfusiereacties in zware sterren om neon, magnesium en zuurstof te maken.




Links: Verbranding van steenkool (voornamelijk amorfe koolstof) in lucht. Rechts: Diamanten (kristallijne koolstof). We hebben overwogen om een foto te maken van brandende diamanten – ze ontbranden bij ongeveer 800oC – maar dat konden we ons niet veroorloven!

Op koolstof gebaseerde levensvormen, zoals deze, domineren onze planeet.

DNA. De beroemde dubbele-helixmolecule wordt mogelijk gemaakt door het vermogen van koolstof om lange moleculaire ketens te vormen.
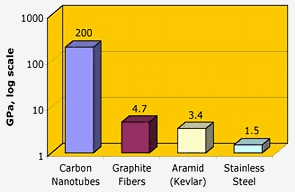
Nasa: Koolstofnanobuisjes hebben een uitstekende treksterkte – twee orden van grootte hoger dan grafietvezels, kevlar of staal.
Carbon’s Periodic Table Neighborhood
| Group 13 |
Group 14 |
Groep 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
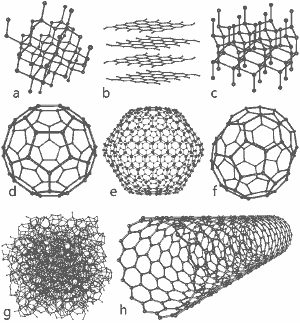
Een prachtige afbeelding vrijgegeven door Michael Ströck onder de GNU Free Documentation License: De structuren van acht allotropen van koolstof: a) Diamant b) Grafiet c) Lonsdaleiet d) C60 (Buckminsterfullerene) e) C540 Fullerene f) C70 Fullerene g) Amorfe koolstof h) Enkelwandige koolstofnanobuis. Klik hier voor grotere afbeelding.
Opzicht en kenmerken
Schadelijke effecten:
Zuivere koolstof is zeer weinig giftig. Het inademen van grote hoeveelheden zwartkoolstof (roet/kolenstof) kan irritatie en beschadiging van de longen veroorzaken.
Eigenschappen:
Koolstof kan bestaan in verschillende driedimensionale structuren waarin de atomen verschillend zijn gerangschikt (allotropen).
Drie veel voorkomende kristallijne allotropen zijn grafiet, diamant, en (meestal) fullerenen. Grafeen heeft een 2D-kristalstructuur.(Fullerenen kunnen soms in amorfe vorm bestaan.)(9)
Koolstof kan ook in een amorfe toestand bestaan. Veel allotropen die gewoonlijk als amorf worden beschreven, zoals glasachtige koolstof, roet of zwarte koolstof, hebben echter voldoende structuur om niet echt amorf te zijn. Hoewel kristallijne nanobuisjes zijn waargenomen, zijn ze over het algemeen amorf.(10)
De structuren van acht allotropen worden onderaan deze pagina getoond.
Interessant is dat grafiet een van de zachtste stoffen is en dat men tot voor kort dacht dat diamant de hardste in de natuur voorkomende stof was.
Men heeft berekend dat een uiterst zeldzame allotroop van koolstof, lonsdaleiet, in zuivere vorm 58% sterker is dan diamant. Lonsdaleite is een diamantachtig koolstofnetwerk dat de hexagonale structuur van grafiet heeft. Het ontstaat wanneer meteorieten die grafiet bevatten, inslaan op een ander lichaam, zoals de aarde. De hoge temperaturen en druk van de inslag transformeren het grafiet in lonsdaleiet.
Koolstof heeft het hoogste smelt-/sublimatiepunt van alle elementen en heeft, in de vorm van diamant, de hoogste thermische geleidbaarheid van alle elementen.
De hoge thermische geleidbaarheid van diamant is de oorsprong van de jargonterm ‘ijs’. Bij normale kamertemperaturen is je lichaamstemperatuur hoger dan die van de kamer – inclusief grote diamanten die je toevallig in de buurt hebt liggen. Als u deze diamanten aanraakt, voert hun hoge warmtegeleidingsvermogen de warmte sneller van uw huid weg dan elk ander materiaal. Uw hersenen interpreteren deze snelle overdracht van warmte-energie van uw huid als een teken dat u iets heel kouds aanraakt – dus diamanten op kamertemperatuur kunnen aanvoelen als ijs.
Toepassingen van koolstof
Koolstof (in de vorm van steenkool, dat voornamelijk uit koolstof bestaat) wordt gebruikt als brandstof.
Grafiet wordt gebruikt voor potloodpunten, hoge temperatuur smeltkroezen, droge cellen, elektroden en als smeermiddel.
Diamanten worden gebruikt in sieraden en – omdat ze zo hard zijn – in de industrie voor snijden, boren, slijpen en polijsten.
Carbon black wordt gebruikt als het zwarte pigment in drukinkt.
Carbon kan legeringen vormen met ijzer, waarvan de meest voorkomende koolstofstaal is.
De radioactieve isotoop 14C wordt gebruikt bij archeologische dateringen.
Koolstofverbindingen zijn belangrijk in veel gebieden van de chemische industrie – koolstof vormt een groot aantal verbindingen met waterstof, zuurstof, stikstof en andere elementen.
Bundantie en isotopen
Bundantie aardkorst: 200 delen per miljoen in gewicht, 344 delen per miljoen in mol
Bundantie zonnestelsel: 3000 delen per miljoen in gewicht, 300 delen per miljoen in mollen
Kosten, zuiver: $2,4 per 100g
Kosten, bulk: $ per 100g
Bron: Koolstof kan worden verkregen door verbranding van organische verbindingen met onvoldoende zuurstof. De vier belangrijkste allotropen van koolstof zijn grafiet, diamant, amorfe koolstof en fullerenen.
Natuurlijke diamanten worden gevonden in kimberliet van oude vulkanen.
Grafiet kan ook worden gevonden in natuurlijke afzettingen.
Fullerenen werden ontdekt als bijproducten van moleculaire straalexperimenten in de jaren 1980.
Amorfe koolstof is het belangrijkste bestanddeel van houtskool, roet (carbon black), en actieve kool.
Isotopen: 13 waarvan de halfwaardetijden bekend zijn, met massanummers 8 tot 20. Natuurlijk voorkomende koolstof is een mengsel van twee isotopen en ze worden gevonden in de getoonde percentages: 12C (99%) en 13C (1%).
Isotoop 14C, met een halfwaardetijd van 5730 jaar, wordt veel gebruikt om koolstofhoudende materialen zoals hout, archeologische specimens, enz. te dateren voor leeftijden tot ongeveer 40 000 jaar.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide., (2006) p192. Greenwood Publishing Group
- Mary Elvira Weeks, De ontdekking van de elementen. I. Elements known to the ancient world., J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses., (2006) p507. SME.
- Amanda S. Barnard, The diamond formula: diamond synthesis-a gemological perspective., (2000) p3. Butterworth-Heinemann
- Robert M. Hazen, De diamantenmakers., (1999) p145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) p423. Wiley.
- Nobelprijs voor de Scheikunde, 1996
- Wat hebben we nodig om een band te maken?
- Ming Gao and Hui Zhang, Preparation of an amorphous fullerene film., Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6
Cite this Page
Voor online linken, kopieer en plak een van de volgende:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
of
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Voor het citeren van deze pagina in een academisch document, gebruik dan de volgende MLA-conforme citatie:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.