Științe > Chimie > Elemente din al treilea rând > Conceptul de legătură metalică și solide metalice
În acest articol vom studia conceptul de legătură metalică și legăturile metalice în cristalele de sodiu, magneziu și aluminiu.
Conceptul de legătură metalică:
Legătura metalică este definită ca fiind forța de atracție care leagă cationii metalici de un număr de electroni mobili sau delocalizați în sfera sa de influență, care ține împreună cationii metalici într-un model definit. Pentru a explica natura legăturii metalice au fost propuse mai multe teorii. Teoria electronilor liberi sau teoria mării electronice este una dintre cele mai simple teorii propuse de Drude și Lorentz. Unele dintre postulatele importante ale acestei teorii sunt următoarele:
Teoria electronilor liberi a legăturii metalice:
Atomii metalici au un număr mai mic de electroni de valență, astfel încât au mulți orbitali de valență vacanți. Na, Mg și Al au orbitali 3p vacanți.
| Nume | Simbol | Numărul atomic | . | Configurație electronică | Configurație detaliată | |
| Sodiu | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 | ||
| Magneziu | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 | ||
| Aluminiu | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Valorile potențialului de ionizare ale metalelor sunt scăzute, prin urmare electronii de valență sunt slab reținuți și pot fi îndepărtați cu ușurință. Structura strâns împachetată a cristalului metalic este formată din atomi ai metalului care sunt identici din toate punctele de vedere.
Orbitalele neocupate ale atomilor strâns împachetați ai metalului se suprapun cu orbitalul similar al atomilor adiacenți prin rețeaua cristalină. Electronii de valență îndepărtați din orbitalii lor și se pot deplasa liber din orbitele de valență vacante ale unui atom în altul. Deoarece acești electroni de valență nu aparțin unui singur atom, ci cristalului ca întreg, ei sunt numiți electroni delocalizați sau mobili. Ionii metalici (cationi) produși ca urmare a delocalizării se numesc nuclee. Ionii metalici au poziții fixe în rețeaua cristalină, în timp ce electronii delocalizați sunt liberi să se deplaseze în rețeaua cristalină. Astfel, metalul poate fi considerat ca o agregare de cationi metalici scufundați într-o mare de electroni mobili.
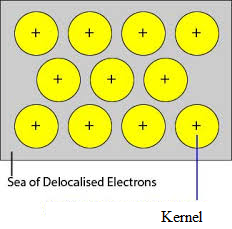
Din moment ce electronii din metale sunt delocalizați și se presupune că aceștia sunt distribuiți uniform în rețeaua cristalină. Forțele de atracție dintre ionii metalici și electronii delocalizați sunt uniforme pe toate direcțiile. Prin urmare, legătura metalică este non-direcțională.
Unitățile care ocupă punctele de rețea în Sodiu, Magneziu, Aluminiu sunt ioni pozitivi ai acestora, respectiv și sunt înconjurate de electroni mobili. Astfel, Sodiul, Magneziul și Aluminiul sunt solide metalice.
Pe măsură ce ne deplasăm de la stânga la dreapta, adică de la Sodiu la Aluminiu, numărul de electroni de valență crește și, prin urmare, rezistența legăturii crește de la Sodiu la Aluminiu.
Proprietățile precum conductivitatea electrică și termică, strălucirea metalică, maleabilitatea și ductilitatea pot fi explicate pe baza teoriei electronilor liberi.
Caracteristicile legăturilor metalice:
- Legătura metalică este definită ca fiind forța de atracție care leagă cationii metalici de un număr de electroni mobili sau delocalizați în sfera sa de influență, care ține împreună cationii metalici într-un model definit.
- Legătura metalică este non-direcțională.
- Este mai slabă decât legătura covalentă, dar mai puternică decât forțele lui van der Waal.
- Legăturile nu sunt rigide.
- Tăria legăturii metalice este direct legată de sarcina pozitivă a ionului metalic. Astfel, rezistența legăturii metalice crește pe măsură ce Na < Mg < Al.
Solidele metalice:
Solidele metalice sunt solide cristaline în care unitățile care ocupă punctele de rețea sunt ioni pozitivi înconjurați de un grup de electroni. (Conceptul de legătură metalică)
Structuri cristaline ale metalelor:
Analizele cu raze X ale diferitelor cristale metalice au arătat că metalele adoptă oricare dintre următoarele structuri cristaline.
- Structura cubică centrată pe corp. (BCC)
- Structura cubică centrată pe față. (FCC)
- Structură hexagonală cu pachete apropiate. (HCP)
Sodiu (Na):
Sodiul metalic are o structură cristalină cubică centrată pe corp (BCC) cu pachete deschise. Legătura este o legătură metalică non-direcțională.
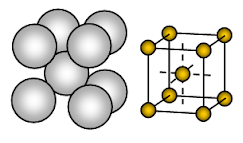
Dispoziția ionilor într-un plan- Rețea cubică – structură deschisă sau pătrată împachetată. În acest aranjament, fiecare ion metalic atinge patru ioni adiacenți într-un plan. Secvența straturilor este AB, AB, AB, AB, ……….
Sodul este un solid metalic. În celula unitară a sodiului, fiecare ion de sodiu este înconjurat de alți opt ioni de sodiu echidistanți. Prin urmare, numărul de coordinare este 8. Acești ioni de sodiu sunt dispuși în colțurile unui cub imaginar, iar în centrul cubului este prezent un singur ion de sodiu. Într-o celulă unitară de sodiu sunt prezenți 2 ioni.
Ionii de sodiu ocupă doar aproximativ 68% din spațiul disponibil într-o celulă unitară. Așadar, 32% din celula unitară rămâne goală (vid). Deoarece această structură are mai mult spațiu gol, metalele care adoptă această structură sunt moi. Astfel, sodiul este un metal moale din cauza mai mult spațiu gol (aproximativ 32% ) în structura sa cristalină și a legăturii metalice destul de slabe datorită unui singur electron de valență pentru fiecare atom de Na din cristalul său.
Magneziu (Mg):
Magneziul are o structură cristalină hexagonală cu pachete apropiate (HCP). Legătura este o legătură metalică non-direcțională.
Magneziul este un solid metalic. Unitățile care ocupă locurile din rețea sunt ionii de Mg și acești ioni sunt înconjurați de electroni mobili sau delocalizați.
Dispoziția ionilor într-un plan dispunerea ionilor este o matrice hexagonală sau un strat închis împachetat. Astfel, fiecare ion metalic se atinge de șase ioni adiacenți într-un plan. Fiecare ion de magneziu atinge șase ioni de magneziu în propriul strat, trei în stratul de deasupra și trei în stratul de dedesubt. În structura hexagonală compactă, straturile compacte închise de ioni sunt stivuite într-o secvență alternantă numită de obicei AB ABA ….. Fiecare al treilea strat de ioni este exact la fel ca și se află direct deasupra primului strat.
Care atom de Mg este înconjurat de alți 12 ioni de Mg echidistanți. Prin urmare, numărul de coordinare este 12. În celula unitară, aproximativ 26% din spațiul disponibil este gol (vid). Această structură este mai strâns împachetată. Datorită unui spațiu gol mai mic în structura cristalină, a unui nor de electroni mai mare datorită Mg+2 și a legăturii metalice puternice, magneziul este mai dur decât metalul sodiu. Este mai maleabil și mai ductil decât sodiul.
Aluminiul (Al):
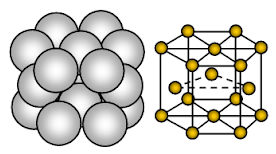
Aluminiul are o structură cristalină cubică cu fețe centrate (FCC). Legătura este o legătură metalică non-direcțională.

Aluminiul este un solid metalic. Unitățile care ocupă situsurile rețelei sunt ionii de Al și acești ioni sunt înconjurați de electroni mobili sau delocalizați.
Dispoziția ionilor într-un plan dispunerea ionilor este o matrice hexagonală sau un strat închis împachetat. Astfel, fiecare ion metalic atinge șase ioni adiacenți într-un plan.
Într-o structură cristalină cubică închisă sau cubică cu fața centrată, secvența de straturi de ioni închiși se repetă la fiecare al patrulea strat. Adică fiecare al patrulea strat de ioni este exact același cu primul strat și se află direct deasupra acestuia. Se numește astfel ABC, ABC, ABC, ABC, ….. cubic close packing. Împachetarea strânsă cubică se mai numește și structură cu fețe centrate, deoarece, dacă este privită dintr-un anumit unghi, se poate considera că ionii se află în cele opt colțuri ale cubului și în centrul fiecăreia dintre cele șase fețe ale cubului, adică în celula unitară.
Care ion de aluminiu (Al+3) este înconjurat de alți 12 atomi de aluminiu echidistanți. Prin urmare, numărul de coordinare este 12. În celula unitară a aluminiului, aproximativ 26% din spațiul disponibil este gol (vid). Datorită spațiului gol mai mic din structura cristalină, a legăturii metalice puternice, aluminiul este mai dur, mai maleabil și mai ductil decât sodiul și magneziul.
Siliciul (Si):
Solidele covalente sunt solide cristaline în care punctele rețelei unitare sunt atomii. Forța majoră de legătură este reprezentată de legăturile covalente dintre atomi. Siliciul este un solid covalent în care punctele de rețea sunt ocupate de atomii elementului. Siliciul este un solid de rețea. Există o rețea de legături covalente Si-Si.
Numărul atomic al siliciului este 14. Configurația electronică a siliciului în starea sa fundamentală este 1s2, 2s22p6, 3s2 3p2. Are patru electroni de valență în orbitalii lor de valență. Siliciul suferă o hibridizare sp3, formând patru orbitali hibridizați sp3 de energie egală. Fiecare atom de siliciu formează patru legături covalente cu alți patru atomi de siliciu vecini datorită SP3- SP3 Astfel se formează unitatea tetraedrică Si4 care se extinde pentru a forma o moleculă gigantică tridimensională.

Legăturile Si -Si se desfășoară continuu în tot cristalul. Astfel, un cristal de siliciu este privit ca o moleculă gigantică tridimensională având o rețea tetraedrică de atomi de siliciu legați între ei prin legături covalente puternice. Solidul care conține o astfel de structură se numește solid de rețea. Unghiul legăturii Si-Si este de 109 o 28 ‘ în timp ce lungimea legăturii este de 2,35 o
Datorită suprapunerii orbitalilor hibrizi, legăturile covalente Si-Si sunt foarte puternice și sunt direcționale. Prezența rețelei de legături covalente puternice explică duritatea și punctul său ridicat de topire.
Electronii din legătura covalentă sunt localizați, prin urmare siliciul nu este un bun conductor de electricitate și căldură. Dar este un semiconductor. Din cauza indisponibilității electronilor liberi, siliciul este un izolator la temperatura zero absolut. Cu toate acestea, siliciul este un semiconductor. Dacă temperatura crește, legăturile covalente se rup, electronii se eliberează și pot conduce electricitatea. Astfel, conductivitatea crește odată cu creșterea temperaturii.
Științe > Chimie > Elemente din rândul al treilea > Conceptul de legătură metalică și solide metalice
.