Das chemische Element Kohlenstoff gehört zu den Nichtmetallen. Es ist seit dem Altertum bekannt. Sein Entdecker und das Datum seiner Entdeckung sind unbekannt.

Datenbereich
| Klassifizierung: | Kohlenstoff ist ein Nichtmetall |
| Farbe: | schwarz (Graphit), transparent (Diamant) |
| Atomgewicht: | 12.011 |
| Zustand: | fest |
| Schmelzpunkt: | 3550 oC, 3823 K |
| Anmerkung: Bei normalem Atmosphärendruck schmilzt Kohlenstoff beim Erhitzen nicht, er sublimiert. Das heißt, er geht direkt vom festen in den gasförmigen Zustand über. Wird der Druck auf 10 Atmosphären erhöht, so schmilzt Kohlenstoff (Graphit) bei 3550 °C. | |
| Siedepunkt: | 3825 oC, 4098 K |
| Der angegebene Siedepunkt wird erreicht, wenn der Graphitdampfdruck über sublimierendem Graphit 1 Atmosphäre erreicht. | |
| Elektronen: | 6 |
| Protonen: | 6 |
| Neutronen im am häufigsten vorkommenden Isotop: | 6 |
| Elektronenschalen: | 2,4 |
| Elektronenkonfiguration: | 1s2 2s2 2p2 |
| Dichte @ 20oC: | 2.267 g/cm3 (gr), 3.513 g/cm3 (di) |
Mehr anzeigen, darunter: Wärme, Energie, Oxidation, Reaktionen,
Verbindungen, Radien, Leitfähigkeiten
| Atomvolumen: | 5,31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Struktur: | hexagonale Schichten (Graphit), tetraedrische (Diamant) |
| Härte: | 0,5 mohs (Graphit), 10,0 mohs (Diamant) |
| Spezifische Wärmekapazität | 0,71 J g-1 K-1 (Graphit), 0.5091 J g-1 K-1 (Diamant) |
| Schmelzwärme | 117 kJ mol-1 (Graphit) |
| Zerstäubungswärme | 717 kJ mol-1 |
| Verdampfungswärme | 710.9 kJ mol-1 |
| 1. Ionisierungsenergie | 1086.5 kJ mol-1 |
| 2. Ionisierungsenergie | 2352.6 kJ mol-1 |
| 3. Ionisierungsenergie | 4620.5 kJ mol-1 |
| Elektronenaffinität | 121.55 kJ mol-1 |
| Minimale Oxidationszahl | -4 |
| Min. gemeinsame Oxidationsnr. | -4 |
| Maximale Oxidationszahl | 4 |
| Max. gemeinsame Oxidationsnr. | 4 |
| Elektronegativität (Pauling-Skala) | 2,55 |
| Polarisierbarkeit Volumen | 1.8 Å3 |
| Reaktion mit Luft | heftig, ⇒ CO2 |
| Reaktion mit 15 M HNO3 | mild, w/ht ⇒ C6(CO2H)6 (Mellitische/Graphitische Säure) |
| Reaktion mit 6 M HCl | keine |
| Reaktion mit 6 M NaOH | keine |
| Oxid(e) | CO , CO2 |
| Hydrid(e) | CH4 und viele CxHy |
| Chlorid(e) | CCl4 |
| Atomradius | 70 pm |
| Ionenradius (1+ Ion) | – |
| Ionenradius (2+ Ion) | – |
| Ionenradius (3+ Ion) | – |
| Ionenradius (1- Ion) | – |
| Ionenradius (2- Ion) | – |
| Ionenradius (3- Ion) | – |
| Wärmeleitfähigkeit | 25-470 W m-1 K-1 (Graphit), 470 W m-1 K-1 (Diamant) |
| Elektrische Leitfähigkeit | 0.07 x 106 S m-1 |
| Gefrier-/Schmelzpunkt: | 3550 oC, 3823 K |

Modelle der Kohlenstoffnanoröhrenstruktur.

Lavoisier verwendet eine riesige Linse bei Verbrennungsexperimenten
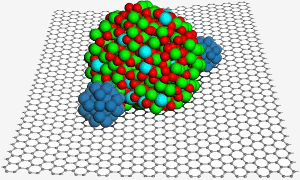
Eine Graphenoberfläche beherbergt ein Indiumzinnoxid-Nanopartikel, das zwei Platin-Nanopartikel (blau) für eine verbesserte Katalyse in einer Brennstoffzelle sichert. Bild: PNL.
Entdeckung des Kohlenstoffs
Kohlenstoff ist seit dem Altertum in Form von Ruß, Holzkohle, Graphit und Diamanten bekannt. Die alten Kulturen wussten natürlich nicht, dass es sich bei diesen Substanzen um verschiedene Formen desselben Elements handelte
Der französische Wissenschaftler Antoine Lavoisier gab dem Kohlenstoff einen Namen und führte eine Reihe von Experimenten durch, um seine Natur zu enthüllen.
1772 kaufte er zusammen mit anderen Chemikern einen Diamanten, den sie in ein geschlossenes Glasgefäß legten. Sie fokussierten die Sonnenstrahlen mit einer bemerkenswerten Riesenlupe auf den Diamanten und sahen, wie der Diamant brannte und verschwand.
Lavoisier stellte fest, dass das Gesamtgewicht des Glases unverändert blieb und dass sich der Diamant beim Brennen mit Sauerstoff zu Kohlendioxid verbunden hatte. (1), (2) Er schloss daraus, dass Diamant und Holzkohle aus demselben Element – Kohlenstoff – bestehen.
1779 zeigte der schwedische Wissenschaftler Carl Scheele, dass Graphit unter Bildung von Kohlendioxid verbrennt und daher eine andere Form von Kohlenstoff sein muss.(3)
1796 stellte der englische Chemiker Smithson Tennant fest, dass Diamant reiner Kohlenstoff und keine Kohlenstoffverbindung ist; er verbrennt nur unter Bildung von Kohlendioxid.
Tennant wies auch nach, dass bei der Verbrennung von Holzkohle und Diamanten gleichen Gewichts die gleiche Menge Kohlendioxid entsteht. (4)
1855 stellte der englische Chemiker Benjamin Brodie reines Graphit aus Kohlenstoff her und bewies damit, dass Graphit eine Form von Kohlenstoff ist.(4)
Obwohl es zuvor erfolglos versucht worden war, wiesen der amerikanische Wissenschaftler Francis Bundy und seine Mitarbeiter bei General Electric 1955 schließlich nach, dass Graphit bei hoher Temperatur und hohem Druck in Diamant umgewandelt werden kann.(5)
1985 entdeckten Robert Curl, Harry Kroto und Richard Smalley Fullerene, eine neue Form von Kohlenstoff, bei der die Atome fußballförmig angeordnet sind. Das bekannteste Fulleren ist das Buckminsterfulleren, auch bekannt als C60, das aus 60 Kohlenstoffatomen besteht. Es gibt eine große Familie von Fullerenen, die bei C20 beginnt und bis zu C540 reicht. (6), (7)
Das jüngste entdeckte Allotrop des Kohlenstoffs ist Graphen, das aus einer einzigen Schicht von in Sechsecken angeordneten Kohlenstoffatomen besteht. Würde man diese Schichten übereinander stapeln, so entstünde Graphit. Graphen hat eine Dicke von nur einem Atom.
Die Entdeckung von Graphen wurde 2004 von Kostya Novoselov und Andre Geim bekannt gegeben, die mit Hilfe von Klebeband eine einzelne Schicht von Atomen von Graphit ablösten, um das neue Allotrop herzustellen.
Interessante Fakten über Kohlenstoff
- Ungefähr 20 % des Gewichts lebender Organismen besteht aus Kohlenstoff.
- Es sind mehr Verbindungen bekannt, die Kohlenstoff enthalten, als nicht.
- Kohlenstoff ist das vierthäufigste Element im Universum.
- Trotz seines hohen Vorkommens verdanken wir die Existenz von Kohlenstoff einer Reihe unwahrscheinlicher Umstände
- Diamant ist ein ausgezeichnetes Schleifmittel, da er das härteste gängige Material ist und außerdem die höchste Wärmeleitfähigkeit besitzt. Er kann jede Substanz abschleifen, während die durch Reibung erzeugte Wärme schnell abgeleitet wird.
- Die Kohlenstoffatome in deinem Körper waren alle einmal Teil der Kohlendioxid-Fraktion der Atmosphäre.
- Graphen ist das dünnste und stärkste Material, das je bekannt war.
- Graphen besteht aus zweidimensionalen Atomkristallen, wobei solche Strukturen zum ersten Mal gesehen wurden.
- Der Graphit in einem typischen Druckbleistift hat einen Durchmesser von 0,7 mm. Das entspricht 2 Millionen Lagen Graphen.
- Autoreifen sind schwarz, weil sie zu etwa 30 % aus Ruß bestehen, der dem Gummi zugesetzt wird, um es zu verstärken. Der Ruß trägt auch zum Schutz vor UV-Schäden an den Reifen bei.(8)
- Kohlenstoff entsteht in Sternen, wenn sie in Kernfusionsreaktionen Helium verbrennen. Kohlenstoff ist Teil der „Asche“, die bei der Heliumverbrennung entsteht.
- Kohlenstoff durchläuft in schweren Sternen Kernfusionsreaktionen, um Neon, Magnesium und Sauerstoff zu erzeugen.




Links: Verbrennung von Kohle (hauptsächlich amorpher Kohlenstoff) in Luft. Rechts: Diamanten (kristalliner Kohlenstoff). Wir haben darüber nachgedacht, ein Foto von brennenden Diamanten zu machen – sie verbrennen bei etwa 800oC – aber wir konnten es uns nicht leisten!

Lebensformen auf Kohlenstoffbasis, wie diese, dominieren unseren Planeten.

DNA. Das berühmte Doppelhelix-Molekül wird durch die Fähigkeit von Kohlenstoff ermöglicht, lange Molekülketten zu bilden.
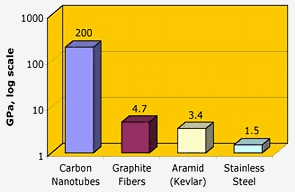
Nasa: Kohlenstoff-Nanoröhren haben eine herausragende Zugfestigkeit – um zwei Größenordnungen höher als Graphitfasern, Kevlar oder Stahl.
Nachbarschaft von Kohlenstoff im Periodensystem
| Gruppe 13 |
Gruppe 14 |
Gruppe 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
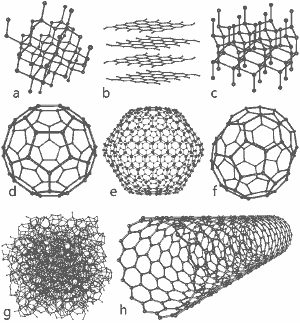
Ein wunderbares Bild, veröffentlicht von Michael Ströck unter der GNU Free Documentation License: Die Strukturen von acht Allotropen des Kohlenstoffs: a) Diamant b) Graphit c) Lonsdaleit d) C60 (Buckminsterfulleren) e) C540 Fulleren f) C70 Fulleren g) Amorpher Kohlenstoff h) Einwandige Kohlenstoff-Nanoröhre. Klicken Sie hier für ein größeres Bild.
Aussehen und Eigenschaften
Schädliche Wirkungen:
Reiner Kohlenstoff hat eine sehr geringe Toxizität. Das Einatmen großer Mengen von Rußstaub (Kohlenstaub) kann zu Reizungen und Schädigungen der Lunge führen.
Eigenschaften:
Kohlenstoff kann in mehreren verschiedenen dreidimensionalen Strukturen vorliegen, in denen seine Atome unterschiedlich angeordnet sind (Allotrope).
Drei gängige kristalline Allotrope sind Graphit, Diamant und (meist) Fullerene. Graphen hat eine 2D-Kristallstruktur.(Fullerene können manchmal in amorpher Form vorliegen.)(9)
Kohlenstoff kann auch in amorphem Zustand vorliegen. Viele Allotrope, die gemeinhin als amorph bezeichnet werden, wie glasartiger Kohlenstoff, Ruß oder Carbon Black, haben jedoch in der Regel genug Struktur, um nicht wirklich amorph zu sein. Obwohl kristalline Nanoröhren beobachtet wurden, sind sie im Allgemeinen amorph.(10)
Die Strukturen von acht Allotropen sind am Ende dieser Seite dargestellt.
Interessanterweise ist Graphit eine der weichsten Substanzen und Diamant galt bis vor kurzem als die härteste natürlich vorkommende Substanz.
Ein extrem seltenes Allotrop des Kohlenstoffs, Lonsdaleit, ist in reiner Form 58% stärker als Diamant. Lonsdaleit ist ein diamantähnliches Kohlenstoffnetzwerk, das die hexagonale Struktur von Graphit aufweist. Es entsteht, wenn graphithaltige Meteoriten auf einen anderen Körper, z. B. die Erde, treffen. Die hohen Temperaturen und der Druck des Einschlags verwandeln den Graphit in Lonsdaleit.
Kohlenstoff hat den höchsten Schmelz-/Sublimationspunkt aller Elemente und in Form von Diamant die höchste Wärmeleitfähigkeit aller Elemente.
Die hohe Wärmeleitfähigkeit von Diamant ist der Ursprung des umgangssprachlichen Begriffs „Eis“. Bei typischen Raumtemperaturen ist Ihre Körpertemperatur höher als die des Raumes – einschließlich der großen Diamanten, die Sie vielleicht zufällig herumliegen haben. Wenn Sie einen dieser Diamanten berühren, leitet seine hohe Wärmeleitfähigkeit die Wärme schneller von Ihrer Haut weg als jedes andere Material. Ihr Gehirn interpretiert diese schnelle Ableitung von Wärmeenergie von Ihrer Haut so, dass Sie etwas sehr Kaltes berühren – deshalb können sich Diamanten bei Zimmertemperatur wie Eis anfühlen.
Verwendung von Kohlenstoff
Kohlenstoff (in Form von Kohle, die hauptsächlich aus Kohlenstoff besteht) wird als Brennstoff verwendet.
Graphit wird für Bleistiftspitzen, Hochtemperaturtiegel, Trockenzellen, Elektroden und als Schmiermittel verwendet.
Diamanten werden in der Schmuckindustrie und – weil sie so hart sind – in der Industrie zum Schneiden, Bohren, Schleifen und Polieren verwendet.
Ruß wird als schwarzes Pigment in Druckfarben verwendet.
Kohlenstoff kann mit Eisen Legierungen bilden, von denen die häufigste Kohlenstoffstahl ist.
Das radioaktive Isotop 14C wird in der archäologischen Datierung verwendet.
Kohlenstoffverbindungen sind in vielen Bereichen der chemischen Industrie wichtig – Kohlenstoff bildet eine große Anzahl von Verbindungen mit Wasserstoff, Sauerstoff, Stickstoff und anderen Elementen.
Häufigkeit und Isotope
Häufigkeit Erdkruste: 200 Gewichtsteile pro Million, 344 Teile pro Million in Molen
Häufigkeit Sonnensystem: 3000 Teile pro Million nach Gewicht, 300 Teile pro Million nach Molen
Kosten, rein: 2,4 $ pro 100g
Kosten, lose: $ pro 100g
Quelle: Kohlenstoff kann durch Verbrennung organischer Verbindungen unter Sauerstoffmangel gewonnen werden. Die vier Hauptallotrope des Kohlenstoffs sind Graphit, Diamant, amorpher Kohlenstoff und Fullerene.
Natürliche Diamanten findet man in Kimberlit aus alten Vulkanen.
Graphit kommt auch in natürlichen Vorkommen vor.
Fullerene wurden in den 1980er Jahren als Nebenprodukt von Molekularstrahlexperimenten entdeckt.
Amorpher Kohlenstoff ist der Hauptbestandteil von Holzkohle, Ruß (Carbon Black) und Aktivkohle.
Isotope: 13, deren Halbwertszeiten bekannt sind, mit den Massenzahlen 8 bis 20. Natürlich vorkommender Kohlenstoff ist ein Gemisch aus zwei Isotopen, die in den angegebenen Anteilen vorkommen: 12C (99 %) und 13C (1 %).
Das 14C-Isotop mit einer Halbwertszeit von 5730 Jahren wird weithin verwendet, um kohlenstoffhaltige Materialien wie Holz, archäologische Proben usw. auf ein Alter von bis zu etwa 40 000 Jahren zu datieren.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide, (2006) p192. Greenwood Publishing Group
- Mary Elvira Weeks, Die Entdeckung der Elemente. I. Elements known to the ancient world, J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses., (2006) p507. SME.
- Amanda S. Barnard, Die Diamantformel: Diamantensynthese – eine gemmologische Perspektive, (2000) p3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers, (1999) p145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) p423. Wiley.
- Nobelpreis für Chemie, 1996
- Was brauchen wir, um einen Reifen herzustellen?
- Ming Gao und Hui Zhang, Preparation of an amorphous fullerene film, Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6.
Zitieren Sie diese Seite
Für die Online-Verknüpfung kopieren Sie bitte eine der folgenden Möglichkeiten:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
oder
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Um diese Seite in einem akademischen Dokument zu zitieren, verwenden Sie bitte die folgende MLA-konforme Zitierweise:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.