Wissenschaft > Chemie > Elemente der dritten Reihe > Konzept der metallischen Bindung und metallische Festkörper
In diesem Artikel werden wir das Konzept der metallischen Bindung und metallische Bindungen in Natrium-, Magnesium- und Aluminiumkristallen untersuchen.
Konzept der metallischen Bindung:
Die metallische Bindung ist definiert als die Anziehungskraft, die Metallkationen an eine Anzahl beweglicher oder delokalisierter Elektronen in ihrem Einflussbereich bindet, was die Metallkationen in einem bestimmten Muster zusammenhält. Zur Erklärung der Natur der Metallbindung wurden viele Theorien vorgeschlagen. Die Theorie der freien Elektronen oder die Elektronensee-Theorie ist eine der einfachsten Theorien, die von Drude und Lorentz vorgeschlagen wurde. Einige der wichtigen Postulate dieser Theorie sind wie folgt:
Theorie der freien Elektronen in metallischen Bindungen:
Metallatome haben eine geringere Anzahl von Valenzelektronen, so dass sie viele leere Valenzorbitale haben. Na, Mg und Al haben 3p-Orbitale frei.
| Name | Symbol | Atom-Nr. | Elektronische Konfiguration | Detaillierte Konfiguration |
| Natrium | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnesium | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Aluminium | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Die Ionisierungspotentiale der Metalle sind niedrig, so dass die Valenzelektronen nur locker gebunden sind und leicht entfernt werden können. Die dicht gepackte Struktur des Metallkristalls besteht aus den Atomen des Metalls, die in jeder Hinsicht identisch sind.
Die unbesetzten Orbitale der dicht gepackten Atome des Metalls überlappen sich mit dem ähnlichen Orbital der benachbarten Atome durch das Kristallgitter. Die Valenzelektronen werden aus ihren Orbitalen entfernt und können sich frei von den unbesetzten Valenzorbitalen eines Atoms zum anderen bewegen. Da diese Valenzelektronen nicht zu einem einzelnen Atom, sondern zum Kristall als Ganzem gehören, werden sie als delokalisierte oder mobile Elektronen bezeichnet. Die Metallionen (Kationen), die aufgrund der Delokalisierung entstehen, werden Kerne genannt. Die Metallionen haben feste Positionen im Kristallgitter, während sich die delokalisierten Elektronen frei im Kristallgitter bewegen können. Somit kann Metall als eine Ansammlung von Metallkationen betrachtet werden, die in ein Meer von beweglichen Elektronen eingetaucht sind.
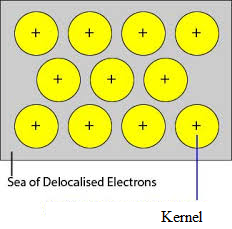
Da die Elektronen in den Metallen delokalisiert sind, wird angenommen, dass sie gleichmäßig im Kristallgitter verteilt sind. Die Anziehungskräfte zwischen den Metallionen und den delokalisierten Elektronen sind in allen Richtungen gleich. Daher ist die metallische Bindung ungerichtet.
Die Einheiten, die die Gitterpunkte in Natrium, Magnesium und Aluminium besetzen, sind jeweils positive Ionen von ihnen und werden von beweglichen Elektronen umgeben. Somit sind Natrium, Magnesium und Aluminium metallische Festkörper.
Wenn wir uns von links nach rechts bewegen, d.h. von Natrium zu Aluminium, nimmt die Anzahl der Valenzelektronen zu und somit die Stärke der Bindung von Natrium zu Aluminium.
Die Eigenschaften wie elektrische und thermische Leitfähigkeit, metallischer Glanz, Verformbarkeit und Duktilität können auf der Grundlage der Theorie der freien Elektronen erklärt werden.
Charakteristika metallischer Bindungen:
- Die metallische Bindung ist definiert als die Anziehungskraft, die Metallkationen an eine Anzahl beweglicher oder delokalisierter Elektronen in ihrem Einflussbereich bindet, die die Metallkationen in einem bestimmten Muster zusammenhält.
- Die metallische Bindung ist ungerichtet.
- Sie ist schwächer als die kovalente Bindung, aber stärker als die van der Waal-Kräfte.
- Die Bindungen sind nicht starr.
- Die Stärke der metallischen Bindung steht in direktem Zusammenhang mit der positiven Ladung des Metallions. So nimmt die Stärke der metallischen Bindung mit Na < Mg < Al zu.
Metallische Festkörper:
Metallische Festkörper sind kristalline Festkörper, in denen die Einheiten, die die Gitterpunkte besetzen, positive Ionen sind, die von einem Pool von Elektronen umgeben sind. (Konzept der metallischen Bindung)
Kristallstrukturen von Metallen:
Die Röntgenanalyse verschiedener Metallkristalle hat gezeigt, dass Metalle eine der folgenden Kristallstrukturen aufweisen:
- Körperzentrierte kubische Struktur. (BCC)
- Flächenzentrierte kubische Struktur. (FCC)
- Hexagonal dicht gepackte Struktur. (HCP)
Natrium (Na):
Natriummetall hat eine kubisch-raumzentrierte (BCC) offen gepackte Kristallstruktur. Die Bindung ist eine ungerichtete metallische Bindung.
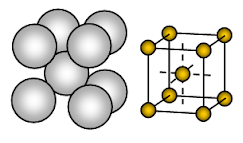
Die Anordnung der Ionen in einer Ebene- Kubische Anordnung – offene oder quadratisch gepackte Struktur. Bei dieser Anordnung berührt jedes Metallion vier benachbarte Ionen in einer Ebene. Die Reihenfolge der Schichten ist AB, AB, AB, ……….
Natrium ist ein metallischer Festkörper. In der Einheitszelle von Natrium ist jedes Natrium-Ion von acht anderen Natrium-Ionen in gleichem Abstand umgeben. Die Koordinationszahl ist also 8. Diese Natriumionen sind an den Ecken eines imaginären Würfels angeordnet, und in der Mitte des Würfels befindet sich ein Natriumion. In einer Einheitszelle von Natrium sind 2 Ionen vorhanden.
Die Natriumionen nehmen nur etwa 68% des verfügbaren Raums in einer Einheitszelle ein. Somit bleiben 32% der Einheitszelle leer (void). Da diese Struktur mehr Leerraum aufweist, sind Metalle, die diese Struktur annehmen, weich. Natrium ist also ein weiches Metall, weil es mehr Leerraum (etwa 32 %) in seiner Kristallstruktur hat und eine eher schwache metallische Bindung aufgrund von nur einem Valenzelektron pro Na-Atom in seinem Kristall.
Magnesium (Mg):
Magnesium hat eine hexagonal dicht gepackte (HCP) Kristallstruktur. Die Bindung ist eine ungerichtete metallische Bindung.
Magnesium ist ein metallischer Feststoff. Die Einheiten, die Gitterplätze besetzen, sind Mg-Ionen, und diese Ionen sind von beweglichen oder delokalisierten Elektronen umgeben.
Die Anordnung der Ionen in einer Ebene ist eine hexagonale Anordnung oder eine geschlossene gepackte Schicht. So berührt jedes Metallion sechs benachbarte Ionen in einer Ebene. Jedes Magnesium-Ion berührt sechs Magnesium-Ionen in seiner eigenen Schicht, drei in der Schicht darüber und drei in der Schicht darunter. In der hexagonal gepackten Struktur sind die geschlossen gepackten Ionenschichten in einer abwechselnden Reihenfolge gestapelt, die gewöhnlich AB ABA ….. genannt wird. Jede dritte Ionenschicht ist genau gleich und liegt direkt über der ersten Schicht.
Jedes Mg-Atom ist von 12 anderen Mg-Ionen in gleichem Abstand umgeben. Die Koordinationszahl ist also 12. In der Einheitszelle sind etwa 26 % des verfügbaren Raums leer (void). Diese Struktur ist dichter gepackt. Aufgrund des geringeren Leerraums in der Kristallstruktur, der größeren Elektronenwolke aufgrund von Mg+2 und der starken metallischen Bindung ist Magnesium härter als Natriummetall. Es ist formbarer und dehnbarer als Natrium.
Aluminium (Al):
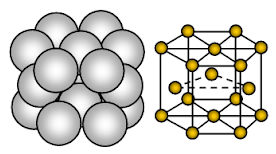
Aluminium hat eine kubisch-flächenzentrierte (FCC) Kristallstruktur. Die Bindung ist eine ungerichtete metallische Bindung.

Aluminium ist ein metallischer Feststoff. Die Einheiten, die Gitterplätze besetzen, sind Al-Ionen, und diese Ionen sind von beweglichen oder delokalisierten Elektronen umgeben.
Die Anordnung der Ionen in einer Ebene ist eine hexagonale Anordnung oder eine geschlossene gepackte Schicht. So berührt jedes Metallion sechs benachbarte Ionen in einer Ebene.
In einer kubisch dicht gepackten oder flächenzentrierten kubischen Kristallstruktur wiederholt sich die Abfolge der dicht gepackten Ionenschichten in jeder vierten Schicht. D.h. jede vierte Ionenschicht ist genau die gleiche wie die erste und liegt direkt über dieser. Sie wird daher als ABC, ABC, ABC, ….. kubische dichte Packung bezeichnet. Die kubische dichte Packung wird auch als flächenzentrierte dichte Packung bezeichnet, da sich die Ionen aus einem bestimmten Blickwinkel betrachtet an den acht Ecken des Würfels und in der Mitte jeder der sechs Flächen des Würfels, d. h. der Einheitszelle, befinden.
Jedes Aluminiumion (Al+3) ist von 12 anderen gleich weit entfernten Aluminiumatomen umgeben. Die Koordinationszahl ist also 12. In der Einheitszelle von Aluminium sind etwa 26 % des verfügbaren Raums leer (void). Aufgrund des geringeren Leerraums in der Kristallstruktur und der starken metallischen Bindung ist Aluminium härter, formbarer und dehnbarer als Natrium und Magnesium.
Silizium (Si):
Kovalente Festkörper sind kristalline Festkörper, bei denen die Einheitsgitterpunkte Atome sind. Die wichtigste Bindungskraft sind kovalente Bindungen zwischen Atomen. Silicium ist ein kovalenter Festkörper, in dem die Gitterpunkte von den Atomen des Elements besetzt sind. Silicium ist ein Netzwerkfestkörper. Es besteht ein Netz von kovalenten Si-Si-Bindungen.
Die Ordnungszahl von Silicium ist 14. Die elektronische Konfiguration von Silizium im Grundzustand ist 1s2, 2s22p6, 3s2 3p2. Es hat vier Valenzelektronen in ihren Valenzorbitalen. Silizium macht eine sp3-Hybridisierung durch und bildet vier sp3-hybridisierte Orbitale mit gleicher Energie. Jedes Siliciumatom bildet vier kovalente Bindungen mit vier anderen benachbarten Siliciumatomen aufgrund von SP3- SP3 So entsteht eine tetraedrische Si4-Einheit, die sich zu einem dreidimensionalen Riesenmolekül ausdehnt.

Die Si-Si-Bindungen verlaufen kontinuierlich im gesamten Kristall. Ein Siliziumkristall ist also ein dreidimensionales Riesenmolekül mit einem tetraedrischen Netz von Siliziumatomen, die durch starke kovalente Bindungen miteinander verbunden sind. Ein Festkörper, der eine solche Struktur enthält, wird als Netzwerkfeststoff bezeichnet. Der Winkel der Si-Si-Bindung beträgt 109 o 28 ‚, während die Bindungslänge 2,35 o beträgt
Durch die Überlappung der Hybridorbitale sind die kovalenten Si-Si-Bindungen sehr stark und gerichtet. Das Vorhandensein eines Netzes starker kovalenter Bindungen ist für die Härte und den hohen Schmelzpunkt verantwortlich.
Die Elektronen in der kovalenten Bindung sind lokalisiert, daher ist Silizium kein guter Leiter von Elektrizität und Wärme. Aber es ist ein Halbleiter. Da keine freien Elektronen zur Verfügung stehen, ist Silizium bei absoluter Nulltemperatur ein Isolator. Silizium ist jedoch ein Halbleiter. Wird die Temperatur erhöht, brechen kovalente Bindungen auf und es werden Elektronen freigesetzt, die Strom leiten können. Daher nimmt die Leitfähigkeit mit steigender Temperatur zu.