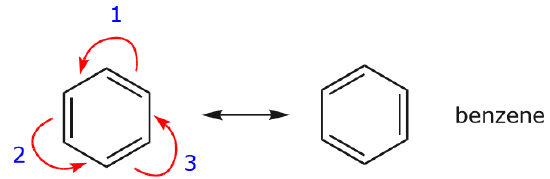
Using Curved Arrows
Torniamo ora ad un nostro vecchio amico, \(CH_3CNO\), che abbiamo introdotto quando abbiamo parlato per la prima volta delle strutture di risonanza. Usiamo questo composto per illustrare ulteriormente come gli elettroni mobili vengono “spinti” per arrivare da una struttura di risonanza all’altra.
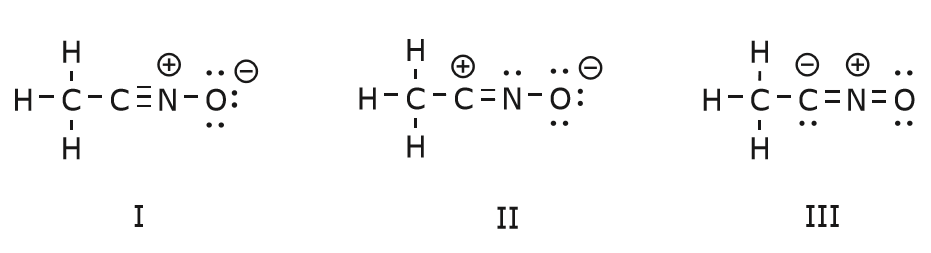
Il movimento di elettroni che avviene per arrivare alla struttura II dalla struttura I inizia con il triplo legame tra carbonio e azoto. Sposteremo uno dei due legami \(\pi\) che fanno parte del triplo legame verso la carica positiva dell’azoto, come mostrato:
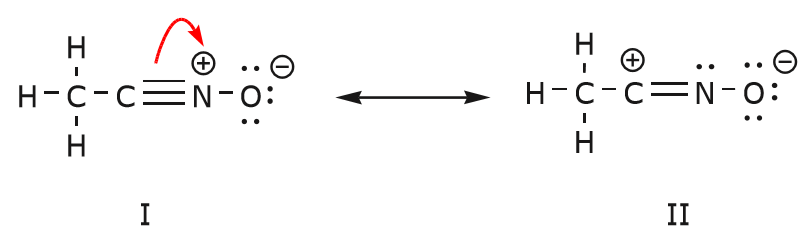
Quando facciamo questo, prestiamo molta attenzione al nuovo stato degli atomi interessati e facciamo tutte le modifiche necessarie alle cariche, ai legami e agli elettroni non condivisi per preservare la validità delle formule risultanti. In questo caso, per esempio, il carbonio che fa parte del triplo legame nella struttura I deve acquisire una carica positiva nella struttura II perché ha perso un elettrone. L’azoto, invece, è ora neutro perché ha guadagnato un elettrone e sta formando tre legami invece di quattro.
Possiamo anche arrivare dalla struttura I alla struttura III spingendo gli elettroni nel modo seguente. Le frecce sono state numerate in questo esempio per indicare quale movimento inizia per primo, ma questo non fa parte delle convenzioni usate nel formalismo della freccia curva.
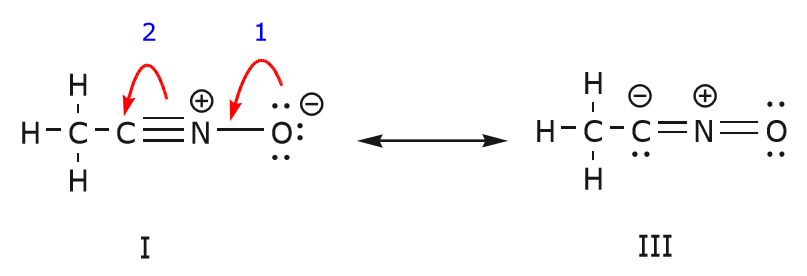
Come spostiamo una coppia di elettroni non condivisi dall’ossigeno verso l’atomo di azoto come mostrato nel passo 1, siamo costretti a spostare elettroni dall’azoto verso il carbonio come mostrato nel passo 2. Altrimenti ci ritroveremmo con un azoto con 5 legami, il che è impossibile, anche se solo momentaneamente. Di nuovo, notate che nel passo 1 la freccia ha origine con una coppia di elettroni non condivisi dall’ossigeno e si muove verso la carica positiva dell’azoto. Si forma un nuovo legame tra azoto e ossigeno. Allo stesso tempo, gli elettroni spostati verso il carbonio nel passo 2 diventano una coppia di elettroni non condivisi nella struttura III. Infine, anche lo stato di ibridazione di alcuni atomi cambia. Per esempio l’atomo di carbonio nella struttura I è ibridato sp, ma nella struttura III è ibridato \(sp^3\).
Potresti voler giocare ancora un po’ e vedere se puoi arrivare dalla struttura II alla struttura III, ecc. Tuttavia, siate avvertiti che a volte è più complicato di quanto possa sembrare a prima vista.
Regole aggiuntive per spostare gli elettroni per scrivere strutture di risonanza:
- Le coppie di elettroni possono spostarsi solo in posizioni adiacenti. Posizioni adiacenti significa atomi e/o legami vicini.
- Le strutture di Lewis che risultano dallo spostamento degli elettroni devono essere valide e devono contenere la stessa carica netta di tutte le altre strutture di risonanza.
L’esempio seguente illustra come una coppia solitaria di elettroni dal carbonio può essere spostata per fare un nuovo legame \(\pi\) ad un carbonio adiacente, e come gli elettroni \(\pi\) tra carbonio e ossigeno possono essere spostati per diventare una coppia di elettroni non condivisi sull’ossigeno. Nessuna delle regole precedenti è stata violata in nessuno di questi esempi.
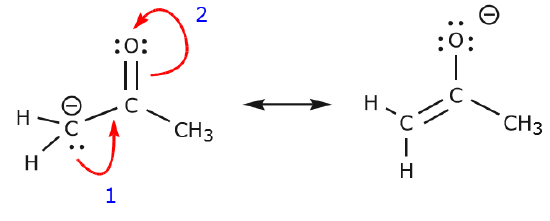
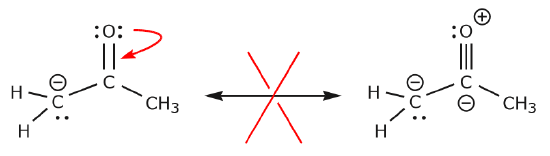
Ora vediamo alcuni esempi di COME NON SPOSTARE ELETTRONI. Usando lo stesso esempio, ma muovendo gli elettroni in un modo diverso, illustra come tale movimento risulterebbe in formule di Lewis non valide, e quindi è inaccettabile. Non solo stiamo spostando gli elettroni nella direzione sbagliata (lontano da un atomo più elettronegativo), ma la struttura risultante viola diverse convenzioni. In primo luogo, il carbonio centrale ha cinque legami e quindi viola la regola dell’ottetto. In secondo luogo, la carica complessiva della seconda struttura è diversa dalla prima. Per evitare di avere un carbonio con cinque legami dovremmo distruggere uno dei singoli legami C-C, distruggendo lo scheletro molecolare nel processo.
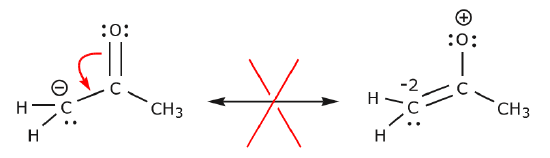
Nell’esempio qui sotto gli elettroni vengono spostati verso una zona ad alta densità di elettroni (una carica negativa), piuttosto che verso una carica positiva. Inoltre, la regola dell’ottetto è violata per il carbonio nella struttura risultante, dove condivide più di otto elettroni.
Altri esempi illustrano ulteriormente le regole di cui abbiamo parlato.
(a) Le coppie di elettroni non condivise (coppie solitarie) situate su un dato atomo possono spostarsi in una posizione adiacente solo per fare un nuovo legame \(\pi\) all’atomo successivo.
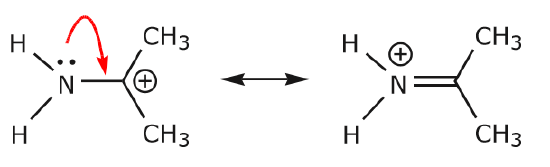
(b) A meno che non ci sia una carica positiva sull’atomo successivo (carbonio sopra), altri elettroni dovranno essere spostati per mantenere la regola dell’ottetto. Nelle strutture di risonanza questi sono quasi sempre elettroni \(\pi\), e quasi mai elettroni sigma.
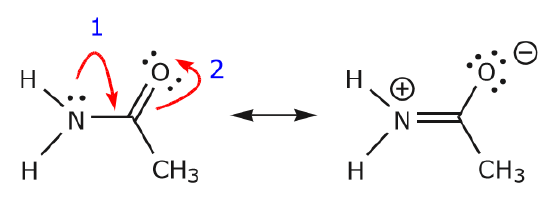
Quando gli elettroni della coppia solitaria di azoto si spostano verso il carbonio vicino per fare un nuovo legame \(\pi\), gli elettroni \(\pi\) che compongono il legame C=O devono essere spostati verso l’ossigeno per evitare di finire con cinque legami al carbonio centrale.
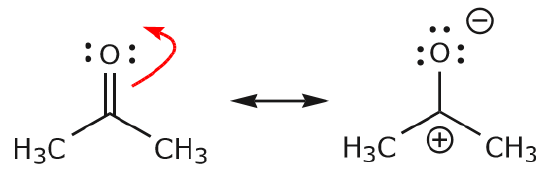
c) Come si può vedere sopra, gli elettroni possono spostarsi verso uno dei due atomi che condividono per formare una nuova coppia solitaria. Nell’esempio sopra, gli elettroni del legame C=O si sono spostati verso l’ossigeno per formare una nuova coppia solitaria. Un altro esempio è:
(d) gli elettroni \(\pi\) possono anche spostarsi in una posizione adiacente per formare un nuovo legame \(\pi\). Ancora una volta, la regola dell’ottetto deve essere osservata:
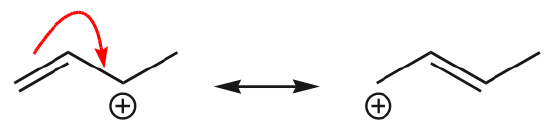
Uno degli esempi più comuni di questa caratteristica si osserva quando si scrivono forme di risonanza per il benzene e anelli simili.