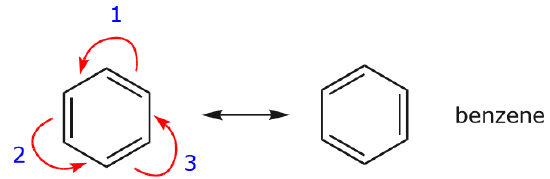
Brug af buede pile
Vi vender nu tilbage til en af vores gamle venner, \(CH_3CNO\), som vi introducerede, da vi først talte om resonansstrukturer. Vi bruger denne forbindelse til yderligere at illustrere, hvordan bevægelige elektroner “skubbes” for at nå fra en resonansstruktur til en anden.
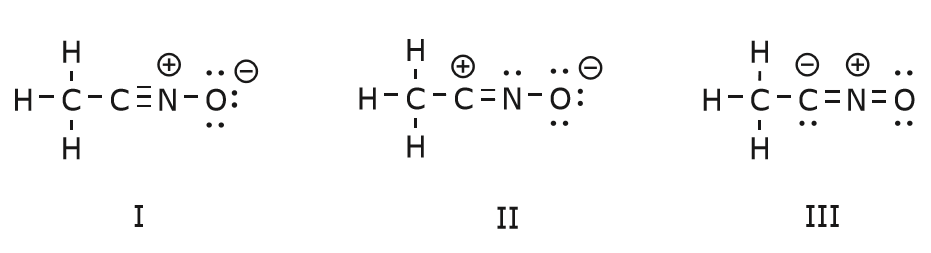
Den bevægelse af elektroner, der finder sted for at nå frem til struktur II fra struktur I, starter med tripelbindingen mellem kulstof og nitrogen. Vi flytter en af de to \(\pi\)-bindinger, der indgår i tripelbindingen, mod den positive ladning på nitrogen, som vist:
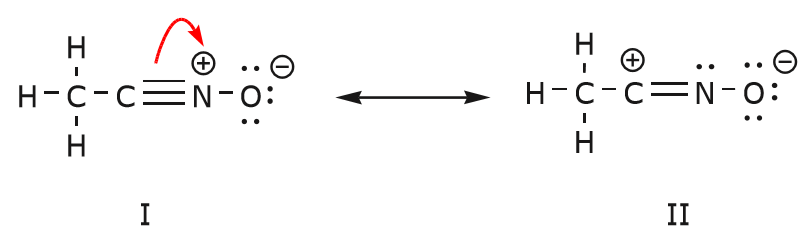
Når vi gør dette, er vi meget opmærksomme på den nye status for de berørte atomer og foretager de nødvendige justeringer af ladninger, bindinger og udelte elektroner for at bevare gyldigheden af de resulterende formler. I dette tilfælde skal f.eks. det kulstof, der indgår i tripelbindingen i struktur I, få en positiv ladning i struktur II, fordi det har mistet en elektron. Nitrogenet er på den anden side nu neutralt, fordi det har fået en elektron og danner tre bindinger i stedet for fire.
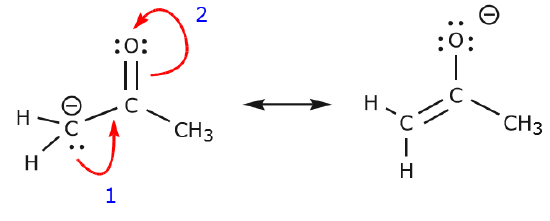
Vi kan også komme fra struktur I til struktur III ved at skubbe elektroner på følgende måde. Pilene er blevet nummereret i dette eksempel for at angive, hvilken bevægelse der starter først, men det er ikke en del af de konventioner, der anvendes i formalismen med buede pile.
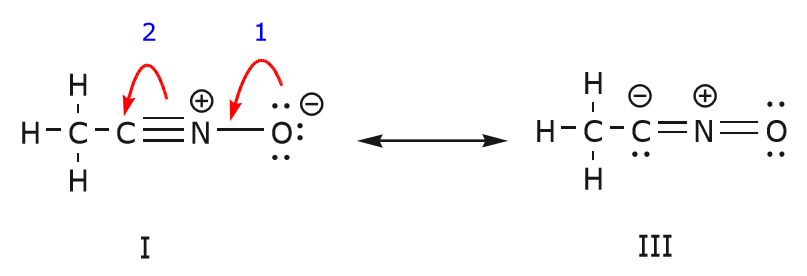
Da vi flytter et par udelte elektroner fra oxygen til nitrogenatomet som vist i trin 1, er vi tvunget til at flytte elektroner fra nitrogen til carbon som vist i trin 2. Ellers ville vi ende op med et nitrogen med 5 bindinger, hvilket er umuligt, selv om det kun er momentant. Igen bemærkes det, at pilen i trin 1 udgår fra et ikke-udvekslet elektronpar fra oxygen og bevæger sig mod den positive ladning på nitrogen. Der dannes en ny \(\pi\) binding mellem nitrogen og oxygen. Samtidig bliver de \(\pi\)-elektroner, der flyttes mod kulstof i trin 2, til et par udelte elektroner i struktur III. Endelig ændres hybridiseringstilstanden for nogle atomer også. F.eks. er kulstofatomet i struktur I sp-hybridiseret, men i struktur III er det \(sp^3\) hybridiseret.
Du kan lege lidt mere og se, om du kan komme fra struktur II til struktur III osv. Vær dog advaret om, at det nogle gange er vanskeligere, end det umiddelbart ser ud til.
Der er yderligere regler for flytning af elektroner for at skrive Resonansstrukturer:
- Elektronpar kan kun flytte til tilstødende positioner. Ved tilstødende positioner forstås naboatomer og/eller nabobindinger.
- De Lewis-strukturer, der fremkommer ved at flytte elektroner, skal være gyldige og skal indeholde den samme nettoladning som alle de andre resonansstrukturer.
Det følgende eksempel illustrerer, hvordan et enkelt elektronpar fra kulstof kan flyttes for at danne en ny \(\pi\) binding til et tilstødende kulstof, og hvordan \(\pi\) elektronerne mellem kulstof og oxygen kan flyttes for at blive til et par udelte elektroner på oxygen. Ingen af de foregående regler er blevet overtrådt i nogen af disse eksempler.
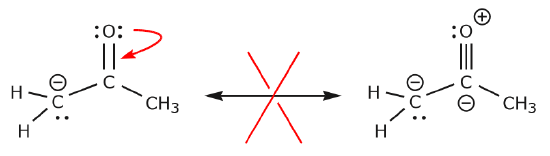
Nu skal vi se på nogle eksempler på, HVORDAN man IKKE må flytte elektroner. Ved at bruge det samme eksempel, men ved at flytte elektroner på en anden måde, illustreres det, hvordan en sådan bevægelse ville resultere i ugyldige Lewis-formler og derfor er uacceptabel. Ikke alene flytter vi elektronerne i den forkerte retning (væk fra et mere elektronegativt atom), men den resulterende struktur er også i strid med flere konventioner. For det første har det centrale kulstof fem bindinger og overtræder derfor oktetreglen. For det andet er den samlede ladning i den anden struktur anderledes end i den første. For at undgå at have et kulstof med fem bindinger ville vi være nødt til at ødelægge en af C-C enkeltbindingerne og dermed ødelægge det molekylære skelet i processen.
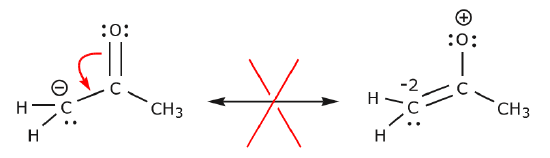
I nedenstående eksempel flyttes elektronerne mod et område med høj elektrontæthed (en negativ ladning), snarere end mod en positiv ladning. Desuden overtrædes oktetreglen for kulstof i den resulterende struktur, hvor det deler flere end otte elektroner.
Der er yderligere eksempler, der yderligere illustrerer de regler, vi har talt om.
(a) Udelagte elektronpar (lone par) placeret på et givet atom kan kun flyttes til en tilstødende position for at lave en ny \(\pi\) binding til det næste atom.
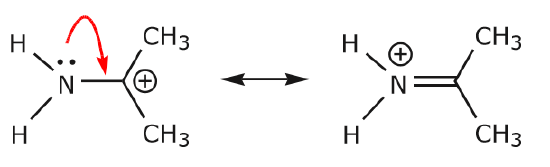
(b) Medmindre der er en positiv ladning på det næste atom (kulstof ovenfor), vil andre elektroner skulle flyttes for at bevare oktetreglen. I resonansstrukturer er disse næsten altid \(\pi\) elektroner og næsten aldrig sigma-elektroner.
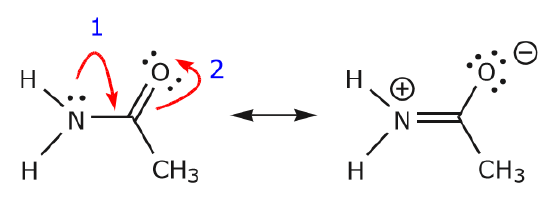
Da elektronerne fra nitrogenets enlige par bevæger sig mod nabokulstof for at lave en ny \(\pi\) binding, skal de \(\pi\) elektroner, der udgør C=O-bindingen, forskydes mod oxygen for at undgå at ende med fem bindinger til det centrale kulstof.
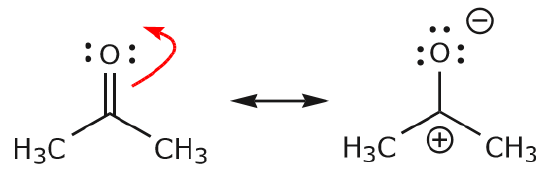
c) Som det fremgår ovenfor, kan \(\pi\) elektronerne flytte sig mod et af de to atomer, de deler, for at danne et nyt lonepar. I eksemplet ovenfor flyttede \(\pi\) elektronerne fra C=O-bindingen sig mod ilten for at danne et nyt lonepar. Et andet eksempel er:
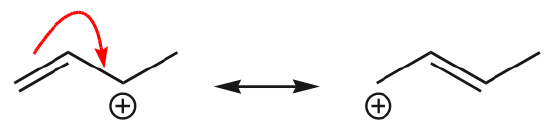
(d) \(\pi\) elektronerne kan også flytte sig til en tilstødende position for at danne en ny \(\pi\) binding. Igen skal oktetreglen overholdes:
Et af de mest almindelige eksempler på denne egenskab ses, når man skriver resonansformer for benzen og lignende ringe.