Utilisation des flèches courbes
Nous revenons maintenant à un de nos vieux amis, \(CH_3CNO\), que nous avons introduit lorsque nous avons parlé pour la première fois des structures de résonance. Nous utilisons ce composé pour illustrer davantage comment les électrons mobiles sont « poussés » pour arriver d’une structure de résonance à une autre.
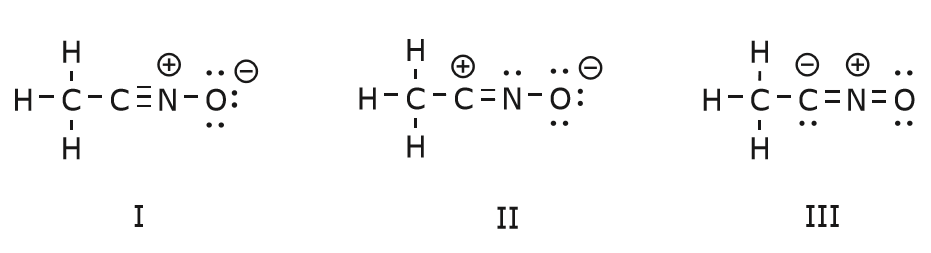
Le mouvement des électrons qui a lieu pour arriver à la structure II à partir de la structure I commence par la triple liaison entre le carbone et l’azote. Nous allons déplacer l’une des deux liaisons \(\pi\) qui font partie de la triple liaison vers la charge positive de l’azote, comme indiqué :
Lorsque nous faisons cela, nous portons une attention particulière au nouveau statut des atomes affectés et nous faisons tous les ajustements nécessaires aux charges, aux liaisons et aux électrons non partagés pour préserver la validité des formules résultantes. Dans ce cas, par exemple, le carbone qui fait partie de la triple liaison dans la structure I doit acquérir une charge positive dans la structure II car il a perdu un électron. L’azote, en revanche, est maintenant neutre parce qu’il a gagné un électron et qu’il forme trois liaisons au lieu de quatre.
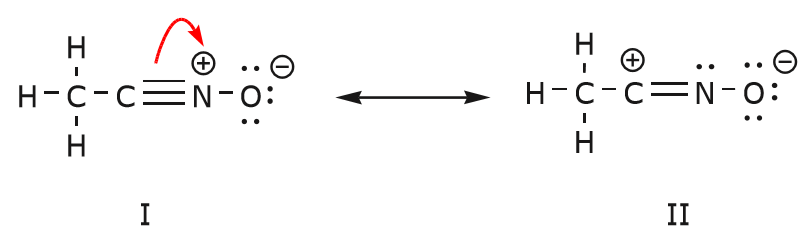
On peut aussi arriver de la structure I à la structure III en poussant les électrons de la manière suivante. Les flèches ont été numérotées dans cet exemple pour indiquer quel mouvement commence en premier, mais cela ne fait pas partie des conventions utilisées dans le formalisme des flèches courbes.
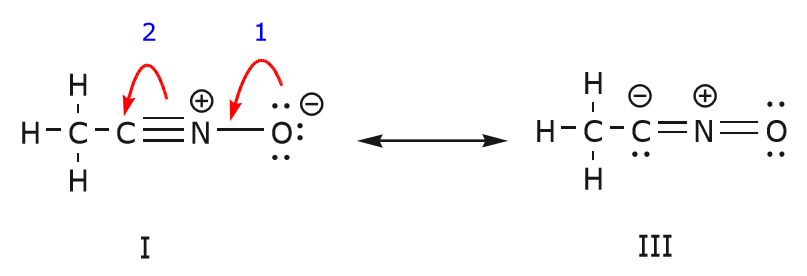
Alors que nous déplaçons une paire d’électrons non partagés de l’oxygène vers l’atome d’azote comme indiqué à l’étape 1, nous sommes obligés de déplacer des électrons de l’azote vers le carbone comme indiqué à l’étape 2. Sinon, nous nous retrouverions avec un azote comportant 5 liaisons, ce qui est impossible, même si ce n’est que momentanément. Encore une fois, remarquez que dans l’étape 1, la flèche part d’une paire d’électrons non partagée de l’oxygène et se déplace vers la charge positive de l’azote. Une nouvelle liaison \(\ipi\) se forme entre l’azote et l’oxygène. Dans le même temps, les électrons \(\pi\) déplacés vers le carbone dans l’étape 2 deviennent une paire d’électrons non partagés dans la structure III. Enfin, l’état d’hybridation de certains atomes change également. Par exemple, l’atome de carbone dans la structure I est hybridé sp, mais dans la structure III il est hybridé \(sp^3\).
Vous pouvez vouloir jouer un peu plus et voir si vous pouvez arriver de la structure II à la structure III, etc. Cependant, soyez averti que parfois c’est plus délicat que ce qui peut sembler à première vue.
Règles supplémentaires pour déplacer les électrons afin d’écrire des structures de résonance:
- Les paires d’électrons ne peuvent se déplacer que vers des positions adjacentes. Par positions adjacentes, on entend des atomes et/ou des liaisons voisines.
- Les structures de Lewis qui résultent du déplacement des électrons doivent être valides et doivent contenir la même charge nette que toutes les autres structures de résonance.
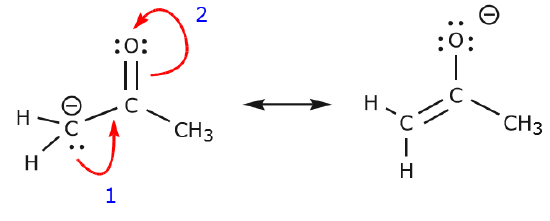
L’exemple suivant illustre comment une paire d’électrons solitaires du carbone peut être déplacée pour établir une nouvelle liaison \(\pi\) avec un carbone adjacent, et comment les électrons \(\pi\) entre le carbone et l’oxygène peuvent être déplacés pour devenir une paire d’électrons non partagés sur l’oxygène. Aucune des règles précédentes n’a été violée dans aucun de ces exemples.
Regardons maintenant quelques exemples de COMMENT NE PAS DÉPLACER LES ÉLECTRONS. L’utilisation du même exemple, mais en déplaçant les électrons d’une manière différente, illustre comment un tel mouvement aboutirait à des formules de Lewis invalides, et est donc inacceptable. Non seulement nous déplaçons les électrons dans la mauvaise direction (en les éloignant d’un atome plus électronégatif), mais la structure qui en résulte viole plusieurs conventions. Premièrement, le carbone central a cinq liaisons et viole donc la règle de l’octuple. Ensuite, la charge globale de la deuxième structure est différente de celle de la première. Pour éviter d’avoir un carbone avec cinq liaisons, nous devrions détruire l’une des liaisons simples C-C, détruisant ainsi le squelette moléculaire.
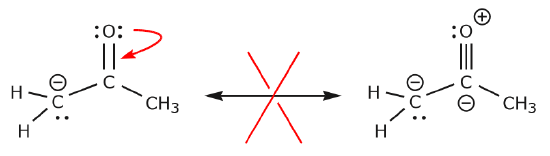
Dans l’exemple ci-dessous, les électrons sont déplacés vers une zone de haute densité électronique (une charge négative), plutôt que vers une charge positive. En outre, la règle de l’octuor est violée pour le carbone dans la structure résultante, où il partage plus de huit électrons.
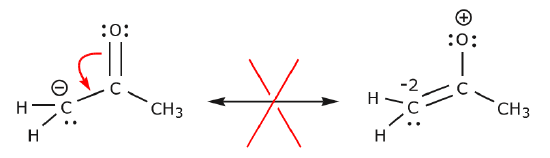
Des exemples supplémentaires illustrent davantage les règles dont nous avons parlé.
(a) Les paires d’électrons non partagées (paires solitaires) situées sur un atome donné ne peuvent se déplacer vers une position adjacente que pour établir une nouvelle liaison \(\pi\) avec l’atome suivant.
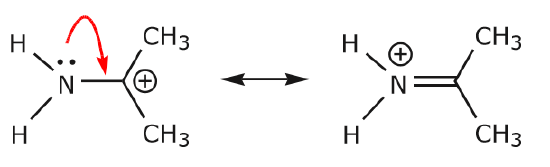
(b) À moins qu’il n’y ait une charge positive sur l’atome suivant (carbone ci-dessus), d’autres électrons devront être déplacés pour préserver la règle de l’octuor. Dans les structures de résonance, il s’agit presque toujours d’électrons \(\pi\), et presque jamais d’électrons sigma.
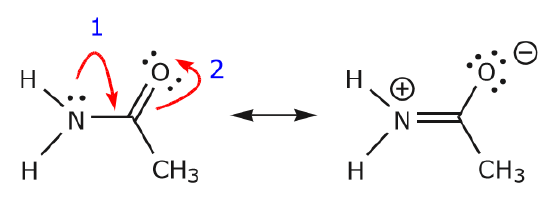
Alors que les électrons de la paire solitaire de l’azote se déplacent vers le carbone voisin pour faire une nouvelle liaison \(\pi\), les électrons \(\pi\) constituant la liaison C=O doivent être déplacés vers l’oxygène pour éviter de se retrouver avec cinq liaisons au carbone central.
c) Comme on peut le voir ci-dessus, les électrons \(\pi\) peuvent se déplacer vers l’un des deux atomes qu’ils partagent pour former une nouvelle paire solitaire. Dans l’exemple ci-dessus, les électrons \(\pi\) de la liaison C=O se sont déplacés vers l’oxygène pour former une nouvelle paire solitaire. Autre exemple :
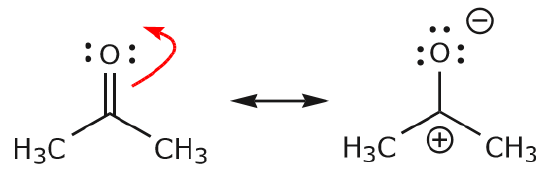
(d) Les électrons \(\pi\) peuvent également se déplacer vers une position adjacente pour former une nouvelle liaison \(\pi\). Encore une fois, la règle de l’octuor doit être observée :
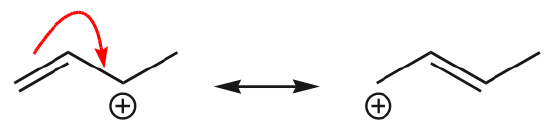
Un des exemples les plus courants de cette caractéristique est observé lors de l’écriture des formes de résonance pour le benzène et les cycles similaires.
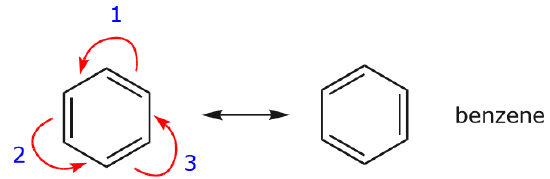
.