Verwendung von gekrümmten Pfeilen
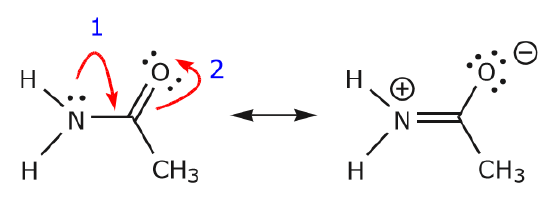
Wir kehren nun zu einem alten Bekannten zurück, \(CH_3CNO\), das wir bei unserer ersten Diskussion über Resonanzstrukturen vorgestellt haben. Wir verwenden diese Verbindung, um weiter zu veranschaulichen, wie bewegliche Elektronen „geschoben“ werden, um von einer Resonanzstruktur zu einer anderen zu gelangen.
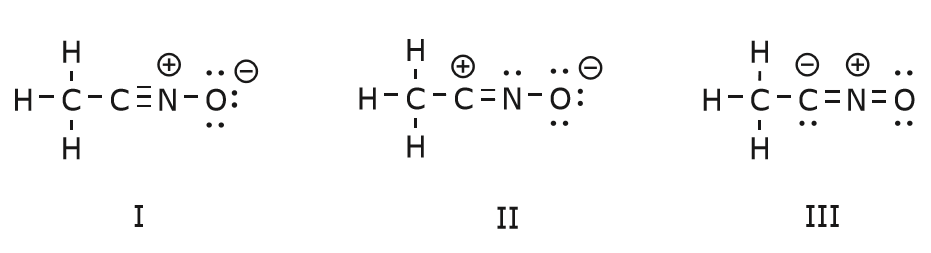
Die Bewegung der Elektronen, die stattfindet, um von Struktur I zu Struktur II zu gelangen, beginnt mit der Dreifachbindung zwischen Kohlenstoff und Stickstoff. Wir verschieben eine der beiden \(\pi\)-Bindungen, die Teil der Dreifachbindung sind, in Richtung der positiven Ladung des Stickstoffs, wie gezeigt:
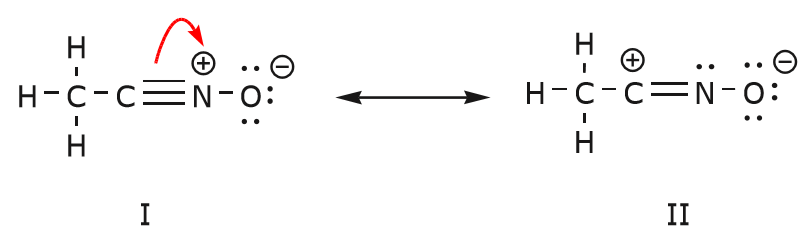
Wenn wir dies tun, achten wir genau auf den neuen Status der betroffenen Atome und nehmen alle notwendigen Anpassungen an den Ladungen, Bindungen und nicht geteilten Elektronen vor, um die Gültigkeit der resultierenden Formeln zu erhalten. In diesem Fall muss zum Beispiel der Kohlenstoff, der in Struktur I Teil der Dreifachbindung ist, in Struktur II eine positive Ladung erhalten, da er ein Elektron verloren hat. Der Stickstoff hingegen ist jetzt neutral, weil er ein Elektron gewonnen hat und drei statt vier Bindungen bildet.
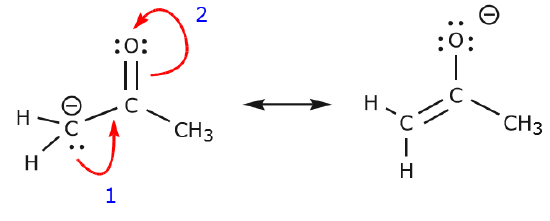
Wir können auch von Struktur I zu Struktur III gelangen, indem wir die Elektronen auf folgende Weise verschieben. Die Pfeile wurden in diesem Beispiel nummeriert, um anzuzeigen, welche Bewegung zuerst beginnt, aber das ist nicht Teil der Konventionen, die im Formalismus der gekrümmten Pfeile verwendet werden.
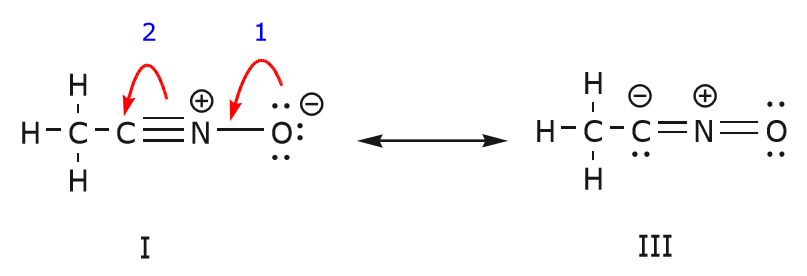
Wenn wir ein Paar nicht geteilter Elektronen vom Sauerstoff zum Stickstoffatom verschieben, wie in Schritt 1 gezeigt, sind wir gezwungen, Elektronen vom Stickstoff zum Kohlenstoff zu verschieben, wie in Schritt 2 gezeigt. Andernfalls würden wir einen Stickstoff mit 5 Bindungen erhalten, was unmöglich ist, auch wenn es nur vorübergehend ist. Auch hier ist zu beachten, dass der Pfeil in Schritt 1 von einem nicht geteilten Elektronenpaar des Sauerstoffs ausgeht und sich in Richtung der positiven Ladung des Stickstoffs bewegt. Es entsteht eine neue \(\pi\)-Bindung zwischen Stickstoff und Sauerstoff. Gleichzeitig werden die \(\pi\)-Elektronen, die in Schritt 2 in Richtung Kohlenstoff verschoben werden, zu einem Paar nicht geteilter Elektronen in Struktur III. Schließlich ändert sich auch der Hybridisierungszustand einiger Atome. Zum Beispiel ist das Kohlenstoffatom in Struktur I sp-hybridisiert, aber in Struktur III ist es \(sp^3\)-hybridisiert.
Vielleicht möchten Sie noch ein wenig herumspielen und sehen, ob Sie von Struktur II zu Struktur III gelangen können, usw. Sei jedoch gewarnt, dass es manchmal kniffliger ist, als es auf den ersten Blick scheint.
Zusätzliche Regeln für das Bewegen von Elektronen, um Resonanzstrukturen zu schreiben:
- Elektronenpaare können sich nur auf benachbarte Positionen bewegen. Benachbarte Positionen bedeuten benachbarte Atome und/oder Bindungen.
- Die Lewis-Strukturen, die durch das Verschieben von Elektronen entstehen, müssen gültig sein und die gleiche Nettoladung enthalten wie alle anderen Resonanzstrukturen.
Das folgende Beispiel veranschaulicht, wie ein einsames Elektronenpaar des Kohlenstoffs verschoben werden kann, um eine neue \(\pi\)-Bindung zu einem benachbarten Kohlenstoff herzustellen, und wie die \(\pi\)-Elektronen zwischen Kohlenstoff und Sauerstoff verschoben werden können, um ein Paar nicht geteilter Elektronen auf Sauerstoff zu werden. Keine der vorangegangenen Regeln wurde in einem dieser Beispiele verletzt.
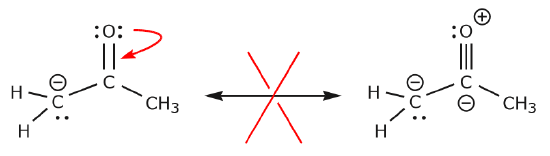
Nun wollen wir uns einige Beispiele dafür ansehen, WIE MAN ELEKTRONEN NICHT BEWEGT. Anhand desselben Beispiels, bei dem die Elektronen jedoch auf andere Weise bewegt werden, wird veranschaulicht, dass eine solche Bewegung zu ungültigen Lewis-Formeln führen würde und daher inakzeptabel ist. Wir bewegen die Elektronen nicht nur in die falsche Richtung (weg von einem elektronegativeren Atom), sondern die resultierende Struktur verstößt auch gegen mehrere Konventionen. Erstens hat der zentrale Kohlenstoff fünf Bindungen und verstößt damit gegen die Oktettregel. Zweitens ist die Gesamtladung der zweiten Struktur anders als die der ersten. Um einen Kohlenstoff mit fünf Bindungen zu vermeiden, müssten wir eine der C-C-Einfachbindungen zerstören, wodurch das Molekülskelett zerstört würde.
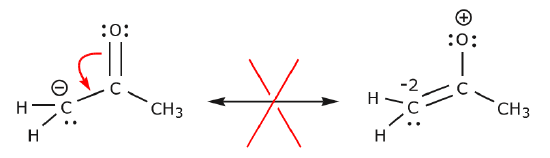
Im folgenden Beispiel werden die Elektronen in Richtung eines Bereichs mit hoher Elektronendichte (negative Ladung) und nicht in Richtung einer positiven Ladung bewegt. Außerdem wird die Oktettregel für Kohlenstoff in der resultierenden Struktur verletzt, da er mehr als acht Elektronen teilt.
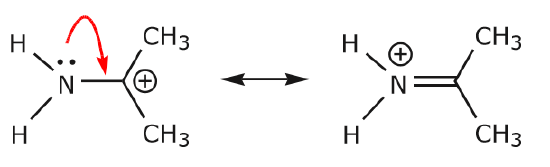
Weitere Beispiele veranschaulichen die Regeln, über die wir gesprochen haben.
(a) Ungeteilte Elektronenpaare (einsame Paare), die sich an einem bestimmten Atom befinden, können nur an eine benachbarte Position wandern, um eine neue \(\pi\)-Bindung zum nächsten Atom zu bilden.
(b) Sofern keine positive Ladung am nächsten Atom (Kohlenstoff oben) vorhanden ist, müssen andere Elektronen verschoben werden, um die Oktettregel zu wahren. In Resonanzstrukturen handelt es sich dabei fast immer um \(\pi\)-Elektronen und fast nie um Sigma-Elektronen.
Wenn sich die Elektronen des einsamen Stickstoffpaars in Richtung des benachbarten Kohlenstoffs bewegen, um eine neue \(\pi\)-Bindung zu bilden, müssen die \(\pi\)-Elektronen, die die C=O-Bindung bilden, in Richtung des Sauerstoffs verschoben werden, um zu vermeiden, dass am Ende fünf Bindungen zum zentralen Kohlenstoff bestehen.
c) Wie oben zu sehen ist, können sich die \(\pi\)-Elektronen in Richtung eines der beiden Atome bewegen, die sie gemeinsam nutzen, um ein neues einsames Paar zu bilden. Im obigen Beispiel haben sich die \(\pi\)-Elektronen aus der C=O-Bindung in Richtung des Sauerstoffs bewegt, um ein neues einsames Paar zu bilden. Ein weiteres Beispiel ist:
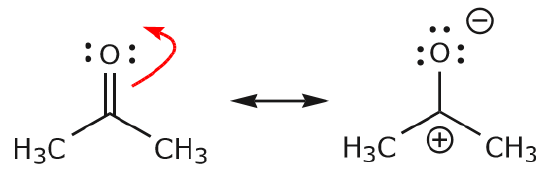
(d) \(\pi\)-Elektronen können auch in eine benachbarte Position wandern, um eine neue \(\pi\)-Bindung zu bilden. Auch hier muss die Oktettregel beachtet werden:
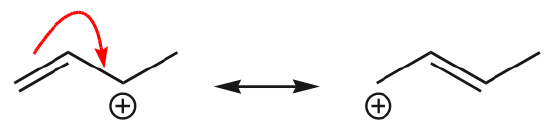
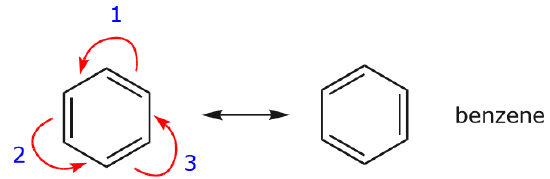
Eines der häufigsten Beispiele für diese Eigenschaft wird beim Schreiben von Resonanzformen für Benzol und ähnliche Ringe beobachtet.