Usando Setas Curvas
Agora voltamos a um velho amigo nosso, { CH_3CNO}, que introduzimos quando falamos pela primeira vez das estruturas de ressonância. Usamos este composto para ilustrar melhor como os elétrons móveis são “empurrados” para chegar de uma estrutura de ressonância para outra.
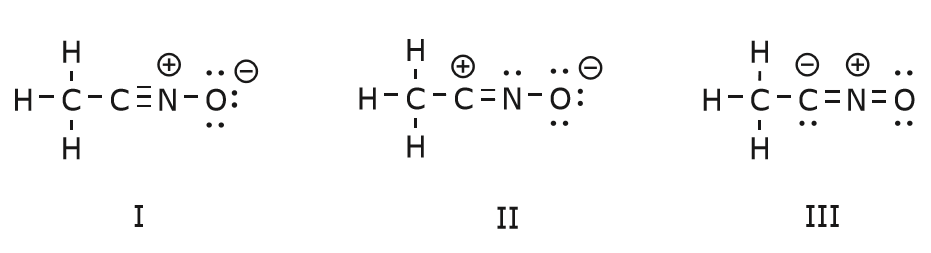
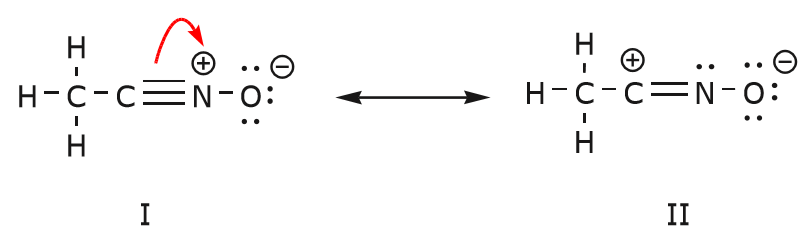
O movimento dos elétrons que ocorre para chegar à estrutura II a partir da estrutura I começa com a tripla ligação entre carbono e nitrogênio. Vamos mover uma das duas ligações que fazem parte da ligação tripla para a carga positiva sobre o nitrogênio, como mostrado:
 >
>
Quando fazemos isso, prestamos muita atenção ao novo status dos átomos afetados e fazemos os ajustes necessários nas cargas, ligações e elétrons não compartilhados para preservar a validade das fórmulas resultantes. Neste caso, por exemplo, o carbono que faz parte da tripla ligação na estrutura I tem de adquirir uma carga positiva na estrutura II porque perdeu um electrão. O nitrogénio, por outro lado, é agora neutro porque ganhou um electrão e está a formar três ligações em vez de quatro.
Também podemos chegar da estrutura I à estrutura III empurrando os electrões da seguinte forma. As setas foram numeradas neste exemplo para indicar qual movimento começa primeiro, mas isso não faz parte das convenções usadas no formalismo da seta curva.
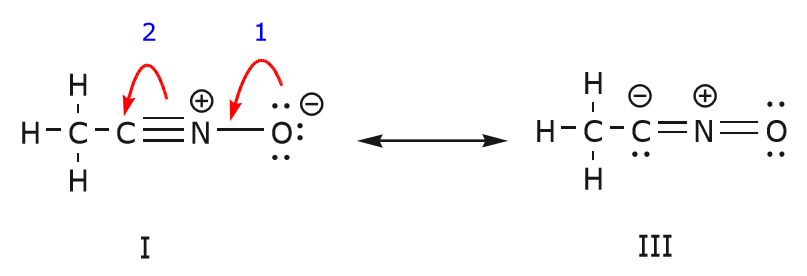
Como movemos um par de elétrons não partilhados do oxigênio em direção ao átomo de nitrogênio como mostrado no passo 1, somos forçados a deslocar os elétrons do nitrogênio em direção ao carbono como mostrado no passo 2. Caso contrário acabaríamos com um nitrogênio com 5 ligações, o que é impossível, mesmo que apenas momentaneamente. Mais uma vez, note que no passo 1 a seta tem origem num par de electrões não partilhados do oxigénio e move-se em direcção à carga positiva sobre o nitrogénio. Uma nova ligação forma-se entre o nitrogénio e o oxigénio. Ao mesmo tempo, os elétrons sendo deslocados em direção ao carbono no passo 2 tornam-se um par de elétrons não compartilhados na estrutura III. Finalmente, o estado de hibridização de alguns átomos também muda. Por exemplo, o átomo de carbono na estrutura I é hibridizado, mas na estrutura III é hibridizado.
Você pode querer brincar mais um pouco e ver se você pode chegar da estrutura II para a estrutura III, etc. No entanto, fique avisado que às vezes é mais complicado do que parece à primeira vista.
Regras adicionais para mover elétrons para escrever Estruturas de Ressonância:
- Pares de elétrons só podem se mover para posições adjacentes. Posições adjacentes significa átomos vizinhos e/ou ligações.
- As estruturas Lewis resultantes dos electrões em movimento devem ser válidas e devem conter a mesma carga líquida que todas as outras estruturas de ressonância.
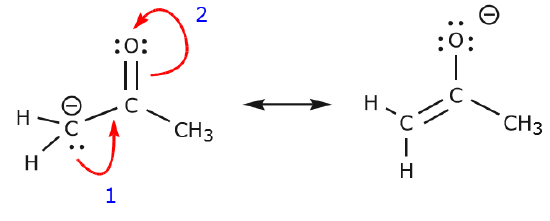
O exemplo seguinte ilustra como um par único de electrões de carbono pode ser movido para fazer uma nova ligação a um carbono adjacente, e como os electrões entre carbono e oxigénio podem ser movidos para se tornarem um par de electrões não partilhados sobre oxigénio. Nenhuma das regras anteriores foi violada em nenhum destes exemplos.
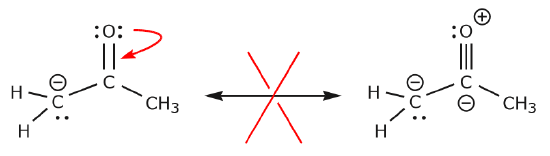
Agora vamos ver alguns exemplos de COMO NÃO MOVER ELETRÔNICOS. Usando o mesmo exemplo, mas movendo elétrons de uma maneira diferente, ilustra como tal movimento resultaria em fórmulas inválidas de Lewis, e portanto é inaceitável. Não só estamos movendo elétrons na direção errada (longe de um átomo mais eletronegativo), mas a estrutura resultante viola várias convenções. Primeiro, o carbono central tem cinco ligações e, portanto, viola a regra do octeto. Em segundo lugar, a carga global da segunda estrutura é diferente da primeira. Para evitar ter um carbono com cinco ligações teríamos que destruir uma das ligações únicas de C-C, destruindo o esqueleto molecular no processo.
No exemplo abaixo os elétrons estão sendo movidos para uma área de alta densidade de elétrons (uma carga negativa), e não para uma carga positiva. Além disso, a regra do octeto é violada para o carbono na estrutura resultante, onde partilha mais de oito electrões.
Exemplos adicionais ilustram melhor as regras de que temos estado a falar.
(a) Os pares de electrões não partilhados (pares isolados) localizados num determinado átomo só podem mover-se para uma posição adjacente para fazer uma nova ligação ao próximo átomo.
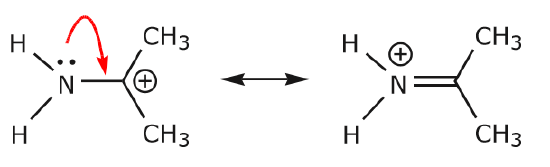
(b) A menos que haja uma carga positiva no próximo átomo (carbono acima), outros electrões terão de ser deslocados para preservar a regra do octeto. Em estruturas de ressonância estes são quase sempre elétrons, e quase nunca elétrons sigma.
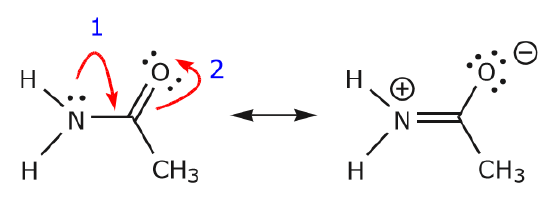
Como os elétrons do par solitário de nitrogênio se movem em direção ao carbono vizinho para fazer uma nova ligação, os elétrons que compõem a ligação C=O devem ser deslocados em direção ao oxigênio para evitar que terminem com cinco ligações ao carbono central.
c) Como pode ser visto acima, os electrões podem mover-se para um dos dois átomos que partilham para formar um novo par solitário. No exemplo acima, os elétrons da ligação C=O se moveram em direção ao oxigênio para formar um novo par solitário. Outro exemplo é:
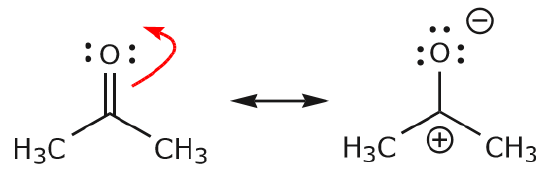
(d) {\pi} Os electrões também se podem mover para uma posição adjacente para formar uma nova ligação. Mais uma vez, a regra do octeto deve ser observada:
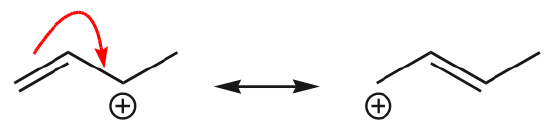
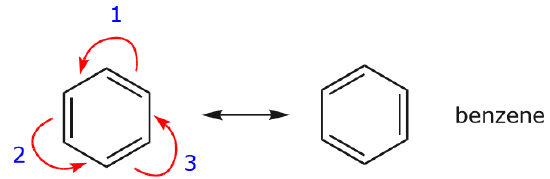
Um dos exemplos mais comuns desta característica é observado ao escrever formas de ressonância para benzeno e anéis similares.