Användning av böjda pilar
Vi återvänder nu till en gammal vän till oss, \(CH_3CNO\), som vi introducerade när vi först talade om resonansstrukturer. Vi använder denna förening för att ytterligare illustrera hur rörliga elektroner ”skjuts” för att komma från en resonansstruktur till en annan.
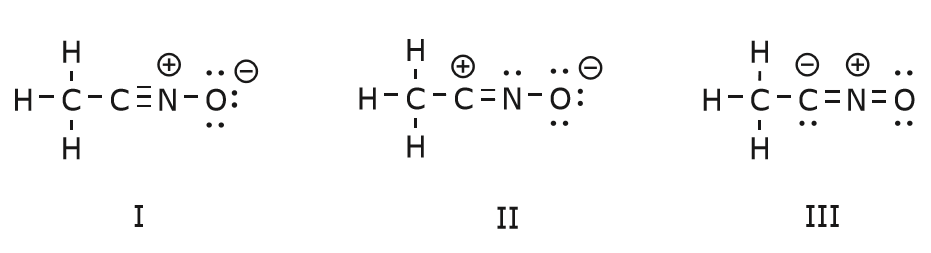
Den förflyttning av elektroner som sker för att komma till struktur II från struktur I börjar med trippelbindningen mellan kol och kväve. Vi flyttar en av de två \(\pi\)-bindningar som ingår i trippelbindningen mot den positiva laddningen på kväve, enligt följande:
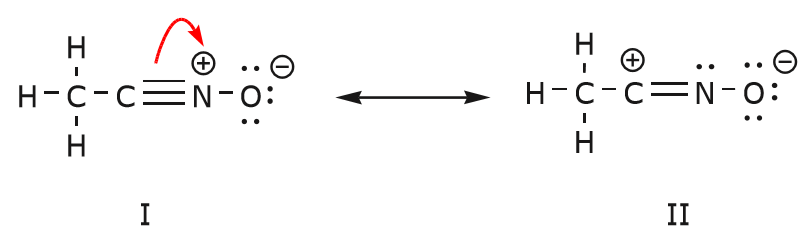
När vi gör detta är vi mycket uppmärksamma på den nya statusen hos de berörda atomerna och gör alla nödvändiga justeringar av laddningar, bindningar och odelade elektroner för att bevara giltigheten hos de resulterande formlerna. I det här fallet måste till exempel kolet som ingår i trippelbindningen i struktur I få en positiv laddning i struktur II eftersom det har förlorat en elektron. Kvävet, å andra sidan, är nu neutralt eftersom det fick en elektron och bildar tre bindningar i stället för fyra.
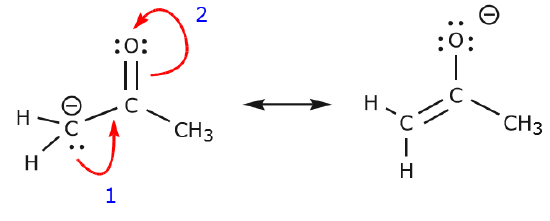
Vi kan också komma från struktur I till struktur III genom att skjuta elektroner på följande sätt. Pilarna har numrerats i det här exemplet för att ange vilken rörelse som börjar först, men det ingår inte i de konventioner som används i formalismen för krökta pilar.
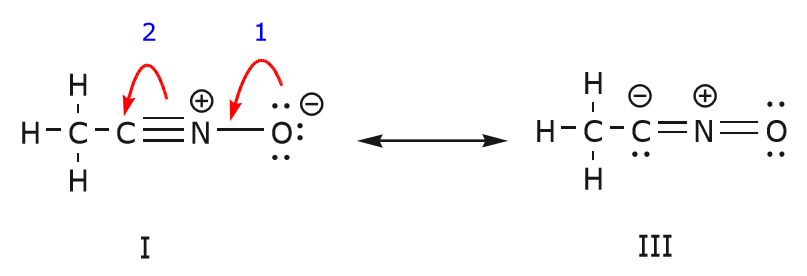
När vi flyttar ett par odelade elektroner från syre till kväveatomen enligt steg 1 tvingas vi att förskjuta elektroner från kväve till kol enligt steg 2. Annars skulle vi få ett kväve med 5 bindningar, vilket är omöjligt, även om det bara är tillfälligt. Lägg återigen märke till att pilen i steg 1 utgår från ett odelat elektronpar från syre och rör sig mot den positiva laddningen på kväve. En ny \(\pi\) bindning bildas mellan kväve och syre. Samtidigt blir de \(\pi\)-elektroner som förflyttas mot kol i steg 2 ett par odelade elektroner i struktur III. Slutligen ändras också hybridiseringstillståndet hos vissa atomer. Kolatomen i struktur I är till exempel sp-hybridiserad, men i struktur III är den \(sp^3\) hybridiserad.
Du kanske vill leka lite mer och se om du kan komma från struktur II till struktur III osv. Var dock varnad för att det ibland är knepigare än vad det verkar vid första anblicken.
Tilläggsregler för att flytta elektroner för att skriva resonansstrukturer:
- Elektronpar kan bara flytta till intilliggande positioner. Med angränsande positioner menas angränsande atomer och/eller bindningar.
- De Lewisstrukturer som blir resultatet av att flytta elektroner måste vara giltiga och måste innehålla samma nettoladdning som alla andra resonansstrukturer.
Följande exempel illustrerar hur ett ensam elektronpar från kol kan flyttas för att skapa en ny \(\pi\) bindning till ett angränsande kol, och hur \(\pi\) elektronerna mellan kol och syre kan flyttas för att bli ett par odelade elektroner på syre. Ingen av de tidigare reglerna har överträtts i något av dessa exempel.
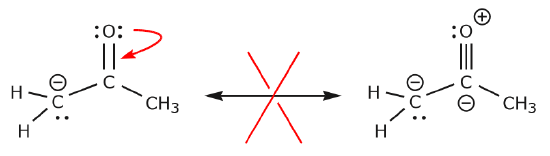
Nu ska vi titta på några exempel på HUR man inte flyttar elektroner. Genom att använda samma exempel, men flytta elektroner på ett annat sätt, illustreras hur en sådan förflyttning skulle resultera i ogiltiga Lewisformler och därför är oacceptabel. Vi flyttar inte bara elektronerna i fel riktning (bort från en mer elektronegativ atom), utan den resulterande strukturen bryter mot flera konventioner. För det första har det centrala kolet fem bindningar och bryter därför mot oktettregeln. För det andra är den totala laddningen i den andra strukturen annorlunda än i den första. För att undvika att ha ett kol med fem bindningar skulle vi vara tvungna att förstöra en av C-C enkelbindningarna, vilket skulle förstöra det molekylära skelettet i processen.
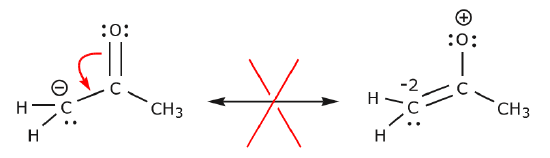
I exemplet nedan flyttas elektroner mot ett område med hög elektrontäthet (en negativ laddning), snarare än mot en positiv laddning. Dessutom bryts oktettregeln för kolet i den resulterande strukturen, där det delar fler än åtta elektroner.
Andra exempel illustrerar ytterligare de regler vi har talat om.
(a) Odelade elektronpar (lone par) som befinner sig på en viss atom kan bara förflytta sig till en intilliggande position för att göra en ny \(\pi\)-bindning till nästa atom.
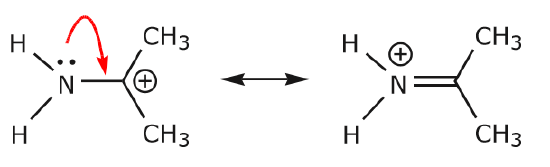
(b) Om det inte finns en positiv laddning på nästa atom (kolet ovan), måste andra elektroner förflyttas för att bevara oktettregeln. I resonansstrukturer är dessa nästan alltid \(\pi\)-elektroner och nästan aldrig sigmaelektroner.
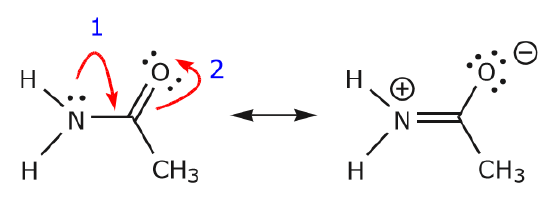
När elektronerna från det ensamma kväveparet rör sig mot det närliggande kolet för att bilda en ny \(\pi\)-bindning måste \(\pi\)-elektronerna som bildar C=O-bindningen förskjutas mot syret för att undvika att hamna med fem bindningar till det centrala kolet.
c) Som framgår ovan kan \(\pi\) elektroner förflytta sig mot en av de två atomer som de delar för att bilda ett nytt ensamt par. I exemplet ovan rörde sig \(\pi\) elektronerna från C=O-bindningen mot syret för att bilda ett nytt ensamstående par. Ett annat exempel är:
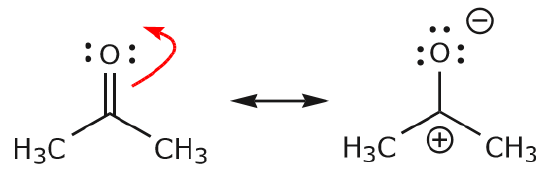
(d) \(\pi\)-elektroner kan också flytta sig till en intilliggande position för att bilda en ny \(\pi\)-bindning. Återigen måste oktettregeln iakttas:
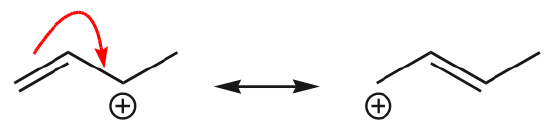
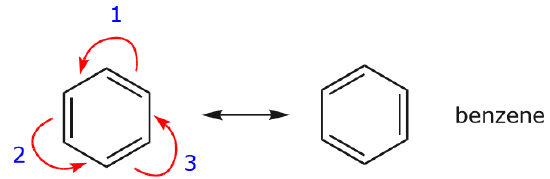
Ett av de vanligaste exemplen på denna egenskap observeras när man skriver resonansformer för bensen och liknande ringar.