Kaarevien nuolien käyttäminen
Palaamme nyt vanhaan ystäväämme, \(CH_3CNO\), jonka esittelimme puhuessamme ensimmäisen kerran resonanssirakenteista. Käytämme tätä yhdistettä havainnollistamaan edelleen, miten liikkuvia elektroneja ”työnnetään” saapuaksemme yhdestä resonanssirakenteesta toiseen.
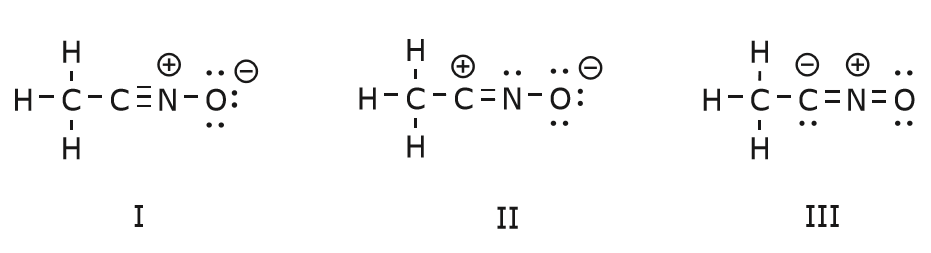
Elektronien liike, joka tapahtuu saapuaksemme rakenteeseen II rakenteesta I, alkaa hiilen ja typen välisestä kolmoissidoksesta. Siirrämme yhden kahdesta \(\pi\)-sidoksesta, jotka muodostavat osan kolmoissidoksesta, kohti typen positiivista varausta, kuten kuvassa on esitetty:
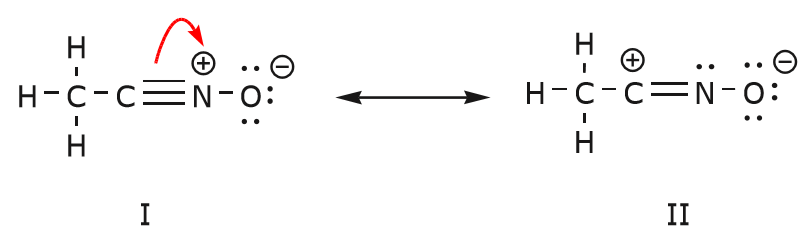
Tehdessämme tämän kiinnitämme tarkkaan huomiota asianomaisten atomien uuteen asemaan ja teemme tarvittavat muutokset varauksiin, sidoksiin ja jakamattomiin elektroneihin, jotta tuloksena olevien kaavojen pätevyys säilyy. Tässä tapauksessa esimerkiksi hiilen, joka muodostaa osan kolmoissidoksesta rakenteessa I, on saatava positiivinen varaus rakenteessa II, koska se on menettänyt yhden elektronin. Typpi taas on nyt neutraali, koska se sai yhden elektronin ja se muodostaa kolmen sidoksen neljän sijaan.
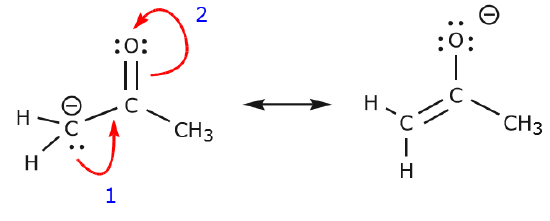
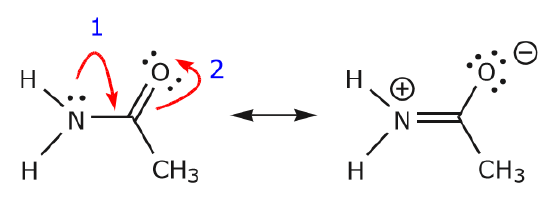
Voidaan myös päästä rakenteesta I rakenteeseen III työntämällä elektroneja seuraavalla tavalla. Nuolet on tässä esimerkissä numeroitu osoittamaan, kumpi liike alkaa ensin, mutta se ei kuulu kaarevien nuolien formalismissa käytettyihin konventioihin.
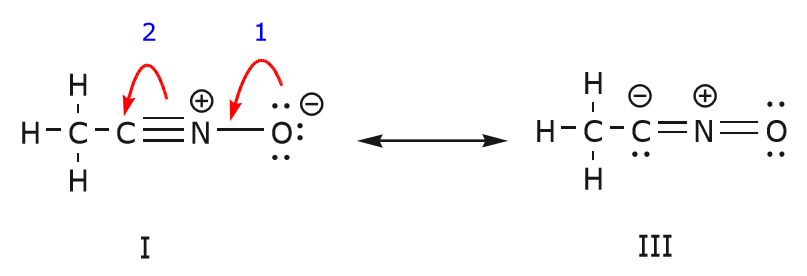
Kun siirretään pari jakamatonta elektronia hapesta kohti typpiatomia vaiheessa 1 esitetyllä tavalla, joudutaan siirtämään elektroneja typestä kohti hiiltä vaiheessa 2 esitetyllä tavalla. Muuten päätyisimme typpeen, jossa on 5 sidosta, mikä on mahdotonta, vaikkakin vain hetkellisesti. Huomaa jälleen, että vaiheessa 1 nuoli lähtee hapen jakamattomasta elektroniparista ja siirtyy kohti typen positiivista varausta. Typen ja hapen välille muodostuu uusi \(\pi\) sidos. Samaan aikaan \(\pi\)-elektronit, jotka siirtyvät kohti hiiltä vaiheessa 2, muuttuvat jakamattomaksi elektronipariksi rakenteessa III. Lopuksi myös joidenkin atomien hybridisaatiotila muuttuu. Esimerkiksi hiiliatomi rakenteessa I on sp-hybridisoitunut, mutta rakenteessa III se on \(sp^3\)-hybridisoitunut.
Voithan leikkiä vähän lisää ja katsoa, pääsetkö rakenteesta II rakenteeseen III jne. Varoitetaan kuitenkin, että joskus se on hankalampaa kuin miltä ensisilmäyksellä näyttää.
Lisäsääntöjä elektronien siirtämiseen resonanssirakenteiden kirjoittamiseksi:
- Elektroniparit voivat siirtyä vain vierekkäisiin asemiin. Vierekkäisillä paikoilla tarkoitetaan viereisiä atomeja ja/tai sidoksia.
- Elektronien siirtämisen tuloksena syntyvien Lewis-rakenteiden on oltava kelvollisia ja niiden on sisällettävä sama nettovaraus kuin kaikkien muidenkin resonanssirakenteiden.
Seuraava esimerkki havainnollistaa, miten hiilen yksinäinen elektronipari voidaan siirtää niin, että se muodostaa uuden \(\pi\)-sidoksen viereiseen hiileen, ja miten hiilen ja hapen väliset \(\pi\)-elektronit voidaan siirtää niin, että ne muuttuvat hapen jakamattomaksi elektronipariksi. Yhtäkään edellisistä säännöistä ei ole rikottu missään näistä esimerkeistä.
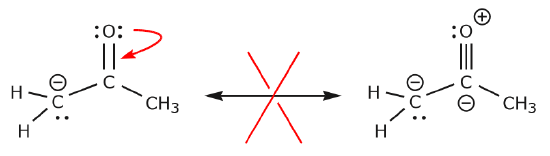
Katsotaan nyt esimerkkejä siitä, MITEN ELEKTRONEJA EI SAA LIIKKUA. Käyttämällä samaa esimerkkiä, mutta siirtämällä elektroneja eri tavalla, havainnollistetaan, miten tällainen siirto johtaisi virheellisiin Lewisin kaavoihin, eikä sitä näin ollen voida hyväksyä. Emme ainoastaan siirrä elektroneja väärään suuntaan (poispäin elektronegatiivisemmasta atomista), vaan tuloksena oleva rakenne rikkoo useita konventioita. Ensinnäkin keskushiilellä on viisi sidosta, joten se rikkoo oktettisääntöä. Toiseksi toisen rakenteen kokonaisvaraus on erilainen kuin ensimmäisen. Välttääksemme hiilen, jossa on viisi sidosta, meidän pitäisi tuhota yksi C-C-yksilösidoksista, jolloin molekyylin luuranko tuhoutuisi.
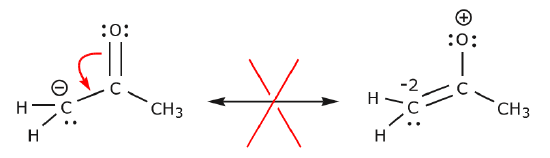
Oheisessa esimerkissä elektroneja siirretään kohti aluetta, jossa on suuri elektronitiheys (negatiivinen varaus), eikä kohti positiivista varausta. Lisäksi syntyvässä rakenteessa hiilen osalta rikotaan oktettisääntöä, jossa se jakaa enemmän kuin kahdeksan elektronia.
Lisäesimerkit havainnollistavat edelleen sääntöjä, joista olemme puhuneet.
(a) Tietyssä atomissa sijaitsevat jakamattomat elektroniparit (yksinäiset parit) voivat siirtyä viereiseen paikkaan vain muodostaakseen uuden \(\pi\)sidoksen seuraavaan atomiin.
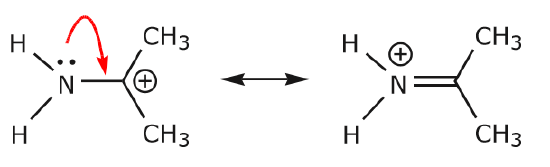
(b) Ellei seuraavassa atomissa (hiili edellä) ole positiivista varausta, muiden elektronien täytyy siirtyä, jotta oktettisääntö säilyy. Resonanssirakenteissa nämä ovat lähes aina \(\pi\)-elektroneita, eivätkä melkein koskaan sigmaelektroneita.
Kun typen yksinäisen parin elektronit siirtyvät kohti viereistä hiiltä muodostaakseen uuden \(\pi\)-sidoksen, C=O-sidoksen muodostavat \(\pi\)-elektronit on siirrettävä kohti happea, jotta vältettäisiin se, että päädyttäisiin lopulta viiteen sidokseen keskimmäisen hiilen kanssa.
c) Kuten edellä nähdään, \(\pi\)-elektronit voivat siirtyä jompaankumpaan niistä kahdesta atomista, jotka ne jakavat, muodostaakseen uuden yksinäisen parin. Yllä olevassa esimerkissä C=O-sidoksen \(\pi\)-elektronit siirtyivät kohti happea muodostaen uuden yksinäisen parin. Toinen esimerkki on:
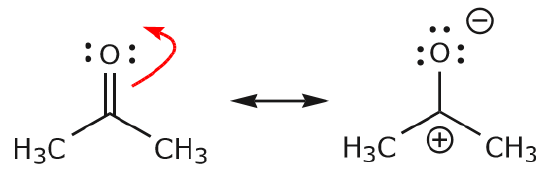
(d) \(\pi\) elektronit voivat myös siirtyä viereiseen paikkaan muodostaen uuden \(\pi\) sidoksen. Jälleen kerran on noudatettava oktettisääntöä:
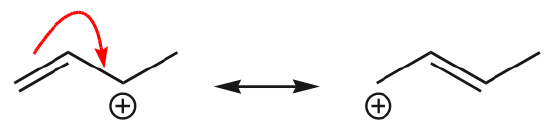
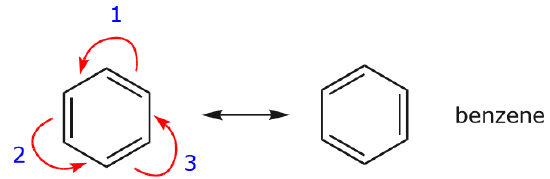
Yksi yleisimmistä esimerkeistä tästä ominaisuudesta havaitaan kirjoitettaessa bentseenin ja vastaavien renkaiden resonanssimuotoja.