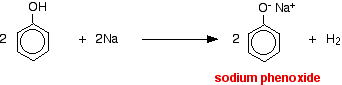Zuurheid van fenol
Verbindingen zoals alcoholen en fenol die een -OH groep bevatten die aan een koolwaterstof vastzit zijn zeer zwakke zuren. Alcoholen zijn zo zwak zuur dat, voor normale laboratoriumdoeleinden, hun zuurheid praktisch kan worden genegeerd. Fenol is echter voldoende zuur om herkenbare zure eigenschappen te hebben – ook al is het nog steeds een zeer zwak zuur. Een waterstofion kan zich van de -OH groep losmaken en op een base overgaan. Bijvoorbeeld, in oplossing in water:

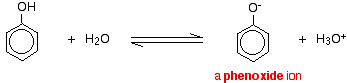
Phenol is een zeer zwak zuur en de evenwichtspositie ligt ver naar links. Fenol kan een waterstofion verliezen omdat het gevormde fenoxide-ion tot op zekere hoogte gestabiliseerd is. De negatieve lading op het zuurstofatoom is rond de ring gedelokaliseerd. Hoe stabieler het ion is, hoe waarschijnlijker het is dat het zich vormt. Een van de lone paren op het zuurstofatoom overlapt met de gedelokaliseerde elektronen op de benzeenring.
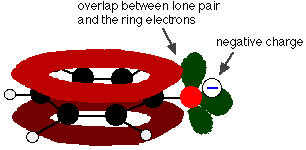
Deze overlapping leidt tot een delokalisatie die zich vanaf de ring uitstrekt over het zuurstofatoom. Het gevolg is dat de negatieve lading niet meer volledig op het zuurstof gelokaliseerd is, maar over het hele ion verspreid is.
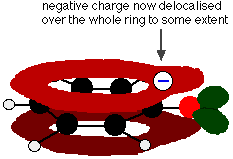
Het verspreiden van de lading maakt het ion stabieler dan het zou zijn als alle lading op het zuurstof bleef. Zuurstof is echter het meest elektronegatieve element in het ion en de gedelokaliseerde elektronen zullen daarheen worden getrokken. Dat betekent dat er nog steeds veel lading rond de zuurstof zal zijn, die de neiging zal hebben het waterstofion weer aan te trekken. Daarom is fenol slechts een zeer zwak zuur.
Waarom is fenol een veel sterker zuur dan cyclohexanol? Om deze vraag te beantwoorden moeten we de manier evalueren waarop een zuurstofsubstituent interageert met de benzeenring. Zoals we in onze eerdere behandeling van elektrofiele aromatische substitutiereacties hebben opgemerkt, verhoogt een zuurstofsubstituent de reactiviteit van de ring en bevordert het de aanval van elektrofielen op ortho- en para-locaties. Voorgesteld werd dat resonantie-delokalisatie van een zuurstof-elektronenpaar zonder binding in het pi-elektronensysteem van de aromatische ring verantwoordelijk was voor dit substituent-effect. Een soortgelijke reeks resonantiestructuren voor de geconjugeerde base van het fenolaatanion verschijnt onder de fenolstructuren.
De resonantiestabilisatie in deze twee gevallen is zeer verschillend. Een belangrijk principe van resonantie is dat ladingsscheiding het belang van de canonieke bijdragen aan de resonantiehybride vermindert en de totale stabilisatie vermindert. De structuren die bijdragen aan de fenol-hybride lijden allemaal onder ladingsscheiding, wat resulteert in een zeer bescheiden stabilisatie van deze verbinding. Aan de andere kant is het fenolaat anion al geladen, en de canonieke bijdragen zorgen voor de verspreiding van de lading, wat resulteert in een aanzienlijke stabilisatie van deze stof. De geconjugeerde basen van eenvoudige alcoholen worden niet gestabiliseerd door ladingsdelokalisatie, zodat de zuurgraad van deze verbindingen vergelijkbaar is met die van water. Een energiediagram dat het effect van resonantie op de zuurtegraad van cyclohexanol en fenol toont, is hiernaast afgebeeld. Aangezien de resonantiestabilisatie van de fenolaatconjugaatbase veel groter is dan de stabilisatie van fenol zelf, is de zuurgraad van fenol ten opzichte van cyclohexanol verhoogd. Ondersteunend bewijs dat de negatieve lading van het fenolaat is gedelokaliseerd op de ortho- en para-koolbonen van de benzeenring komt van de invloed van elektron-onttrekkende substituenten op die plaatsen.

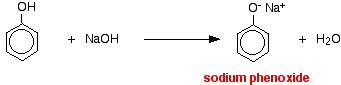
In deze reactie is het waterstofion verwijderd door het sterk basische hydroxide-ion in de natriumhydroxide-oplossing.
Zuren reageren met de meer reactieve metalen om waterstofgas te geven. Fenol is geen uitzondering – het enige verschil is de langzame reactie omdat fenol zo’n zwak zuur is. Fenol wordt in een droge buis verwarmd tot het gesmolten is, en een klein stukje natrium wordt toegevoegd. Er ontstaat wat bruis door het vrijkomen van waterstofgas. Het mengsel dat in de buis achterblijft, bevat natriumfenoxide.