
ALLISON SIEBECKER, ND, MSOM, LAC
STEVEN SANDBURG-LEWIS, ND, DHANP
Jednym z naszych głównych celów jest edukowanie lekarzy na temat skutecznych metod leczenia zespołu jelita drażliwego (IBS). W naszym ostatnim artykule na temat przerostu bakteryjnego jelita cienkiego (SIBO), wyjaśniliśmy podstawy tej głównej przyczyny IBS. Jako kontynuację, omówimy teraz drobne punkty diagnozy i interpretacji testów (z przykładami przypadków), jak również dietę, probiotyki, naprawę i zapobieganie.
Diagnozowanie SIBO
Istnieją 2 testy, które mogą zdiagnozować SIBO: endoskopia z hodowlą i wodorowo-metanowy test oddechowy. Ani badanie kału, ani badanie kwasu organicznego w moczu nie może zdiagnozować SIBO. Najczęściej stosowaną metodą oceny SIBO jest wodorowo-metanowy test oddechowy, ponieważ oferuje on najbardziej dokładne i szczegółowe informacje, a jednocześnie jest nieinwazyjny i niedrogi. Dla porównania, endoskopia, choć oferuje bezpośredni pomiar, ma kilka ograniczeń. Jest inwazyjna, kosztowna i może pobrać próbki tylko z proksymalnej części jelita cienkiego, ponieważ endoskopia zazwyczaj nie sięga poza dwunastnicę.1 Jest to istotne ograniczenie, ponieważ uważa się, że SIBO występuje najczęściej w dystalnej części jelita.2 Dodatkowo, hodowla nie może dokładnie odzwierciedlać bakterii beztlenowych obecnych w SIBO, ponieważ większość bakterii beztlenowych nie może być hodowana.3 Podobnie, badanie kwasów organicznych, które może pośrednio wskazywać na przerost bakterii poprzez obecność hippuratu w moczu, p-hydroksybenzoesanu i innych metabolitów bakteryjnych, nie może rozróżnić lokalizacji przerostu pomiędzy dystalnym jelitem cienkim a proksymalnym jelitem grubym, ani zaoferować szczegółów dostarczonych przez test oddechowy.4 Badanie stolca może sugerować jedynie przerost bakterii w jelicie grubym, chociaż może wykazać zaburzenia wchłaniania tłuszczów, które często są wynikiem SIBO.
Rozrost bakterii powoduje wytwarzanie nadmiernych ilości wodoru i/lub metanu.5, 6 Gazy te nie są wytwarzane przez człowieka, ale są metabolicznymi produktami ubocznymi fermentacji węglowodanów przez bakterie jelitowe.7 Test oddechowy mierzy stężenie tych gazów i dlatego jest badaniem pośrednim; jednakże określa, które gazy są obecne, jak również lokalizację i nasilenie SIBO. Informacja ta jest często niezbędna do leczenia i oceny rokowania. Ponadto, większość badań nad SIBO wykorzystuje test oddechowy.
Po pobraniu próbki podstawowej na czczo, roztwór laktulozy, niewchłanialnego cukru syntetycznego, jest przyjmowany jako substrat do fermentacji bakteryjnej. Tylko bakterie, nie ludzie, produkują enzymy do trawienia laktulozy. Laktuloza potrzebuje około 2 godzin, aby przejść przez jelito cienkie. W tym czasie, co 15-20 minut pobierane są seryjne próbki oddechu, które odzwierciedlają ilość bakterii w jelicie cienkim, oraz przez trzecią godzinę, która odzwierciedla jelito grube. Chociaż czas przechodzenia laktulozy przez jelito cienkie jest przedmiotem dyskusji w literaturze, ogólnie przyjmuje się, że minimum 90 minut prawidłowo odzwierciedla SIBO.2 Glukoza może być również używana jako substrat testowy, ale z powodu jej szybkiego wchłaniania w proksymalnym jelicie cienkim, nie jest ona w stanie zidentyfikować dystalnego SIBO.2 Jeśli wynik testu na glukozę jest negatywny, test na laktulozę jest nadal wymagany w celu zbadania dystalnego SIBO.
Test wymaga 24-godzinnej diety przygotowawczej i całonocnego postu. Przygotowanie do testu różni się w zależności od laboratorium, ale typowa dieta przygotowawcza jest ograniczona do białego ryżu, ryb/drobiu/mięsa, jaj, twardych serów, klarownego rosołu wołowego lub drobiowego (nie rosołu kostnego lub bulionu), oleju, soli i pieprzu. Celem diety przygotowawczej jest uzyskanie wyraźnej reakcji na roztwór testowy poprzez zmniejszenie obecności pokarmów ulegających fermentacji. W niektórych przypadkach mogą być potrzebne 2 dni diety przygotowawczej, aby wystarczająco zredukować poziom podstawowy gazów do ujemnego. Antybiotyki nie powinny być stosowane przez co najmniej 2 tygodnie przed pierwszym testem, chociaż niektóre źródła zalecają 4 tygodnie.7 Jeśli pacjent przyjmuje stale antybiotyki i podejrzewa się u niego SIBO, pierwszy test oddechowy można wykonać bez odstawiania antybiotyków.
Test może być wykonany w placówce wyposażonej w urządzenie do badania oddechu lub w domu przy użyciu zestawu, który jest wysyłany do analizy. (Patrz www.siboinfo.com/testing.) Nie wszystkie laboratoria wykonują testy na obecność metanu, ponieważ oprzyrządowanie jest różne. Badanie metanu jest ważne, ponieważ leczenie może się różnić w przypadku metanu w porównaniu z wodorem.
Interpretacja testu może się znacznie różnić wśród praktyków.2 Nie ma uzgodnionych kryteriów, sytuacja, którą mamy nadzieję zobaczyć naprawioną. Jest bardzo możliwe, że pacjent może być uznany za pozytywny przez jednego lekarza/laboratorium, a negatywny przez innego. Kryteria podane przez producenta maszyny dla pozytywnego testu są następujące:8
– Wzrost w stosunku do najniższej poprzedniej wartości w produkcji wodoru o 20 części na milion (ppm) lub większej w ciągu 120 minut po spożyciu laktulozy
– Wzrost w stosunku do najniższej poprzedniej wartości w produkcji metanu o 12 ppm lub większej w ciągu 120 minut po spożyciu. laktulozę
– Wzrost w stosunku do najniższej poprzedniej wartości w połączonej sumie produkcji wodoru i metanu o 15 ppm lub więcej w ciągu 120 minut po spożyciu laktulozy
Stwierdziliśmy, że bezwzględny poziom gazów na poziomie lub powyżej dodatnich poziomów ppm podanych przez QuinTron, bez wzrostu ponad poziom podstawowy lub najniższą poprzedzającą wartość, dobrze koreluje z klinicznym SIBO. Jest to szczególnie prawdziwe dla gazu metanowego, który może mieć wzór podwyższonej linii podstawowej (> 12 ppm), która pozostaje podwyższona przez czas trwania testu (Rysunek 1). W takich przypadkach metan może wzrosnąć tylko o 5 ppm, ale poziom ppm jest stale powyżej pozytywnego punktu odcięcia. Interpretacja podwyższonego wodoru lub metanu w próbce podstawowej (przed spożyciem laktozy) jest kontrowersyjna, ale wolimy uważać wysoką wartość podstawową za test pozytywny9, 10 (rysunek 2), chyba że poziom gazu spada po wartości podstawowej i nadal się zmniejsza lub pozostaje niski w ciągu pierwszych 2 godzin, wskazując na niewłaściwą dietę przygotowawczą (rysunki 3 i 3.5).
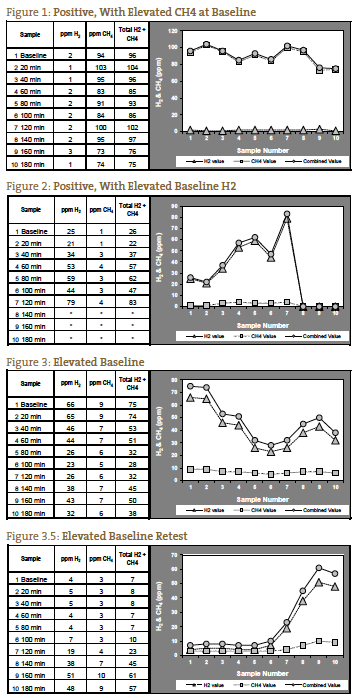
Klasyczny wynik pozytywny dla SIBO został uznany za podwójny pik, z pierwszym szczytem reprezentującym SIBO i drugim szczytem reprezentującym normalną obfitość bakterii jelita grubego (rysunek 4). Z naszego doświadczenia wynika, że taka prezentacja jest rzadka. Częściej widzimy jeden pik, który wzrasta jeszcze wyżej w trzeciej godzinie, reprezentujący dystalne SIBO, po którym następują normalne bakterie jelita grubego (Rycina 5).
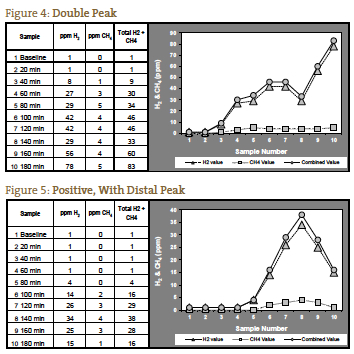
Jeśli mierzone gazy nie wzrastają aż do 120 minut, możliwe jest, że jest to spowodowane wydłużonym czasem tranzytu, co widzieliśmy u pacjentów z ciężkim zaparciem. U takiego pacjenta z oczekiwanym obrazem objawów dla SIBO typu zaparciowego, znaczący wzrost po 140 minutach może być interpretowany jako test pozytywny (Rycina 6). Rycina 7 przedstawia test negatywny; zauważ, że skala po lewej stronie wykresu jest zmniejszona, aby odzwierciedlić niższy poziom gazu. Rysunki od 1 do 7 są przykładami przypadków dostarczonymi przez laboratorium NCNM.
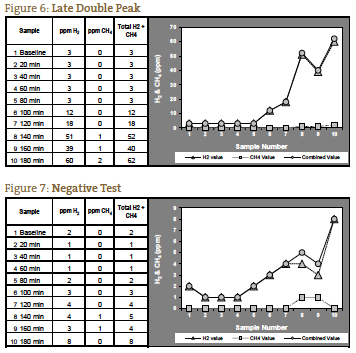
Testy oddechowe mogą być stosowane w przypadkach pediatrycznych, tak długo jak dziecko może prawidłowo przestrzegać instrukcji dotyczących wdmuchiwania gazu do urządzenia zbierającego. W przypadku osób w wieku poniżej 3 lat badanie najlepiej wykonać w biurze/laboratorium, ze względu na różnice w metodach pobierania próbek w porównaniu z zestawami domowymi. Pediatryczne dawkowanie laktulozy wynosi 1g/kg masy ciała, przy czym maksymalna dawka wynosi 10 g (osoby ważące 22 funty i więcej otrzymują maksymalną dawkę dla dorosłych wynoszącą 10 g).11 Zestawy laktulozy mogą być zamawiane wyłącznie przez lekarzy przepisujących leki, ponieważ laktuloza jest lekiem wydawanym na receptę.
Leczenie dietetyczne
Diety stosowane w leczeniu SIBO zmniejszają obciążenie bakteryjne i fermentację węglowodanów, a także wspomagają gojenie się tkanek. Odbywa się to poprzez zmniejszenie ilości polisacharydów, oligosacharydów i disacharydów poprzez eliminację wszystkich zbóż, warzyw bogatych w skrobię, laktozy i substancji słodzących innych niż miód. Na początku eliminowane są rośliny strączkowe. Stwierdziliśmy, że stosowanie Specyficznej Diety Węglowodanowej™ (SCD) lub jej wariantu, diety GAPS (Gut and Psychology Syndrome™) jako diety zasadniczej, z włączeniem zaleceń dotyczących owoców i warzyw z diety Low FODMAP™ (Tabela 1) jest skutecznym podejściem. (Dieta Low FODMAP jest dietą stosowaną w leczeniu IBS, która powstała w wyniku zbadania poziomu fermentujących węglowodanów w żywności; jej skuteczność w leczeniu IBS wynosi 76%.12 Dieta FODMAP nie została opracowana specjalnie dla SIBO i dlatego nie eliminuje źródeł polisacharydów i disacharydów, takich jak zboża, skrobia, warzywa skrobiowe i sacharoza. Eliminacja tych polisacharydów i disacharydów jest niezbędna w SIBO. W SIBO dobrze wchłaniane węglowodany, pokarmy, które zwykle służą do karmienia gospodarza, zamiast tego odżywiają zwiększoną ilość bakterii jelita cienkiego, powodując objawy i napędzając wzrost bakterii1 (Rycina 8).
Każda dieta będzie musiała być zindywidualizowana metodą prób i błędów w czasie. Dostarczenie tabeli żywności lub konkretnej recepty na dietę jedynie oferuje miejsce do rozpoczęcia.
Diety niskowęglowodanowe są dietami odchudzającymi. Szczególną uwagę należy zwrócić na tych, którzy mają nadwagę lub niedowagę. Jeśli dieta SIBO prowadzi do nadmiernej utraty wagi, strategia żywieniowa musi zostać zmieniona, aby umożliwić spożywanie większej ilości węglowodanów. W takich okolicznościach należy rozważyć jedną lub więcej z pozostałych 3 opcji leczenia opisanych w naszym poprzednim artykule, wraz z białym ryżem, glukozą i innymi źródłami węglowodanów.
Probiotyki
Probiotyki są kontrowersyjną interwencją w SIBO, ponieważ laktobakterie zostały wyhodowane w SIBO13 i istnieje obawa o zwiększenie przeciążenia bakteryjnego. Jest to szczególnie istotne w przypadku zmniejszonej ruchliwości spowodowanej dysfunkcją migrującego kompleksu motorycznego (MMC). Pomimo tych obaw, nieliczne badania nad probiotykami, które koncentrowały się bezpośrednio na SIBO, wykazały dobre wyniki, z odsetkiem eradykacji wynoszącym 47% w przypadku Bacillus clausii jako jedynego leczenia,14 64% odsetek powodzenia w przypadku Lactobacillus casei Shirota jako jedynego leczenia,15 oraz poprawę kliniczną wynoszącą 82% w przypadku Lactobacillus casei i L. plantarum, Streptococcus faecalis i Bifidobacter brevis jako jedynego leczenia.16 Jogurt probiotyczny zawierający Lactobacillus johnsonii normalizował odpowiedź cytokinową, zmniejszając niski stopień przewlekłego zapalenia występującego w SIBO, po 4 tygodniach suplementacji.17 U naszych pacjentów z SIBO zaobserwowaliśmy dobre wyniki, stosując różne probiotyki wieloszczepowe i pojedyncze, a także domowej roboty jogurt bez laktozy i hodowane warzywa.
Kluczowym punktem stosowania suplementów probiotycznych w SIBO jest unikanie prebiotyków jako głównych składników. Prebiotyki są fermentowalnym pożywieniem dla bakterii, które mogą nasilać objawy podczas aktywnego SIBO i sprzyjać rozwojowi bakterii po SIBO. Typowe prebiotyki występujące w suplementach probiotycznych to: FOS (frukto-oligosacharyd), MOS (mannan-oligosacharyd), GOS (galakto-oligosacharyd), inulinę i arabinogalaktan. Prebiotyki mogą być indywidualnie tolerowane w małych ilościach stosowanych jako składniki bazowe.
Przepuszczalność jelit
Badania badające tempo gojenia się śluzówki po SIBO wykazały, że przepuszczalność jelit normalizuje się u 75%-100% pacjentów z SIBO w ciągu czterech tygodni po skutecznym leczeniu antybiotykami.18,19 Dla tych, u których przepuszczalność nie normalizuje się, suplementy mogą wspomóc proces gojenia.
Zioła śluzowate są tradycyjnie stosowane do gojenia błony śluzowej, w tym Glycyrrhiza glabra (lukrecja), Ulmus fulva (śliski wiąz), Aloe vera i Althea officinalis (prawoślaz lekarski); jednak ich stosowanie po SIBO jest kontrowersyjne ze względu na zawartość mukopolisacharydów, które mogą zachęcać do rozwoju bakterii. Specyficzne składniki odżywcze, które stosowaliśmy to siara (2-6 g QD), L-glutamina (375-1500+ mg QD), cynk karnozyna (75-150 mg QD), witaminy A i D, często podawane w postaci oleju z wątroby dorsza (1 łyżka QD), kurkumina (400 mg do 3 g QD), resweratrol (250 mg do 2 g QD), glutation, jako doustny liposomalny (50-425 mg QD) lub prekursor glutationu N-acetylocysteina (200-600 mg QD. Suplementy są podawane przez 1 do 3 miesięcy, lub mogą być kontynuowane długoterminowo. Wyższe dawki kurkuminy i resweratrolu są podawane przez 2 tygodnie w celu zmniejszenia regulacji NF-Κβ, mediatora zwiększonej przepuszczalności jelit, a następnie bardziej umiarkowane poziomy podtrzymujące.20, 21,22
Prewencja
Suplementy
Kwas solny z betainą lub ziołowe suplementy gorzkie, które pobudzają wydzielanie kwasu solnego (HCl)23 mogą być stosowane w celu zmniejszenia obciążenia spożytych bakterii. Przy rozważaniu suplementacji HCl, złotym standardem jest badanie pH metodą Heidelberga.
Rozstawienie posiłków
Oprócz środków prokinetycznych (omówionych w naszym artykule ze stycznia 2013), rozstawienie posiłków na 4 do 5 godzin, spożywanie tylko wody, pozwala migrującemu kompleksowi motorycznemu (MMC) oczyścić jelito cienkie z bakterii w nocy i pomiędzy posiłkami.24 Stwierdziliśmy, że jest to bardzo pomocne klinicznie. Jeśli dieta low-carb SIBO nie poprawi hipoglikemii, ta strategia będzie musiała być zmieniona, aby umożliwić częstsze posiłki.
Obecne perspektywy interpretacji testów i strategii leczenia będą omawiane na Sympozjum SIBO 2014, 18-19 stycznia w Portland OR, a także będą dostępne na żywo i poprzez nagrane webinarium (www.sibosymposium.com).
 Allison Siebecker, ND, MSOM, LAc jest absolwentką National College of Natural Medicine (Portland, Oregon), gdzie specjalizuje się w leczeniu przerostu bakteryjnego jelita cienkiego (SIBO) i jest adiunktem w dziedzinie zaawansowanej gastroenterologii. Obecnie jest w trakcie pisania książki na temat SIBO. Odwiedź jej edukacyjną stronę internetową poświęconą SIBO pod adresem www.siboinfo.com.
Allison Siebecker, ND, MSOM, LAc jest absolwentką National College of Natural Medicine (Portland, Oregon), gdzie specjalizuje się w leczeniu przerostu bakteryjnego jelita cienkiego (SIBO) i jest adiunktem w dziedzinie zaawansowanej gastroenterologii. Obecnie jest w trakcie pisania książki na temat SIBO. Odwiedź jej edukacyjną stronę internetową poświęconą SIBO pod adresem www.siboinfo.com.
 Steven Sandberg-Lewis, ND, DHANP, jest praktykującym lekarzem naturopatą od czasu ukończenia National University of Natural Medicine (NUNM) w 1978 roku. Od 1985 roku jest profesorem w NUNM, prowadząc różne kursy, ale przede wszystkim koncentrując się na gastroenterologii i medycynie fizykalnej GI. Jego zajęcia w klinice są szczególnie popularne wśród doktorantów NUNM. Oprócz nadzorowania klinicznych rotacji utrzymuje również praktykę w niepełnym wymiarze godzin w 8Hearts Health and Wellness w Portland, Oregon.
Steven Sandberg-Lewis, ND, DHANP, jest praktykującym lekarzem naturopatą od czasu ukończenia National University of Natural Medicine (NUNM) w 1978 roku. Od 1985 roku jest profesorem w NUNM, prowadząc różne kursy, ale przede wszystkim koncentrując się na gastroenterologii i medycynie fizykalnej GI. Jego zajęcia w klinice są szczególnie popularne wśród doktorantów NUNM. Oprócz nadzorowania klinicznych rotacji utrzymuje również praktykę w niepełnym wymiarze godzin w 8Hearts Health and Wellness w Portland, Oregon.
Jest popularnym międzynarodowym wykładowcą na seminariach medycyny funkcjonalnej, prezentuje webinaria, pisze artykuły dla NDNR i Townsend List i jest często przesłuchiwany w sprawach zdrowia i choroby układu pokarmowego. Jest autorem podręcznika medycznego Functional Gastroenterology: Assessing and Addressing the Causes of Functional Digestive Disorders, Second Edition, 2017, który jest dostępny na stronie amazon.com. W 2010 roku był współzałożycielem Centrum SIBO w NUNM, które jest jednym z zaledwie czterech ośrodków w USA zajmujących się diagnostyką, leczeniem, edukacją i badaniami nad przerostem bakteryjnym jelita cienkiego. W 2014 roku został uznany za jednego z „Top Docs” w corocznym wydaniu miesięcznika Portland dotyczącym opieki zdrowotnej, a w 2015 roku został wprowadzony do OANP/NUNM Hall of Fame.
W ramach gastroenterologii, ma szczególne zainteresowanie i doświadczenie w nieswoistych zapaleniach jelit (w tym mikroskopowym zapaleniu jelita grubego), zespole jelita drażliwego (w tym poinfekcyjnym IBS), przeroście bakteryjnym jelita cienkiego (SIBO), przepuklinie rozworu przełykowego, refluksie żołądkowo-przełykowym i żółciowym (GERD), dyskinezie żółciowej oraz przewlekłych stanach nudności i wymiotów.
Dr Sandberg-Lewis mieszka w Portland z żoną, Kayle. Jego zainteresowania obejmują mandolinę, gitarę i głos; narciarstwo biegowe; pisanie i wykłady.
1. Lin HC. Small intestinal bacterial overgrowth: a framework for understanding irritable bowel syndrome. JAMA. 2004;292(7):852-858.
2. Shah ED, Basseri RJ, Chong K, Pimentel M. Abnormal breath testing in IBS: a meta-analysis. Dig Dis Sci. 2010;55(9):2441-2449.
3. Khoshini R, Dai SC, Lezcano S, Pimentel M. A systematic review of diagnostic tests for small intestinal bacterial overgrowth. Dig Dis Sci. 2008;53(6):1443-1454.
4. Lord RS, Bralley JA. Kliniczne zastosowania kwasów organicznych w moczu. Część 2. Dysbioza markerów. Altern Med Rev. 2008;13(4):292-306.
5. Riordan SM, Kim R. Bacterial overgrowth as a cause of irritable bowel syndrome. Curr Opin Gastroenterol. 2006;22(6):669-673.
6. Koide A, Yamaguchi T, Odaka T, et al. Quantitative analysis of bowel gas using plain abdominal radiograph in patients with irritable bowel syndrome. Am J Gastroenterol. 2000;95(7):1735-1741.
7. Eisenmann A, Amann A, Said M, et al. Implementation and interpretation of hydrogen breath tests. J Breath Res. 2008;2(4):046002.
8. Protocols and Interpretation Help, Hydrogen/Methane Breath Tests. Milwaukee, WI: QuinTron Instrument Company, Inc; 2013.
9. Quigley EM, Quera R. Small intestinal bacterial overgrowth: roles of antibiotics, prebiotics, and probiotics. Gastroenterology. 2006;130(2 Suppl 1):S78-S90.
10. Pimentel M, Lin HC, Enayati P, et al. Methane, a gas produced by enteric bacteria, slows intestinal transit and augments small intestinal contractile activity. Am J Physiol Gastrointest Liver Physiol. 2006;290(6):G1089-G1095.
11. QuinTron catalog and Information. Milwaukee, WI: QuinTron Instrument Company Inc; 2012:22.
12. Staudacher HM, Whelan K, Irving PM, Lomer MC. Comparison of symptom response following advice for a diet low in fermentable carbohydrates (FODMAPs) versus standard dietary advice in patients with irritable bowel syndrome. J Hum Nutr Diet. 2011;24(5):487–495.
13. Bouhnik Y, Alain S, Attar A, et al. Bacterial populations contaminating the upper gut in patients with small intestinal bacterial overgrowth syndrome. Am J Gastroenterol. 1999;94(5):1327–1331.
14. Gabrielli M, Lauritano EC, Scarpellini E, et al. Bacillus clausii as a treatment of small intestinal bacterial overgrowth. Am J Gastroenterol. 2009;104(5):1327-1328.
15. Barrett JS, Canale KE, Gearry RB, et al. Probiotic effects on intestinal fermentation patterns in patients with irritable bowel syndrome. World J Gastroenterol. 2008;14(32):5020-5024.
16. Soifer LO, Peralta D, Dima G, Besasso H. Comparative clinical efficacy of a probiotic vs. an antibiotic in the treatment of patients with intestinal bacterial overgrowth and chronic abdominal functional distension: a pilot study. Acta Gastroenterol Latinoam. 2010;40(4):323-327.
17. Schiffrin EJ, Parlesak A, Bode C, et al. Probiotic yogurt in the elderly with intestinal bacterial overgrowth: endotoxaemia and innate immune functions. Br J Nutr. 2009;101(7):961-966.
18. Lauritano EC, Valenza V, Sparano L, et al. Small intestinal bacterial overgrowth and intestinal permeability. Scand J Gastroenterol. 2010;45(9):1131-1132.
19. Riordan SM, McIver CJ, Thomas DH, et al. Luminal bacteria and small-intestinal permeability. Scand J Gastroenterol. 1997;32(6):556-563.
20. Ruland J. Return to homeostasis: downregulation of NF-κB responses. Nat Immunol. 2011;12(8):709-714.
21. Al-Sadi RM, Ma TY. IL-1beta causes an increase in intestinal epithelial tight junction permeability. J Immunol. 2007;178(7):4641-4649.
22. Csaki C, Mobasheri A, Shakibaei M. Synergistic chondroprotective effects of curcumin and resveratrol in human articular chondrocytes: inhibition of IL-1beta-induced NF-kappaB-mediated inflammation and apoptosis. Arthritis Res Ther. 2009;11(6):R165.
23. Bowman G. Jelito, mózg i zaburzenia czynnościowe przewodu pokarmowego. Seminarium Gastroenterologii Funkcjonalnej: Poziom 1. NCNM; Zima, 2010:19.
24. Pimentel M. Nowe rozwiązanie IBS. Sherman Oaks, CA: Health Point Press; 2006.
.