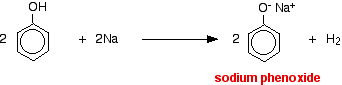Syra hos fenol
Föreningar som alkoholer och fenoler, som innehåller en -OH-grupp knuten till ett kolväte, är mycket svaga syror. Alkoholer är så svagt sura att man för normala laboratorieändamål praktiskt taget kan bortse från deras surhet. Fenol är dock tillräckligt surt för att ha igenkännbara sura egenskaper – även om det fortfarande är en mycket svag syra. En vätejon kan bryta sig loss från -OH-gruppen och övergå till en bas. Till exempel i lösning i vatten:

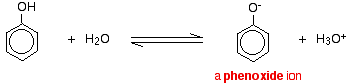
Phenol är en mycket svag syra och jämviktsläget ligger väl till vänster. Fenol kan förlora en vätejon eftersom den bildade fenoxidjonen i viss mån är stabiliserad. Den negativa laddningen på syreatomen är delokaliserad runt ringen. Ju stabilare jonen är, desto mer sannolikt är det att den bildas. Ett av de ensamma paren på syreatomen överlappar de delokaliserade elektronerna på bensenringen.
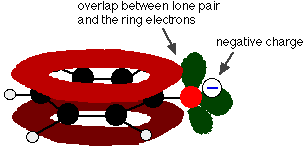
Denna överlappning leder till en delokalisering som sträcker sig från ringen ut över syreatomen. Som en följd av detta är den negativa laddningen inte längre helt lokaliserad på syret, utan sprids ut över hela jonen.
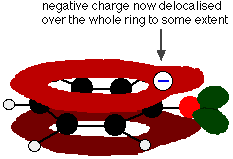
Spridningen av laddningen gör jonen stabilare än vad den skulle vara om all laddning stannade kvar på syret. Syre är dock det mest elektronegativa elementet i jonen och de delokaliserade elektronerna kommer att dras till det. Det betyder att det fortfarande kommer att finnas mycket laddning runt syret vilket kommer att ha en tendens att dra till sig vätejonen tillbaka igen. Därför är fenol bara en mycket svag syra.
Varför är fenol en mycket starkare syra än cyklohexanol? För att besvara denna fråga måste vi utvärdera det sätt på vilket en syre-substituent interagerar med bensenringen. Som vi noterade i vår tidigare behandling av elektrofila aromatiska substitutionsreaktioner ökar en syre-substituent ringens reaktivitet och gynnar elektrofil angrepp vid orto- och para-platser. Det föreslogs att resonansdelokalisering av ett icke-bundet syreelektronpar i den aromatiska ringens pi-elektronsystem var ansvarig för denna substituenteffekt. En liknande uppsättning resonansstrukturer för fenolatanjonens konjugerade bas visas under fenolstrukturerna.
Resonansstabiliseringen i dessa två fall är mycket olika. En viktig princip för resonans är att laddningsseparation minskar betydelsen av kanoniska bidragsgivare till resonanshybriden och minskar den totala stabiliseringen. De bidragande strukturerna till fenolhybriden drabbas alla av laddningsseparation, vilket resulterar i en mycket blygsam stabilisering av denna förening. Å andra sidan är fenolatanjonen redan laddad, och de kanoniska bidragsgivarna verkar för att sprida laddningen, vilket resulterar i en betydande stabilisering av denna art. De konjugerade baserna av enkla alkoholer stabiliseras inte av laddningsdelokalisering, så surheten hos dessa föreningar liknar den hos vatten. Ett energidiagram som visar resonansens effekt på cyklohexanolens och fenolens surhetsgrad visas till höger. Eftersom resonansstabiliseringen av fenolatkonjugatbasen är mycket större än stabiliseringen av själva fenolen, ökar fenolens surhet i förhållande till cyklohexanol. Stödjande bevis för att fenolatets negativa laddning är delokaliserad på bensenringens orto- och para-kolväten kommer från inflytandet av elektronåterkallande substituenter på dessa platser.

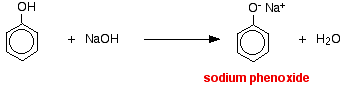
I denna reaktion har vätejonen avlägsnats av den starkt basiska hydroxidjonen i natriumhydroxidlösningen.
Syror reagerar med de mer reaktiva metallerna för att ge vätgas. Fenol är inget undantag – den enda skillnaden är den långsamma reaktionen eftersom fenol är en så svag syra. Fenol värms upp i ett torrt rör tills den är smält och en liten bit natrium tillsätts. Det uppstår ett visst bubblande när vätgas avges. Blandningen som blir kvar i röret kommer att innehålla natriumfenoxid.