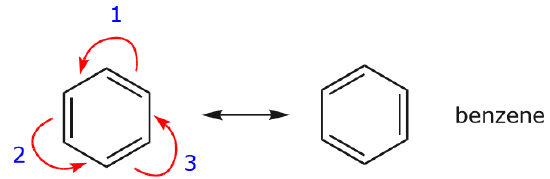
Usando flechas curvas
Volvemos ahora a un viejo amigo nuestro, el \(CH_3CNO\), que presentamos cuando hablamos por primera vez de las estructuras de resonancia. Utilizamos este compuesto para ilustrar mejor cómo los electrones móviles son «empujados» para llegar de una estructura de resonancia a otra.
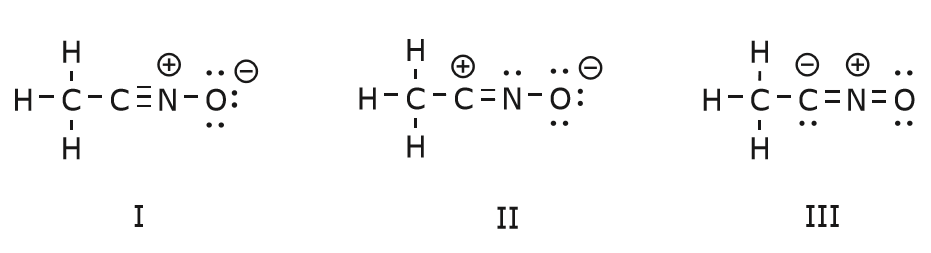
El movimiento de electrones que se produce para llegar a la estructura II desde la estructura I comienza con el triple enlace entre el carbono y el nitrógeno. Moveremos uno de los dos enlaces \(\pi\) que forman parte del triple enlace hacia la carga positiva del nitrógeno, como se muestra:
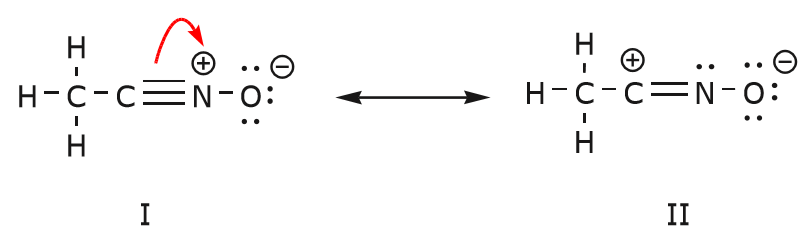
Cuando hacemos esto, prestamos mucha atención al nuevo estado de los átomos afectados y hacemos los ajustes necesarios en las cargas, enlaces y electrones no compartidos para preservar la validez de las fórmulas resultantes. En este caso, por ejemplo, el carbono que forma parte del triple enlace en la estructura I tiene que adquirir una carga positiva en la estructura II porque ha perdido un electrón. El nitrógeno, en cambio, es ahora neutro porque ha ganado un electrón y está formando tres enlaces en lugar de cuatro.
También podemos llegar de la estructura I a la estructura III empujando los electrones de la siguiente manera. Las flechas se han numerado en este ejemplo para indicar qué movimiento comienza primero, pero eso no forma parte de las convenciones utilizadas en el formalismo de flechas curvas.
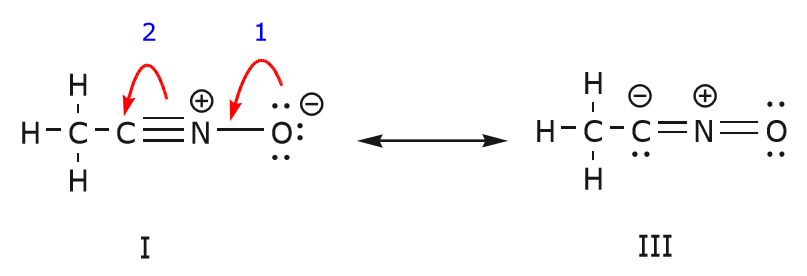
Al mover un par de electrones no compartidos desde el oxígeno hacia el átomo de nitrógeno como se muestra en el paso 1, nos vemos obligados a desplazar electrones desde el nitrógeno hacia el carbono como se muestra en el paso 2. De lo contrario, terminaríamos con un nitrógeno con 5 enlaces, lo cual es imposible, aunque sea momentáneamente. De nuevo, observa que en el paso 1 la flecha se origina con un par de electrones no compartidos del oxígeno y se mueve hacia la carga positiva del nitrógeno. Se forma un nuevo enlace \ (\pi) entre el nitrógeno y el oxígeno. Al mismo tiempo, los electrones \(\pi\) que se desplazan hacia el carbono en el paso 2 se convierten en un par de electrones no compartidos en la estructura III. Finalmente, el estado de hibridación de algunos átomos también cambia. Por ejemplo, el átomo de carbono en la estructura I está hibridado sp, pero en la estructura III está hibridado \(sp^3\).
Es posible que quieras jugar un poco más y ver si puedes llegar de la estructura II a la estructura III, etc. Sin embargo, ten en cuenta que a veces es más complicado de lo que puede parecer a primera vista.
Reglas adicionales para mover electrones para escribir Estructuras de Resonancia:
- Los pares de electrones sólo pueden moverse a posiciones adyacentes. Posiciones adyacentes significa átomos y/o enlaces vecinos.
- Las estructuras de Lewis que resultan de mover electrones deben ser válidas y deben contener la misma carga neta que todas las demás estructuras de resonancia.
El siguiente ejemplo ilustra cómo un par de electrones solitarios del carbono puede moverse para hacer un nuevo enlace \(\pi\) a un carbono adyacente, y cómo los electrones \(\pi\) entre el carbono y el oxígeno pueden moverse para convertirse en un par de electrones no compartidos en el oxígeno. Ninguna de las reglas anteriores ha sido violada en ninguno de estos ejemplos.
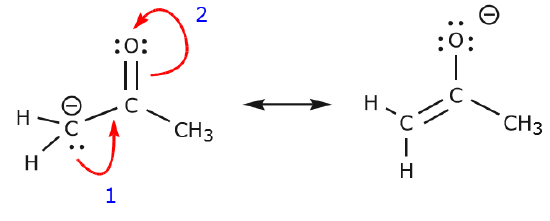
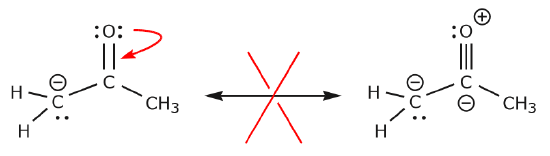
Ahora veamos algunos ejemplos de CÓMO NO MOVER ELECTRONES. Utilizando el mismo ejemplo, pero moviendo los electrones de forma diferente, se ilustra cómo dicho movimiento daría lugar a fórmulas de Lewis no válidas, y por lo tanto es inaceptable. No sólo estamos moviendo los electrones en la dirección equivocada (lejos de un átomo más electronegativo), sino que la estructura resultante viola varias convenciones. En primer lugar, el carbono central tiene cinco enlaces y, por tanto, viola la regla del octeto. En segundo lugar, la carga global de la segunda estructura es diferente a la de la primera. Para evitar tener un carbono con cinco enlaces tendríamos que destruir uno de los enlaces simples C-C, destruyendo el esqueleto molecular en el proceso.
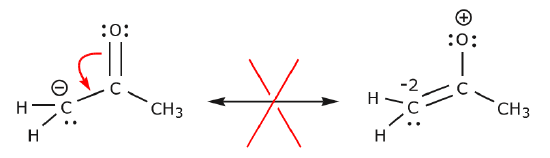
En el ejemplo de abajo los electrones se están moviendo hacia un área de alta densidad de electrones (una carga negativa), en lugar de hacia una carga positiva. Además, la regla del octeto se viola para el carbono en la estructura resultante, donde comparte más de ocho electrones.
Ejemplos adicionales ilustran aún más las reglas de las que hemos estado hablando.
(a) Los pares de electrones no compartidos (pares solitarios) situados en un átomo dado sólo pueden desplazarse a una posición adyacente para hacer un nuevo enlace \(π) con el átomo siguiente.
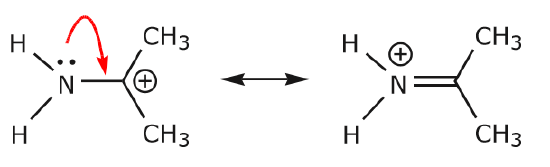
(b) A menos que haya una carga positiva en el átomo siguiente (el carbono de arriba), habrá que desplazar otros electrones para conservar la regla del octeto. En las estructuras de resonancia estos son casi siempre electrones \(\pi\), y casi nunca electrones sigma.
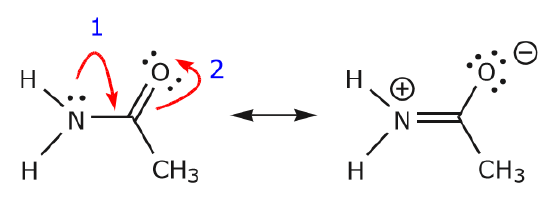
Como los electrones del par solitario del nitrógeno se mueven hacia el carbono vecino para hacer un nuevo enlace \(\pi\), los electrones \(\pi\) que forman el enlace C=O deben ser desplazados hacia el oxígeno para evitar terminar con cinco enlaces al carbono central.
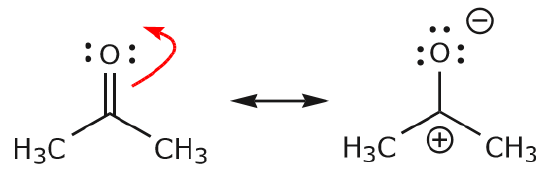
c) Como se ha visto anteriormente, los electrones \(\pi\) pueden desplazarse hacia uno de los dos átomos que comparten para formar un nuevo par solitario. En el ejemplo anterior, los electrones \(\pi\) del enlace C=O se movieron hacia el oxígeno para formar un nuevo par solitario. Otro ejemplo es:
(d) Los electrones \(\pi\) también pueden moverse a una posición adyacente para formar un nuevo enlace \(\pi\). Una vez más, debe observarse la regla del octeto:
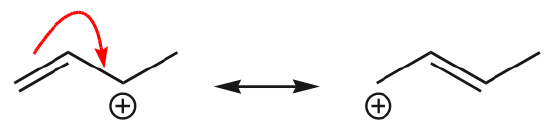
Uno de los ejemplos más comunes de esta característica se observa al escribir las formas de resonancia para el benceno y anillos similares.