Kuusi keskeistä elektrofiilistä aromaattista substituutioreaktiota
Aromaattisten yhdisteiden keskeinen reaktio on elektrofiilinen aromaattinen substituutio, jossa C-H-sidos katkeaa ja muodostuu uusi C-E-sidos (E on elektrofiilinen atomi, kuten Cl, Br, N…).
Sisällysluettelo
- Alkenit tuottavat ”additioitumistuotteita” reaktiossa elektrofiilien kanssa. Miten bentseeni sitten vertautuu?
- Elektrofiilinen aromaattinen substituutio
- Lewis-hapot kiihdyttävät elektrofiilisten aromaattisten substituutioreaktioiden nopeutta
- Kuuden tärkeän elektrofiilisen aromaattisen substituutioreaktion avainkuvio
- Aromaattisen klooraus ja bromaus
- Aromaattisen nitraatio ja sulfonointi
- Friedel-Crafts Alkylation and Acylation
- Yhteenveto: Kuusi keskeistä elektrofiilistä aromaattista substituutioreaktiota
- Testaa itsesi!
- Alkenit antavat ”additiotuotteita” reagoidessaan elektrofiilien kanssa. So How Does Benzene Compare?
- Elektrofiilinen aromaattinen substituutio
- Lewishapot kiihdyttävät elektrofiilisten aromaattisten substituutioreaktioiden nopeutta
- Kuuden tärkeän elektrofiilisen aromaattisen substituutioreaktion keskeinen malli
- Aromaattisten molekyylien klorinoituminen ja brominoituminen
- Aromaattisten molekyylien nitraatio ja sulfonointi
- Friedel-Crafts-alkylaatio ja asylaatio
- Yhteenveto: Kuusi keskeistä elektrofiilistä aromaattista substituutioreaktiota
- Quiz Yourself!
Alkenit antavat ”additiotuotteita” reagoidessaan elektrofiilien kanssa. So How Does Benzene Compare?
Kun käsittelimme alkeenien reaktioita jokin aika sitten – paljon reaktioita! – huomasimme, että suurin osa reaktioista kuului luokkaan, jota kutsumme additioreaktioiksi. Siinä katkaistaan (suhteellisen heikko) C-C (pi)-sidos ja muodostetaan kaksi uutta yksinkertaista sidosta hiileen. Alkeenien klooraus Cl2:lla on klassinen esimerkki:
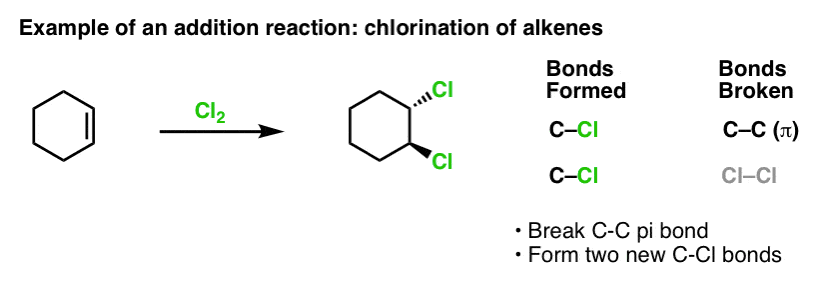
Koska olemme bentseenin aiheessa, on luonnollista miettiä, miten hyvin aromaattisten systeemien (kuten bentseenin) pi-sidokset ovat reaktiivisuudeltaan verrattavissa alkeenien pi-sidoksiin, ja sitä kautta, miten aromaattisten yhdisteiden reaktiot ovat verrattavissa alkeenien reaktioihin.
Olemme nähneet, että bentseenillä on epätavallinen stabiilisuus (36 kcal/mol resonanssienergiaa) suhteessa siihen, mitä odottaisimme teoreettiselta ”sykloheksatrieeniltä”, mikä varmasti saisi meidät ennustamaan, että aromaattisten molekyylien pi-sidokset ovat vähemmän reaktiivisia suhteessa alkeeniin.
Saatat myös muistaa, että bentseeni itsessään on epätavallisen vaikea hydrattava. Vety (H2) voidaan saada liittymään useimpien alkeenien yli katalyyttisen määrän hienojakoista palladiumia hiileen (Pd/C) läsnäollessa, mutta sinun täytyy todella kaivaa esiin purkki Aldrich Brand Whup-Ass® (ts. korkeat lämpötilat, korkeat H2:n paineet , pitkät reaktioajat ), jotta H2:n lisääminen bentseeniin onnistuisi ”tyypillisiin” alkeeniineihin nähden.
Tämän tietäen, miten voisimme olettaa, että Cl2:n tai Br2:n kaltaiset elektrofiilit reagoivat bentseenin kaltaisten aromaattisten yhdisteiden kanssa?
Elektrofiilinen aromaattinen substituutio
Ensimmäinen arvauksemme voisi olla, että bentseeni reagoi Cl2:n kanssa muodostaen alla esitetyn kaltaisen ”additiotuotteen” (vaikkakin hitaammin kuin ”tavallisella” alkeenilla):
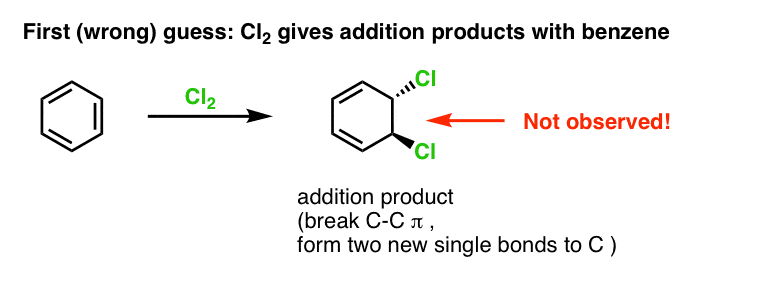
Tämä ei itse asiassa ole tuote, jota havaitsemme!
Sen sijaan, jos käsittelemme bentseeniä Cl2:lla, saamme lopulta (ja hyvin hitaasti) seuraavan tuotteen: klooribentseenin.
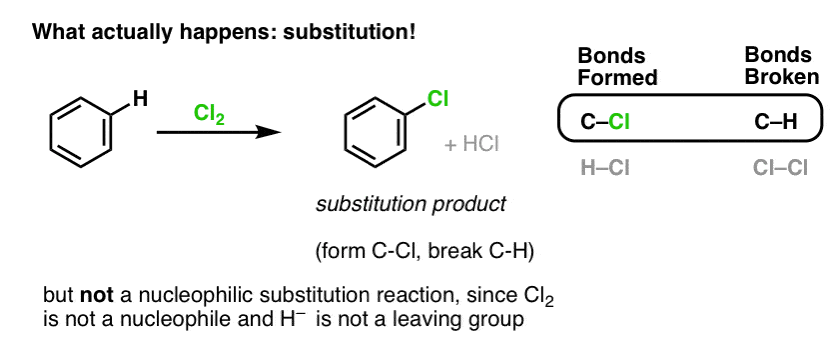
Mitkä sidokset muodostuivat ja mitkä sidokset katkeilivat tässä reaktiossa?
Muodostimme C-Cl:n ja katkaisimme C-H:n . Koska kaikki pi-sidokset ovat ehjiä, tämä ei ole additioreaktio. Sen sijaan tämä on siis eräänlainen substituutioreaktio, jossa muodostamme ja katkaisemme sidoksen yhteen hiileen.
Olemme nähneet aiemmin esimerkin substituutioreaktioista, mutta ne olivat nukleofiilisiä substituutioita, joissa nukleofiili (esim. RS- ) lisätään alkyylihalogenidielektrofiiliin (esim. R-Br) syrjäyttäen lähtevän ryhmän (Br- tässä) muodostaen C-Nuc-sidoksen (tässä tapauksessa C-S) ja katkaisten C-LG-sidoksen (tässä C-Br).
Onko Cl2:n ja bentseenin reaktio siis niin ikään nukleofiilinen substituutioreaktio? Ei!
Cl2 on erittäin huono nukleofiili, joka reagoi elektronin luovuttajana vain vahvojen Lewisin happojen kanssa (esim. AlCl3, alla). Kun se yhdistetään jopa suhteellisen lievän nukleofiilin, kuten alkeenin pi-sidoksen kanssa, se käyttäytyy elektrofiilinä (elektroniakseptorina), kuten näimme sen reaktiossa alkeenien kanssa.
Cl2:n reaktiota bentseenin kanssa kutsutaan näin ollen elektrofiiliseksi aromaattiseksi substituutioksi (lyhyesti EAS):
- Elektrofiilinen, koska lisäämme elektronipuutteisen lajin (elektrofiilin),
- aromaattiseen yhdisteeseen (bentseeniin);
- substituutio, koska katkaisemme C-H:n ja muodostamme C-E:n, jossa E on elektrofiilimme (tässä tapauksessa Cl).
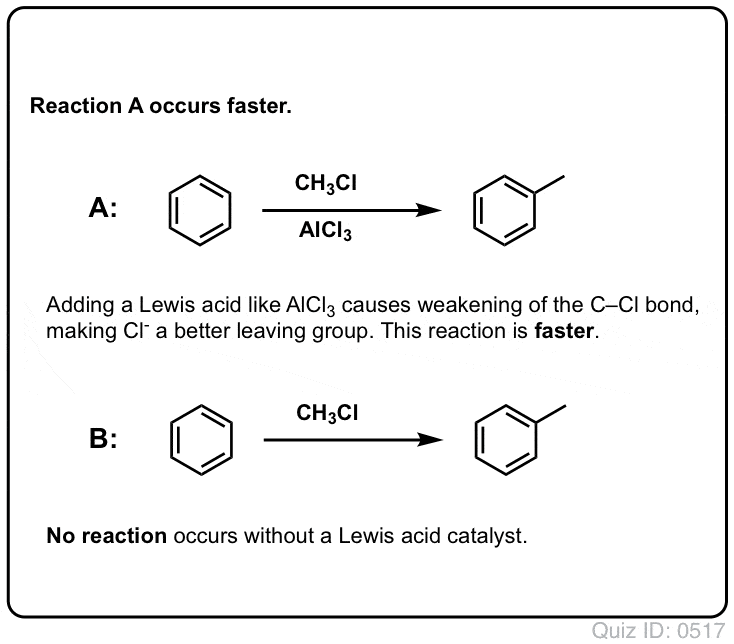
Lewishapot kiihdyttävät elektrofiilisten aromaattisten substituutioreaktioiden nopeutta
Cl2:n reaktio bentseenin kanssa on nopeampi kuin varpaankynsien kasvu, mutta ei paljoa (Se on kuitenkin paljon nopeampi elektronirikkaampien aromaattisten aineiden, kuten tolueenin ja fenolin kanssa). Sen sijaan, että istuisimme laboratoriossa viikkokausia odottamassa reaktion päättymistä, voimme siis lisätä reagenssin, joka ”keittää” Cl2:n reaktiivisuutta ja tekee siitä entistäkin paremman elektrofiilin: toisin sanoen katalyytin.
Hyvän Lewisin hapon, kuten AlCl3:n tai FeCl3:n, lisääminen tekee tempun. . päivitys: katso viesti mekanismista
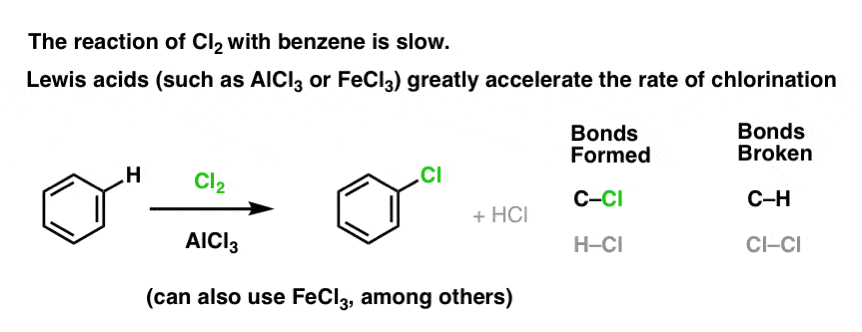
Miten tämä toimii?
Alkoholeja käsittelevästä sarjastamme muistat ehkä, että alkoholit (R-OH) voidaan houkutella osallistumaan substituutio- ja eliminaatioreaktioihin, jos niihin lisätään vahva happo ( muodostaen R-OH2+ ). Tämä johtuu siitä, että konjugaattihappo on aina parempi poistuva ryhmä ; H2O on heikompi emäs ja siten paljon parempi poistuva ryhmä kuin HO- . Etanoli itsessään ei koskaan reagoi NaCl:n kanssa muodostaen etyylikloridia, koska syntyvä poistuva ryhmä HO- on liian vahva emäs suhteessa Cl-:iin, jotta reaktio etenisi missään määrin. Mutta jos muutamme alkoholin sen konjugaattihapoksi R-OH2 + vahvalla hapolla, kuten HCl:llä, reaktio voi silloin edetä, koska Cl- syrjäyttää paljon heikomman emäksen H2O:n.
Voi olla hyödyllistä ajatella, että H+ heikentää C-O-sidosta ja tekee siten siihen kiinnittyneestä hiilestä paremman elektrofiilin.
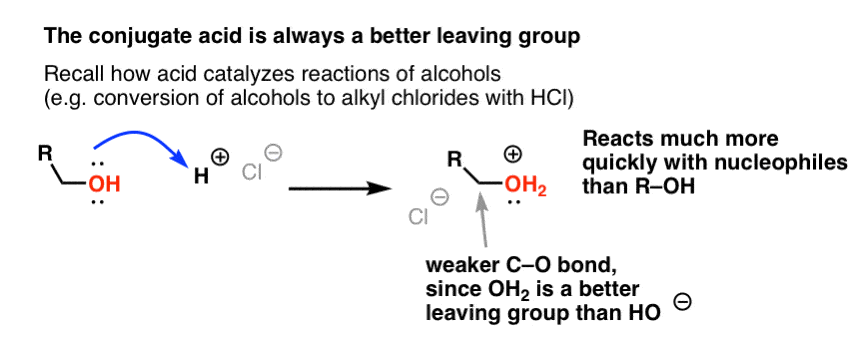
Aivan kuten happo ”pohjustaa” OH-ryhmään kiinnittyneen hiilen myöhempää reaktiota varten muuttamalla hydroksyyliryhmän sen konjugaattihapoksi, Lewis-hapot tekevät vastaavalla tavalla saman taikatempun Cl2:n suhteen (ja muuten kaikkiin käsittelemiimme elektrofiilisiin aromaattisiin substituutioreaktioihin liittyy jonkinlainen happokatalyysi).
Klooriutumisen tapauksessa Lewishappo (AlCl3, alla) ottaa elektroniparin Cl2:sta. Tämä heikentää Cl-Cl-sidosta, mikä tekee siitä entistäkin paremman nukleofiilin. Nukleofiilin hyökkäys distaaliseen Cl:ään ei vapauta Cl-:tä, vaan vielä heikomman emäksen (ja siten paremman poistuvan ryhmän) AlCl4(-).
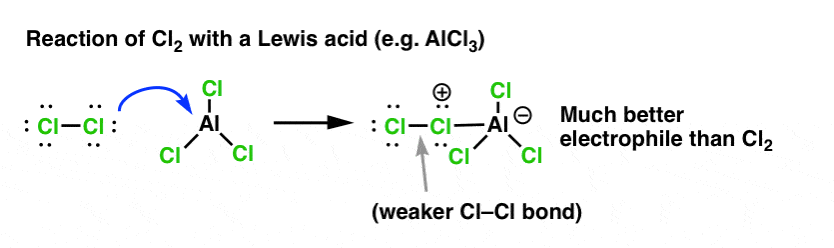
Lewishapon (johon, muistutettakoon, kuuluvat myös Brønsted-hapot, kuten H2SO4 ) lisääminen on yhteinen säie kuudessa tärkeimmässä tärkeimmässä elektrofiilisessä aromaattisessa substituutiossa, jotka yleensä käsitellään orgaanisen kemian johdantokurssilla.
Kuuden tärkeän elektrofiilisen aromaattisen substituutioreaktion keskeinen malli
Tässä jaksossa esittelemme nämä kuusi keskeistä elektrofiilistä aromaattista substituutioreaktiota, jotka ryhmittyvät kauniisti kolmeen pariin:
- klooraus ja bromaus
- nitraatio ja sulfonylointi
- Friedel-Crafts-alkylointi ja Friedel-Crafts-asylointi
Mekanismeihin emme vielä paneudu. Tarkoitus on vain seurata, mitä sidoksia muodostuu ja katkeaa, jotta näet keskeisen kaavan.
Tässä se on:
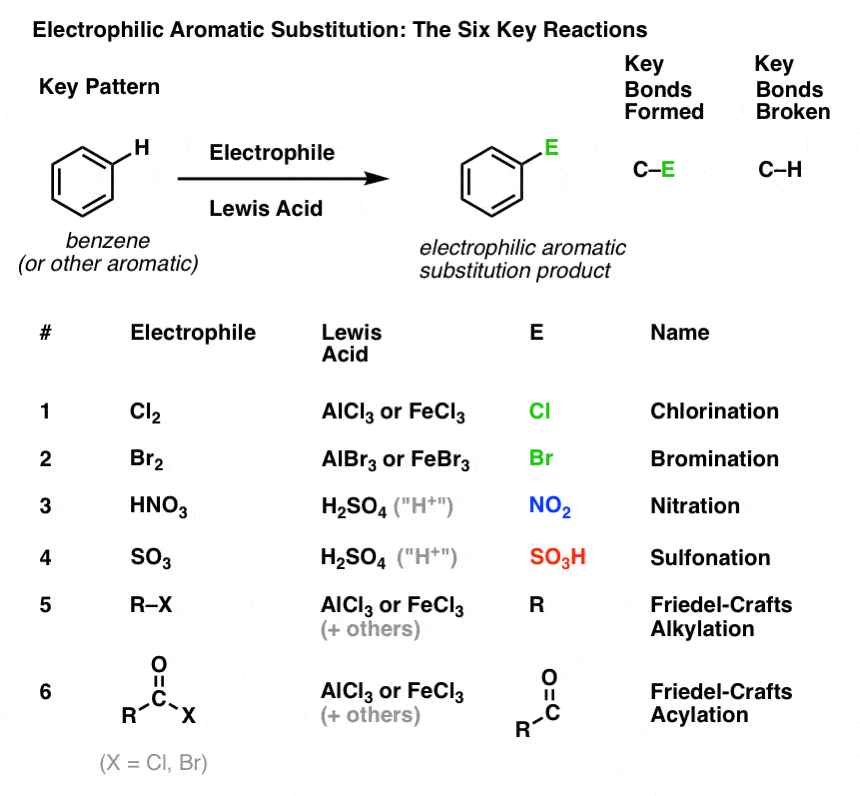
Aromaattisten molekyylien klorinoituminen ja brominoituminen
Olemme nähneet klorinoitumisen (yllä); brominoituminen on hyvin samanlainen. Koska Br2 itsessään ei ole riittävän vahva elektrofiili reagoidakseen bentseenin kanssa kohtuullisella nopeudella, käytämme Lewisin happoa, kuten AlBr3 tai FeBr3, nopeuttamaan reaktiota. .
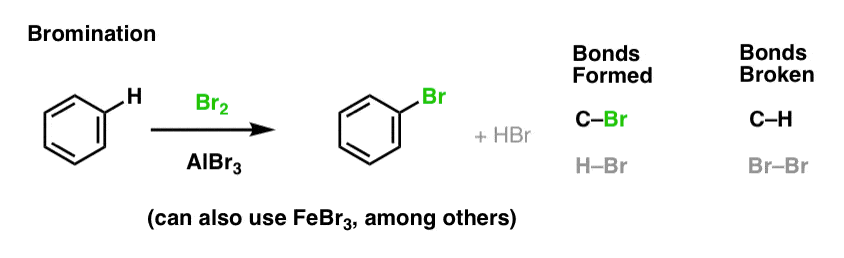
Aromaattisten molekyylien nitraatio ja sulfonointi
Nitraatio (H:n korvaaminen NO2-ryhmällä) ei ole reaktio, jota näimme alkeeneita käsittelevässä jaksossamme, mutta se on suosittu reaktio aromaattisten molekyylien kuten bentseenin kanssa. Tässä reaktiossa metyylibentseeni (tolueeni) muuttuu 2,4,6-trinitrotolueeniksi. Tunnet tämän molekyylin todennäköisesti paremmin räjähdysherkkänä TNT:nä.
Nitraatio on H:n korvaaminen NO2:lla käyttäen typpihappoa (HNO3) NO2:n lähteenä ja rikkihappoa (H2SO4) Lewis-happona:
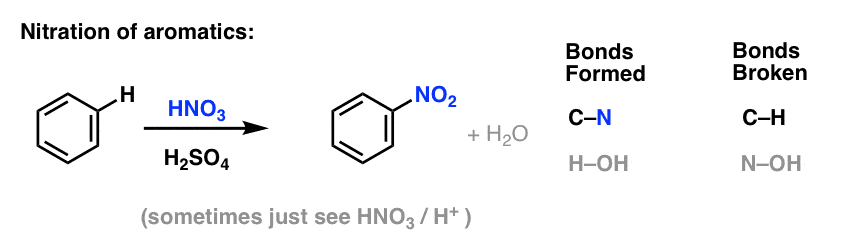
Sulfonaatio (H:n korvaaminen SO3H-ryhmällä) osoittautuu myös hyödylliseksi reaktioksi. Se voidaan suorittaa lisäämällä rikkitrioksidia (SO3) Lewis-happona toimivan rikkihapon (H2SO4) läsnäollessa:
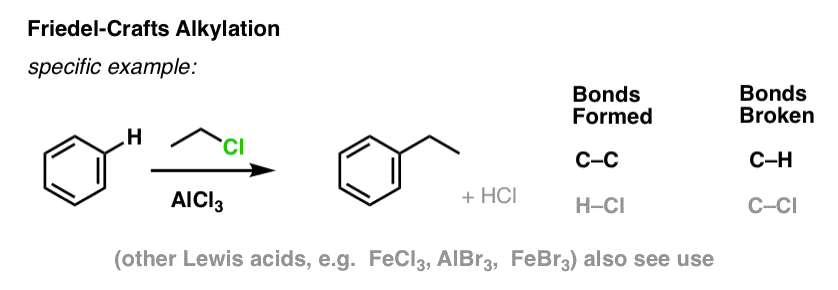
Friedel-Crafts-alkylaatio ja asylaatio
Edellä mainituissa neljässä reaktiossa havaittiin C-Cl:n, C-Br:n, C-N:n ja C-S:n muodostumista.
Aromaattisiin molekyyleihin on myös mahdollista muodostaa hiili-hiilisidoksia lisäämällä alkyyli- tai asyylihalogenideja Lewisin happojen läsnä ollessa. Näitä reaktioita kutsutaan keksijänsä mukaan Friedel-Crafts-reaktioiksi (reaktio on peräisin vuodelta 1877).
Friedel-Crafts-alkylaatiossa aloitetaan alkyylihalogenidilla ”R-X”, kuten CH3CH2Cl, ja lisätään sitten Lewis-happo, kuten AlCl3 tai FeCl3 . Kuten Cl2:n tapauksessa, Lewishappo nopeuttaa reaktiota koordinoimalla halogeenin kanssa, heikentämällä C-Cl-sidosta ja tekemällä siitä paremman poistuvan ryhmän, jolloin nukleofiilit voivat helpommin hyökätä siihen kiinnittyneeseen hiileen. Mitään reaktiota ei tapahdu ilman Lewishappoa.
Huomaa, että tässä muodostamme C-C:n ja katkaisemme C-H:n.
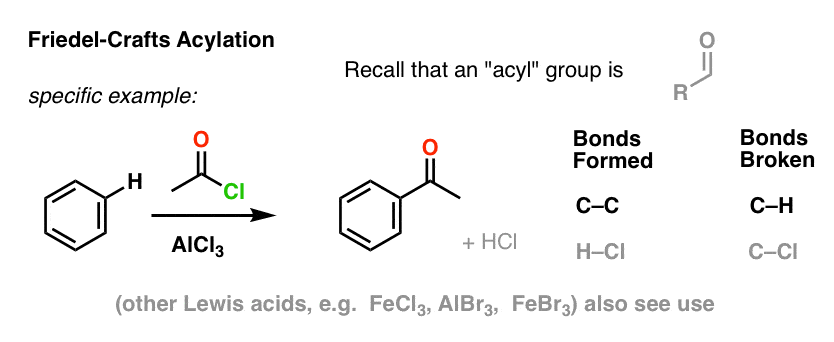
Friedel-Crafts-asylaatio on samanlainen, mutta aloitamme asyylihalogenidilla. Lewis-happomme lisääminen johtaa C-C:n muodostumiseen ja C-H:n katkeamiseen.
Yhteenveto: Kuusi keskeistä elektrofiilistä aromaattista substituutioreaktiota
Olemme esitelleet kuusi keskeistä elektrofiilistä aromaattista substituutioreaktiota (klooraus, bromaus, nitraus, sulfonylaatio sekä Friedel-Craftsin alkylaatio ja asylaatio) ja sen, että niihin kaikkiin liittyy C-H:n katkeaminen ja C-E:n muodostuminen (jossa ”E” on kyseessä oleva elektrofiili).
Mutta muodostuvien ja katkeavien sidosten tunteminen on vasta alkua.
Tässä on muutamia kysymyksiä, joihin haluaisimme tietää vastauksen:
- Miten bentseenin substituentit vaikuttavat tähän reaktioon? Miten nämä reaktiot vaikuttaisivat esimerkiksi, jos suorittaisimme ne metyylibentseenillä, fenolilla tai klooribentseenillä?
- Miten elektronia luovuttavat tai elektronia vetävät substituentit vaikuttavat reaktion nopeuteen?
- Bentseenillä voi mahdollisesti muodostua vain yksi monosubstituoitu tuote. Mutta entä jos lähdetään liikkeelle monosubstituoidusta tuotteesta ja tehdään sille elektrofiilinen aromaattinen substituutio? Mihin substituentit päätyvät?
- Miten reaktio toimii? Miten selitämme C-E:n muodostumisen ja C-H:n katkeamisen?
- Miten muut aromaattiset ryhmät (kuin bentseeni). Miten elektrofiiliset aromaattiset substituutioreaktiot pyrrolilla, pyridiinillä, naftaleenilla tai muilla ryhmillä vertautuvat?
Seuraavassa postauksessa käsittelemme ensimmäistä kysymystä: elektronia luovuttavien ja elektronia vetävien substituenttien vaikutusta. Puhumme aktivoivista ja deaktivoivista ryhmistä.
Seuraava viesti: Aktivoivat ja deaktivoivat ryhmät
Kiitos lukemisesta!
Monet kiitokset Matthew Knowelle avusta tämän postauksen tekemisessä.
Quiz Yourself!
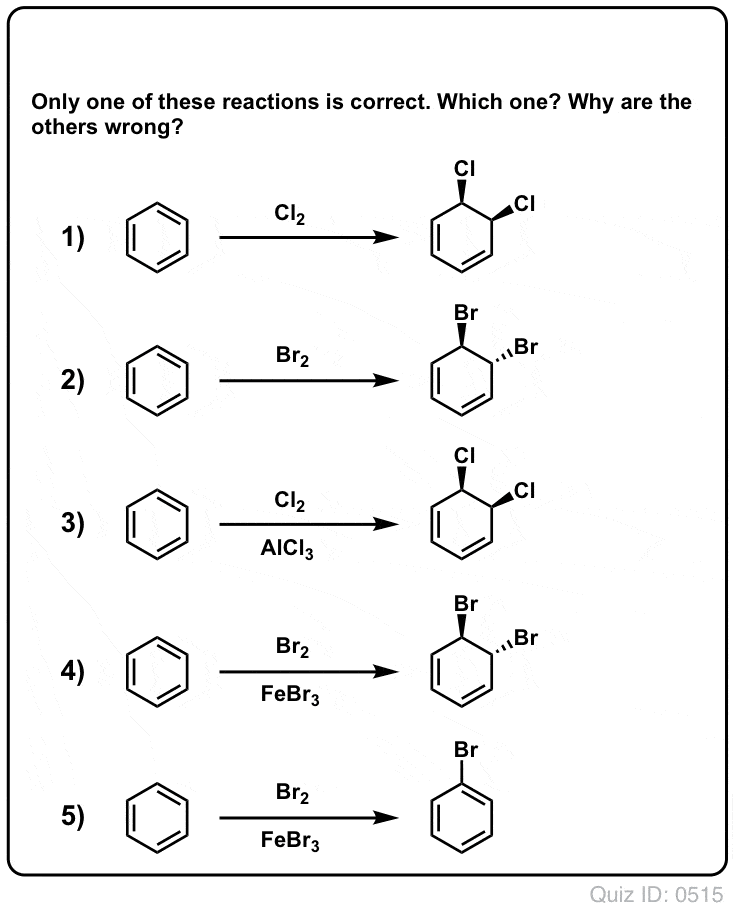 Click to Flip
Click to Flip 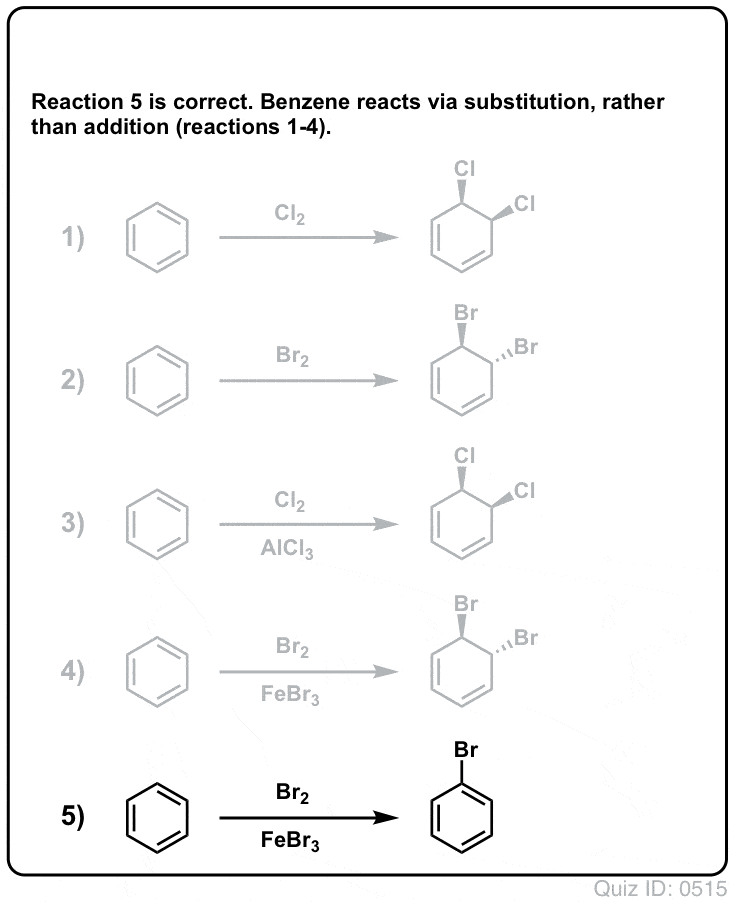
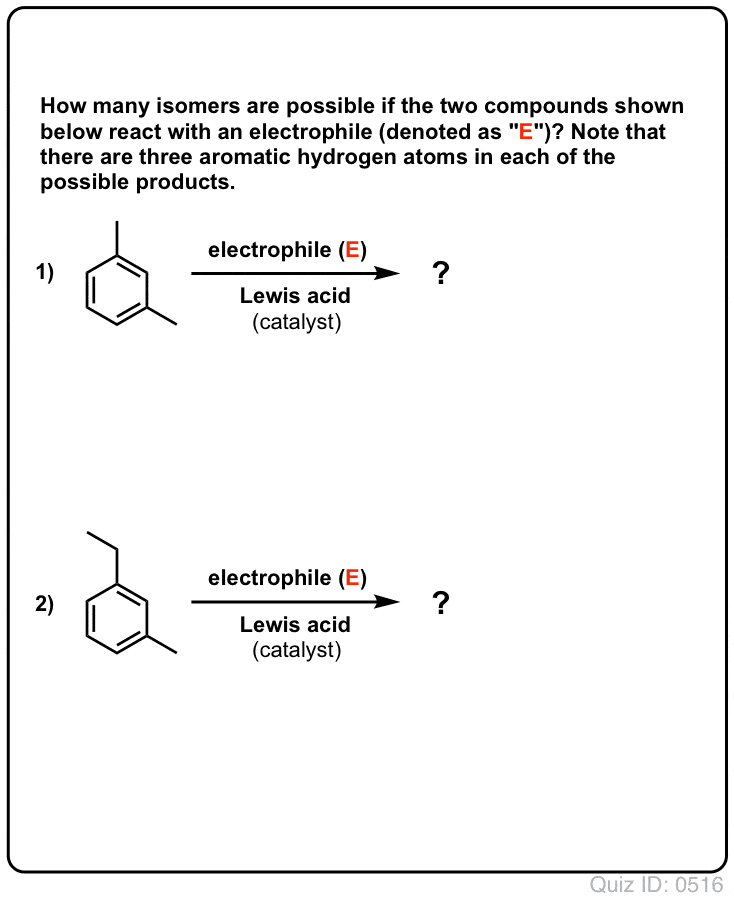 Click to Flip
Click to Flip 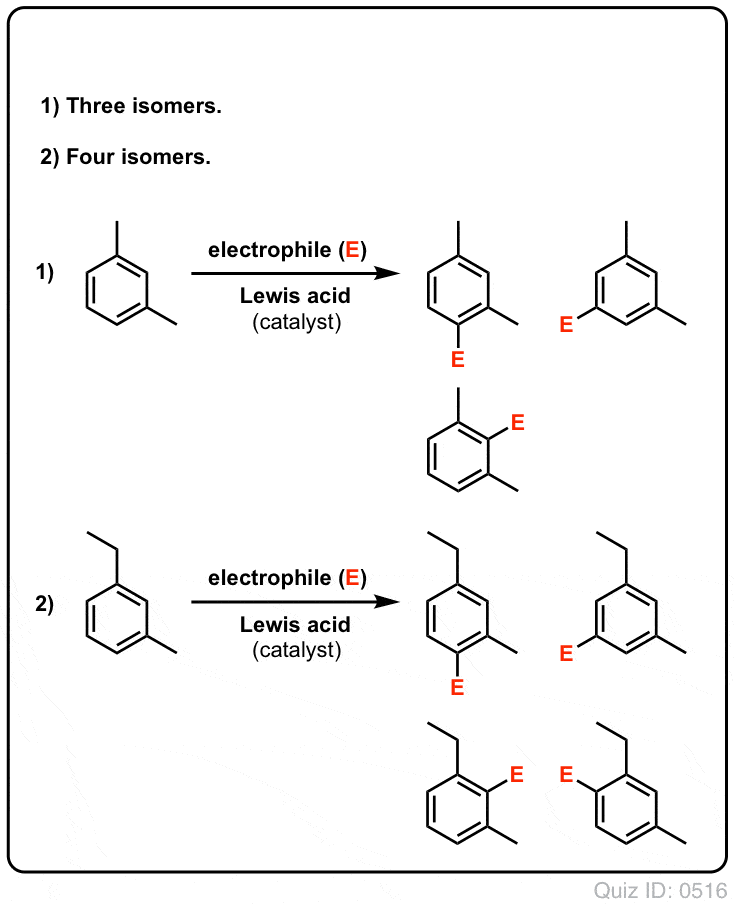
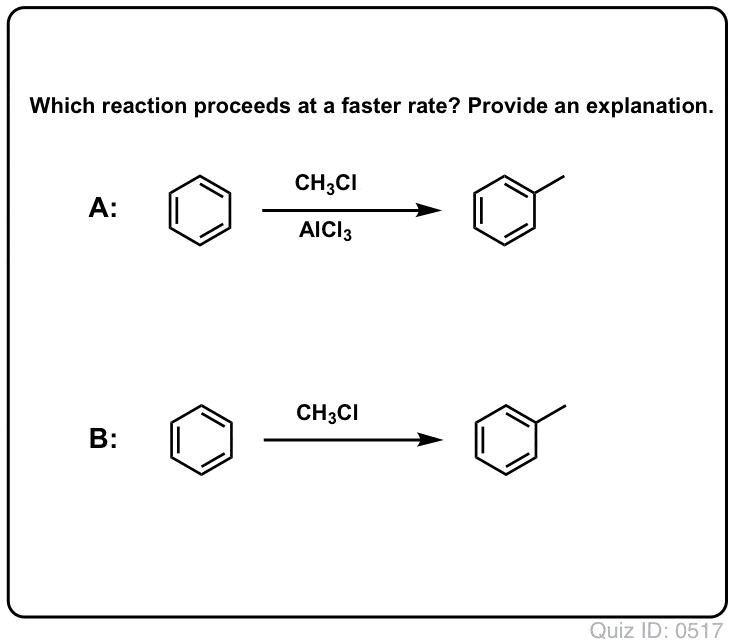 Click to Flip
Click to Flip