The Six Key Electrophilic Aromatic Substitution Reactions
Kluczową reakcją związków aromatycznych jest elektrofilowe podstawienie aromatyczne, w którym wiązanie C-H jest zerwane i powstaje nowe wiązanie C-E (E jest atomem elektrofilowym, takim jak Cl, Br, N…).
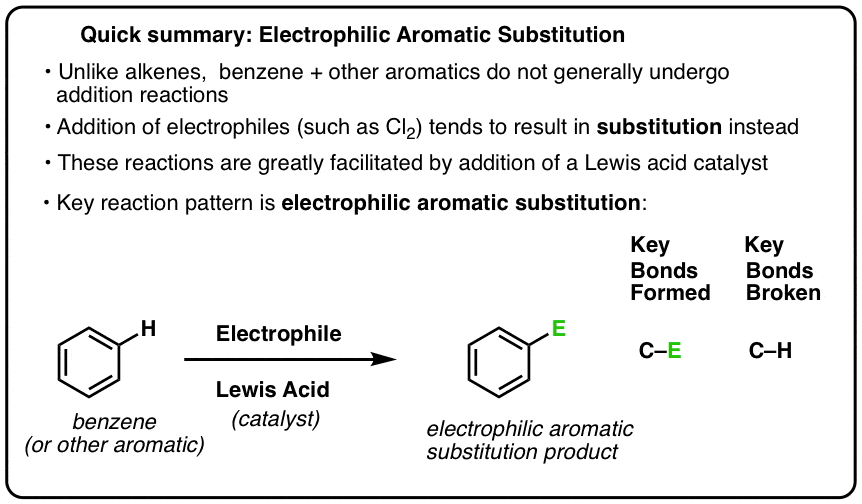
Table of Contents
- Alkeny dają produkty „addycji” w reakcji z elektrofilami. So How Does Benzene Compare?
- Elektrofilowa Substytucja Aromatyczna
- Kwasy Lewisa Przyspieszają Tempo Reakcji Elektrofilowej Substytucji Aromatycznej
- Kluczowy Wzór Dla Sześciu Ważnych Reakcji Elektrofilowej Substytucji Aromatycznej
- Aromatyczne Chlorowanie I Bromowanie
- Aromatyczne Nitrowanie I Sulfonowanie
- Friedel-Crafts Alkilowanie i Acylowanie
- Podsumowanie: Sześć kluczowych reakcji elektrofilowej substytucji aromatycznej
- Zadaj sobie pytanie!
- Alkeny dają produkty „addycji” w reakcji z elektrofilami. So How Does Benzene Compare?
- Elektrofilowa substytucja aromatyczna
- Kwasy Lewisa Przyspieszają Szybkość Reakcji Elektrofilowej Substytucji Aromatycznej
- Kluczowy wzór dla sześciu ważnych reakcji elektrofilowej substytucji aromatycznej
- Chlorowanie i bromowanie cząsteczek aromatycznych
- Nitracja i Sulfonowanie Cząsteczek Aromatycznych
- Alkilowanie i acylowanie metodą Friedela-Craftsa
- Podsumowanie: Sześć kluczowych reakcji elektrofilowej substytucji aromatycznej
- Quiz Yourself!
Alkeny dają produkty „addycji” w reakcji z elektrofilami. So How Does Benzene Compare?
Kiedy jakiś czas temu zajmowaliśmy się reakcjami alkenów – wieloma reakcjami! – zobaczyliśmy, że zdecydowana większość z nich należy do klasy reakcji, które nazywamy reakcjami addycji. Reakcje te polegają na zerwaniu (stosunkowo słabego) wiązania C-C (pi) i utworzeniu dwóch nowych wiązań pojedynczych z węglem. Chlorowanie alkenów za pomocą Cl2 jest klasycznym przykładem:
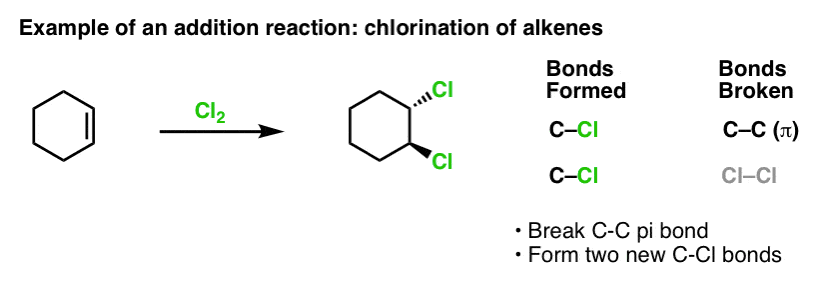
Skoro jesteśmy przy temacie benzenu, to naturalne jest zastanawianie się, jak dobrze wiązania pi w układach aromatycznych (jak benzen) wypadają pod względem reaktywności w porównaniu z wiązaniami pi w alkenach, a co za tym idzie, jak reakcje związków aromatycznych wypadają w porównaniu z reakcjami alkenów.
Widzieliśmy, że benzen ma niezwykłą stabilność (36 kcal/mol energii rezonansu) w stosunku do tego, czego spodziewalibyśmy się po teoretycznym „cykloheksatrienie”, co z pewnością doprowadziłoby nas do przewidywania, że wiązania pi w cząsteczkach aromatycznych będą mniej reaktywne, w stosunku do alkenów.
Można również przypomnieć, że sam benzen jest niezwykle trudny do uwodornienia. Wodór (H2) może być wykonane, aby dodać w poprzek większości alkenów w obecności katalitycznej ilości drobno podzielonego palladu na węglu (Pd / C), ale naprawdę trzeba wyłamać puszkę Aldrich Brand Whup-Ass ® (tj. wysokie temperatury, wysokie ciśnienia H2, wydłużony czas reakcji), aby z powodzeniem dodać H2 do benzenu, w stosunku do „typowych” alkenów.
Wiedząc to, jak moglibyśmy oczekiwać, że elektrofile takie jak Cl2 lub Br2 będą reagować ze związkami aromatycznymi takimi jak benzen?
Elektrofilowa substytucja aromatyczna
Pierwszym naszym przypuszczeniem może być to, że benzen reaguje z Cl2 dając produkt „addycji” jak ten pokazany poniżej (aczkolwiek wolniej niż w przypadku „normalnego” alkenu):
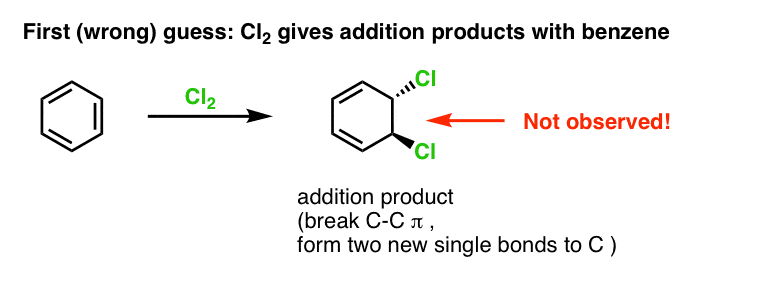
To nie jest produkt, który obserwujemy!
Zamiast tego, jeśli potraktujemy benzen Cl2, otrzymamy w końcu (i bardzo powoli) następujący produkt: chlorobenzen.
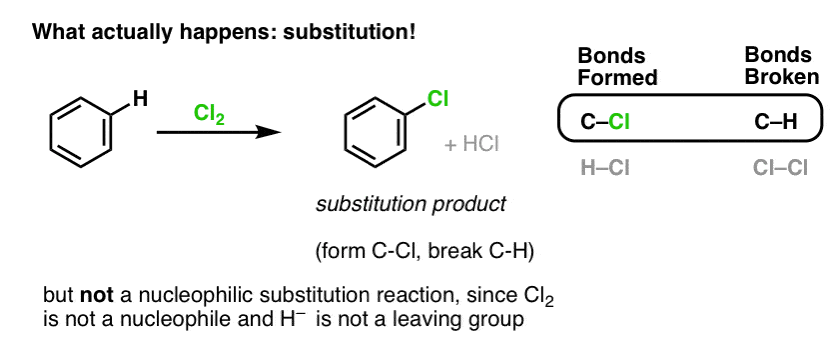
Jakie wiązania powstały i jakie wiązania uległy rozerwaniu w tej reakcji?
Utworzyliśmy C-Cl i rozerwaliśmy C-H . Ponieważ wszystkie wiązania pi są nienaruszone, nie jest to reakcja addycji. Zamiast tego jest to zatem typ reakcji substytucji, w której tworzymy i zrywamy wiązanie na jednym węglu.
Wcześniej widzieliśmy przykład reakcji substytucji, ale były to substytucje nukleofilowe, w których nukleofil (np. RS- ) jest dodawany do elektrofilu halogenku alkilu (np. R-Br), wypierając grupę opuszczającą (tu Br-) tworząc wiązanie C-Nuc (w tym przypadku C-S) i zrywając wiązanie C-LG (tu C-Br).
Czy zatem reakcja Cl2 z benzenem jest podobnie reakcją podstawienia nukleofilowego? Nie!
Cl2 jest bardzo słabym nukleofilem, reagującym jako elektronodonor tylko z silnymi kwasami Lewisa (np. AlCl3, poniżej). W połączeniu z nawet stosunkowo łagodnym nukleofilem, takim jak wiązanie pi w alkanie, zachowuje się jak elektrofil (akceptor elektronów), jak widzieliśmy w jego reakcji z alkenami.
Reakcja Cl2 z benzenem jest więc nazywana elektrofilową substytucją aromatyczną (w skrócie EAS):
- Elektrofilowe, bo dodajemy gatunek ubogi w elektrony (elektrofil),
- do związku aromatycznego (benzenu);
- substytucja, bo odrywamy C-H i tworzymy C-E, gdzie E to nasz elektrofil (w tym przypadku Cl).
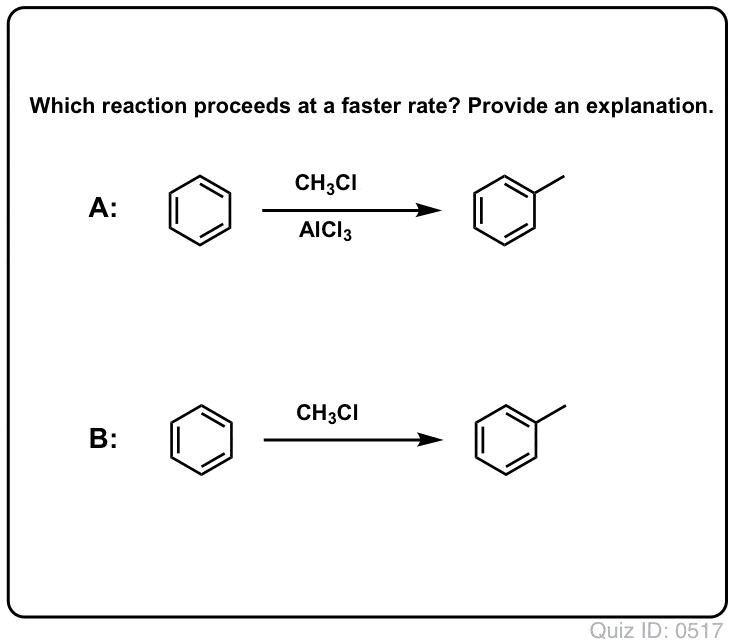
Kwasy Lewisa Przyspieszają Szybkość Reakcji Elektrofilowej Substytucji Aromatycznej
Reakcja Cl2 z benzenem jest szybsza niż wzrost paznokci, ale nie o wiele (jest jednak znacznie szybsza z bardziej bogatymi w elektrony aromatami, takimi jak toluen i fenol). Zamiast więc siedzieć w laboratorium tygodniami, czekając na zakończenie reakcji, możemy dodać odczynnik, który „podkręci” reaktywność Cl2 i uczyni go jeszcze lepszym elektropolem: innymi słowy, katalizatorem.
Dodanie dobrego kwasu Lewisa, takiego jak AlCl3 lub FeCl3, załatwia sprawę. . aktualizacja: zobacz post o mechanizmie
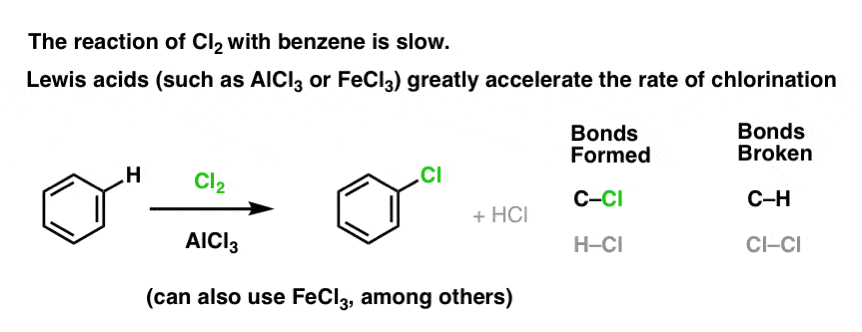
Jak to działa?
Z naszej serii o alkoholach możesz sobie przypomnieć, że alkohole (R-OH) można nakłonić do udziału w reakcjach substytucji i eliminacji, jeśli doda się silny kwas (tworząc R-OH2+ ). Dzieje się tak dlatego, że sprzężony kwas jest zawsze lepszą grupą opuszczającą; H2O jest słabszą zasadą, a więc znacznie lepszą grupą opuszczającą, niż HO- . Sam etanol nigdy nie zareaguje z NaCl, dając chlorek etylu, ponieważ powstająca grupa opuszczająca HO- jest zbyt silną zasadą w stosunku do Cl-, aby reakcja mogła przebiegać w jakimkolwiek stopniu. Ale jeśli przekształcimy alkohol w jego sprzężony kwas R-OH2 + za pomocą silnego kwasu, takiego jak HCl, reakcja może wtedy przebiegać, ponieważ Cl- wypiera znacznie słabszą zasadę H2O.
Pomocne może być myślenie o H+ jako osłabiającym wiązanie C-O, a tym samym czyniącym węgiel z nim związany lepszym elektropolem.
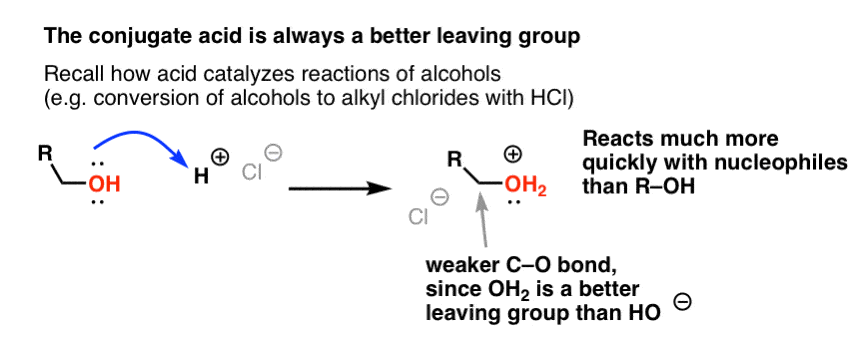
Tak jak kwas „przygotowuje” węgiel przyłączony do grupy OH do następnej reakcji poprzez przekształcenie grupy hydroksylowej w jej sprzężony kwas, kwasy Lewisa podobnie działają tę samą magię na Cl2 (i dla tej sprawy, wszystkie reakcje elektrofilowego podstawienia aromatycznego, które będziemy omawiać, będą obejmować pewien rodzaj katalizy kwasowej).
W przypadku chlorowania, kwas Lewisa (AlCl3, poniżej) przyjmuje parę elektronów od Cl2. Osłabia to wiązanie Cl-Cl, czyniąc z niego jeszcze lepszego nukleofila. Atak nukleofila na dystalny Cl spowoduje uwolnienie nie Cl- , ale jeszcze słabszej zasady (a więc lepszej grupy opuszczającej) AlCl4(-).
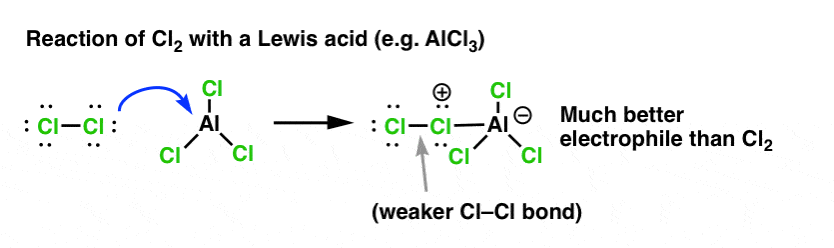
Dodanie kwasu Lewisa (który, przypomnijmy, obejmuje kwasy Brønsteda, takie jak H2SO4 ) jest wspólnym wątkiem w sześciu kluczowych elektrofilowych podstawieniach aromatycznych, które są generalnie omawiane we wprowadzeniu do chemii organicznej.
Kluczowy wzór dla sześciu ważnych reakcji elektrofilowej substytucji aromatycznej
W tym rozdziale przedstawimy sześć kluczowych reakcji elektrofilowej substytucji aromatycznej, które zgrupowane są w trzy pary:
- chlorowanie i bromowanie
- nitrowanie i sulfonylowanie
- alkilowanie Friedela-Craftsa i acylowanie Friedela-Craftsa
Nie będziemy się jeszcze zagłębiać w mechanizmy. Chodzi tylko o to, aby śledzić, jakie wiązania tworzą się i rozpadają, aby zobaczyć kluczowy wzór.
Oto on:
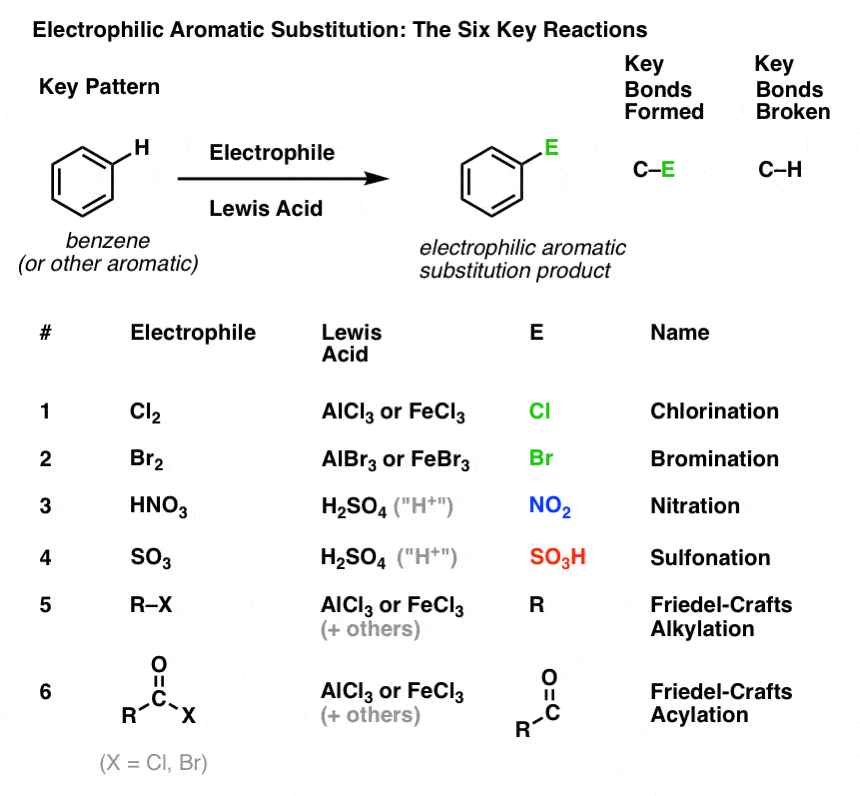
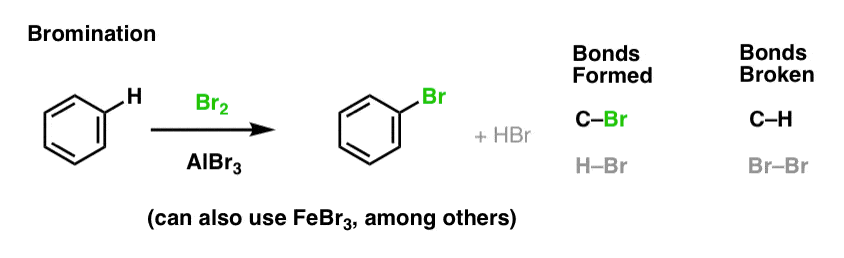
Chlorowanie i bromowanie cząsteczek aromatycznych
Widzieliśmy już chlorowanie (powyżej); bromowanie jest bardzo podobne. Ponieważ Br2 sam w sobie nie jest wystarczająco silnym elektropolem, aby reagować z benzenem z rozsądną szybkością, używamy kwasu Lewisa, takiego jak AlBr3 lub FeBr3, aby przyspieszyć reakcję. .
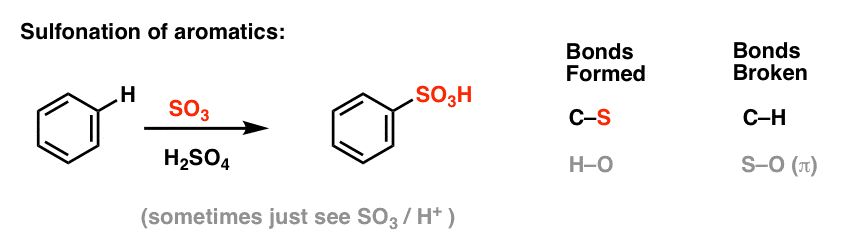
Nitracja i Sulfonowanie Cząsteczek Aromatycznych
Nitracja (zastąpienie H grupą NO2) nie jest reakcją, którą widzieliśmy w naszej sekcji dotyczącej alkenów, ale jest to popularna reakcja z cząsteczkami aromatycznymi, takimi jak benzen. Jest to reakcja, w której metylobenzen (toluen) jest przekształcany w 2,4,6-trinitrotoluen. Prawdopodobnie jesteś bardziej zaznajomiony z tą cząsteczką jako silnym materiałem wybuchowym TNT.
Nitracja jest zastąpieniem H przez NO2, przy użyciu kwasu azotowego (HNO3) jako źródła NO2 i kwasu siarkowego (H2SO4) jako kwasu Lewisa:
Sulfonowanie (zastąpienie H grupą SO3H) również okazuje się być użyteczną reakcją. Można ją przeprowadzić dodając trójtlenek siarki (SO3) w obecności kwasu siarkowego (H2SO4) jako kwasu Lewisa:
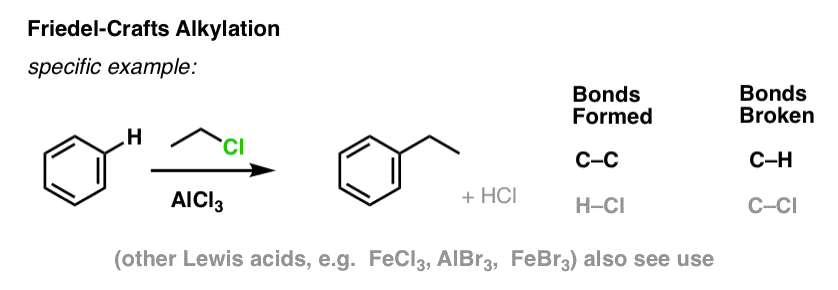
Alkilowanie i acylowanie metodą Friedela-Craftsa
W czterech powyższych reakcjach obserwowaliśmy powstawanie C-Cl, C-Br, C-N i C-S.
Możliwe jest również tworzenie wiązań węgiel-węgiel do cząsteczek aromatycznych poprzez dodanie halogenków alkilowych lub acylowych w obecności kwasów Lewisa. Reakcje te znane są jako reakcje Friedela-Craftsa, od nazwiska ich wynalazców (reakcja pochodzi z 1877 r.).
W alkilacji Friedela-Craftsa zaczynamy od halogenku alkilowego „R-X”, takiego jak CH3CH2Cl, a następnie dodajemy kwas Lewisa, taki jak AlCl3 lub FeCl3 . Podobnie jak w przypadku Cl2, kwas Lewisa przyspiesza reakcję, koordynując się z halogenem, osłabiając wiązanie C-Cl i sprawiając, że staje się on lepszą grupą opuszczającą, co pozwala na łatwiejsze atakowanie przyłączonego węgla przez nukleofile. Bez kwasu Lewisa nie zachodzi żadna reakcja.
Zauważ, że tutaj tworzymy C-C i zrywamy C-H.
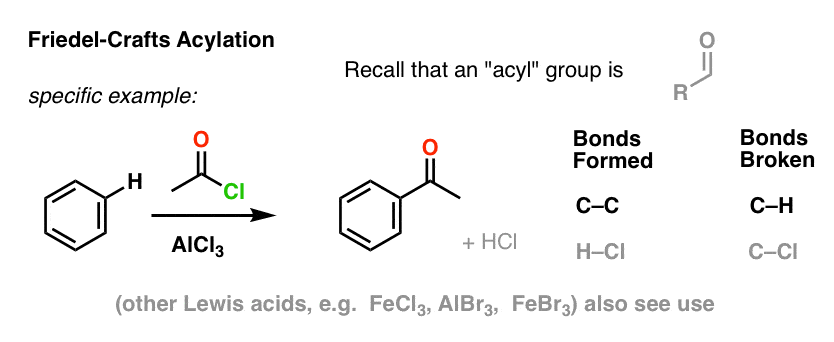
Acylowanie Friedela-Craftsa jest podobne, ale zaczynamy od halogenku acylowego. Dodanie naszego kwasu Lewisa powoduje powstanie C-C i rozerwanie C-H.
Podsumowanie: Sześć kluczowych reakcji elektrofilowej substytucji aromatycznej
Przedstawiliśmy sześć kluczowych reakcji elektrofilowej substytucji aromatycznej (chlorowanie, bromowanie, nitrowanie, sulfonylowanie, alkilowanie i acylowanie Friedela-Craftsa) oraz to, że wszystkie one wiążą się z rozerwaniem C-H i utworzeniem C-E (gdzie „E” to dany elektrofil).
Ale znajomość tworzących się i rozrywających wiązań to dopiero początek.
Oto kilka pytań, na które chcielibyśmy poznać odpowiedź:
- Jak podstawniki na benzenie wpływają na tę reakcję? Na przykład, jak mogłyby wpłynąć na te reakcje, gdybyśmy przeprowadzili je z metylobenzenem? lub fenolem? lub chlorobenzenem?
- Jak podstawniki oddające lub odbierające elektrony wpływają na szybkość reakcji?
- W przypadku benzenu może powstać tylko jeden jednopodstawiony produkt. Ale co się stanie, jeśli zaczniemy od jednopodstawionego produktu i przeprowadzimy na nim elektrofilową substytucję aromatyczną? Gdzie kończą się podstawniki?
- Jak przebiega reakcja? Jak wyjaśnić powstawanie C-E i rozpad C-H ?
- Co z innymi grupami aromatycznymi (poza benzenem). Jak wypadają reakcje elektrofilowego podstawienia aromatycznego na pirolu, pirydynie, naftalenie czy innych grupach?
W następnym poście omówimy pierwsze pytanie: wpływ podstawników elektronodonujących i odbierających elektrony. Porozmawiamy o grupach aktywujących i dezaktywujących.
Next Post: Activating and Deactivating Groups
Dzięki za przeczytanie!
Wielkie podziękowania dla Matthew Knowe za pomoc w tym poście.
Quiz Yourself!
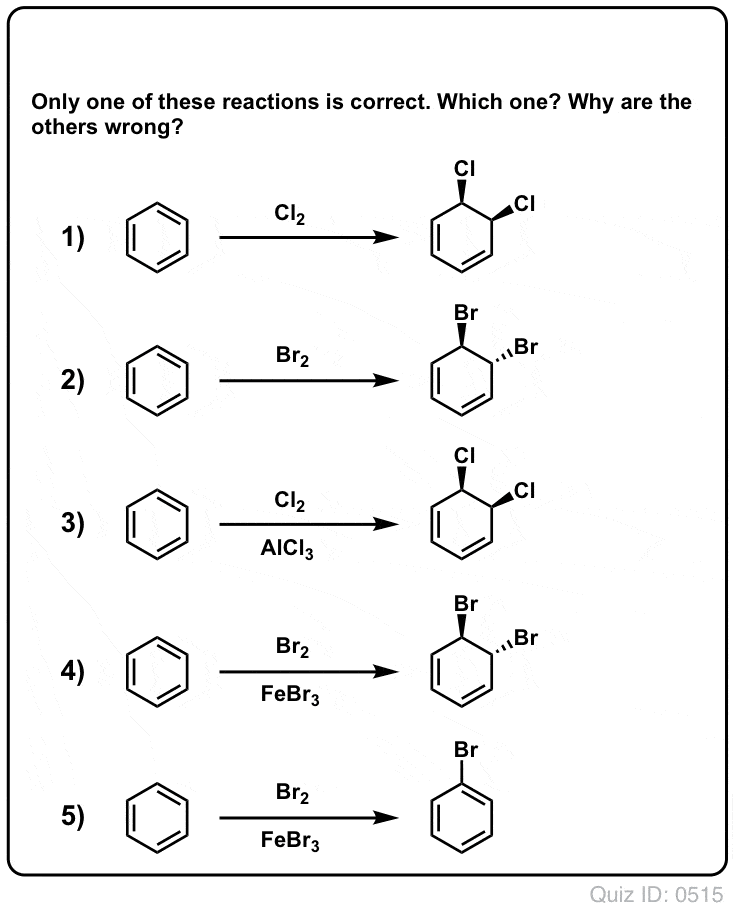 Click to Flip
Click to Flip 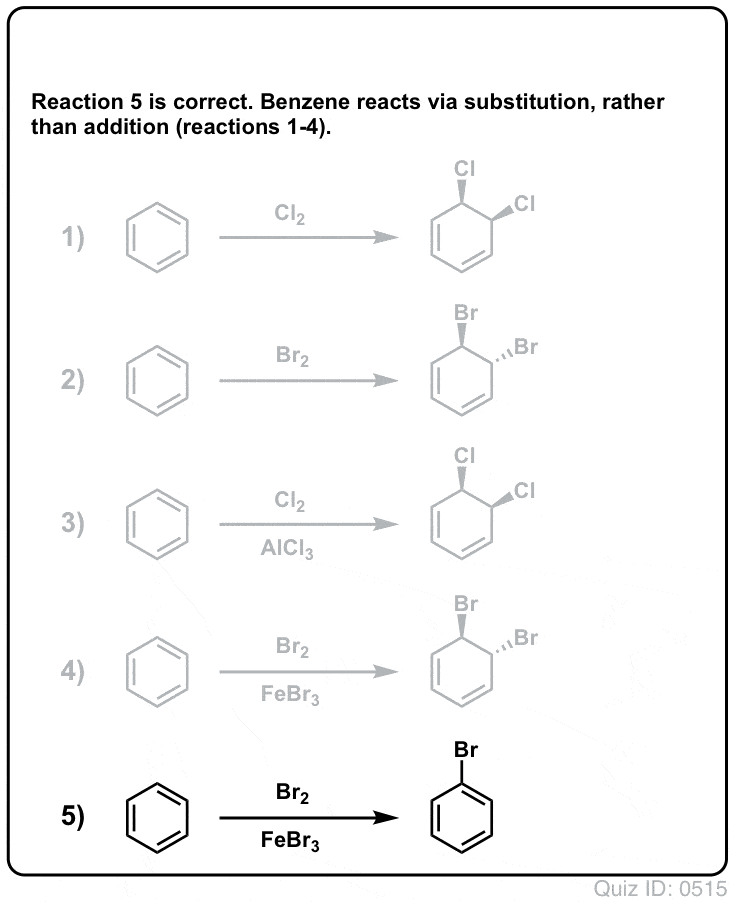 .
. 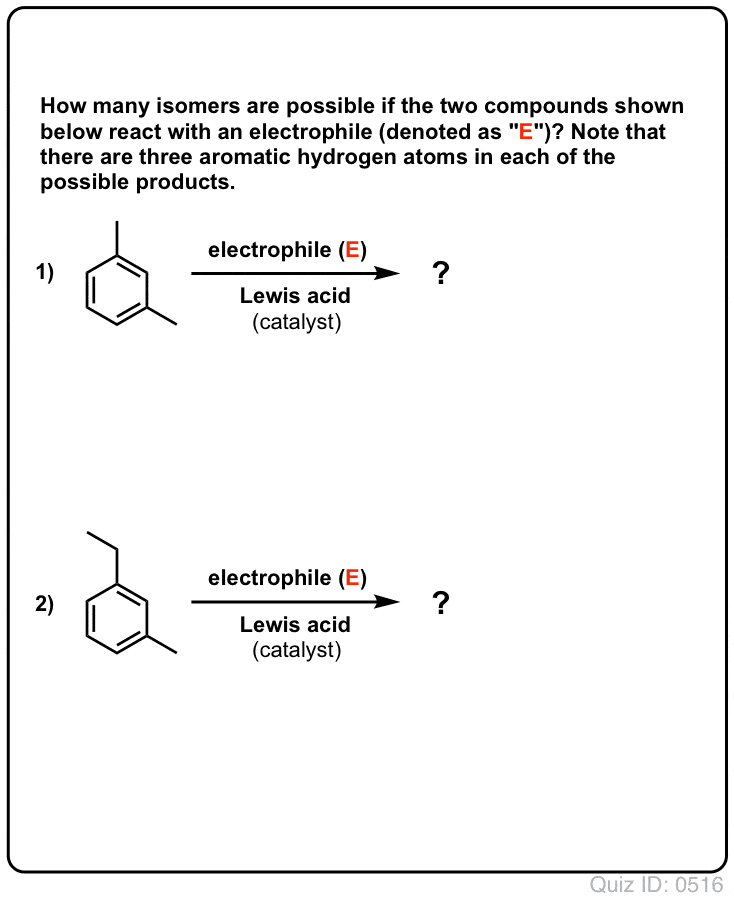 Click to Flip
Click to Flip 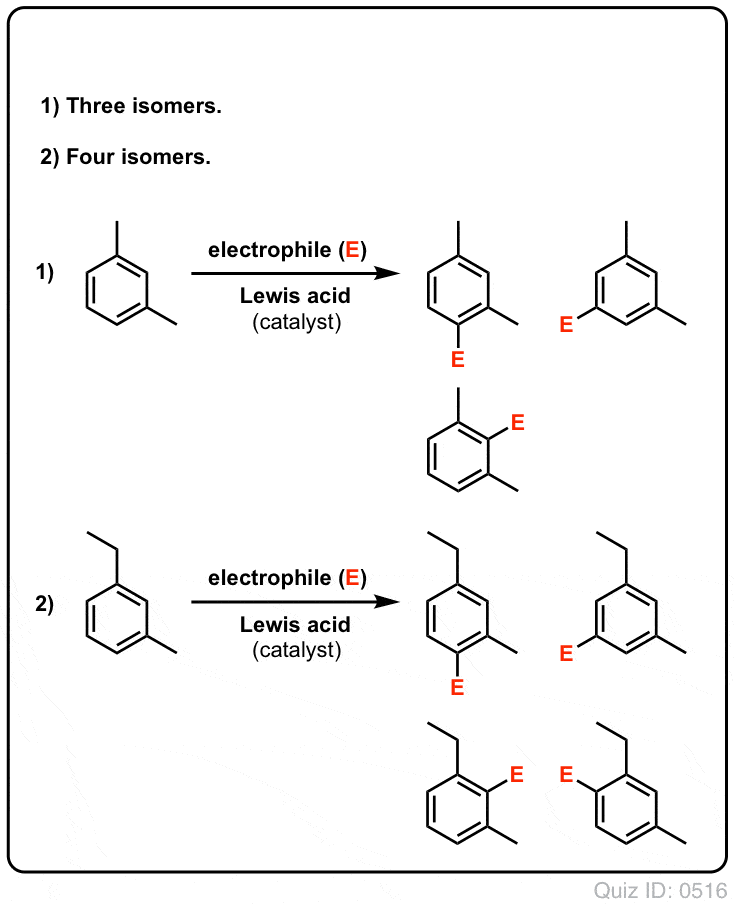
 Click to Flip
Click to Flip 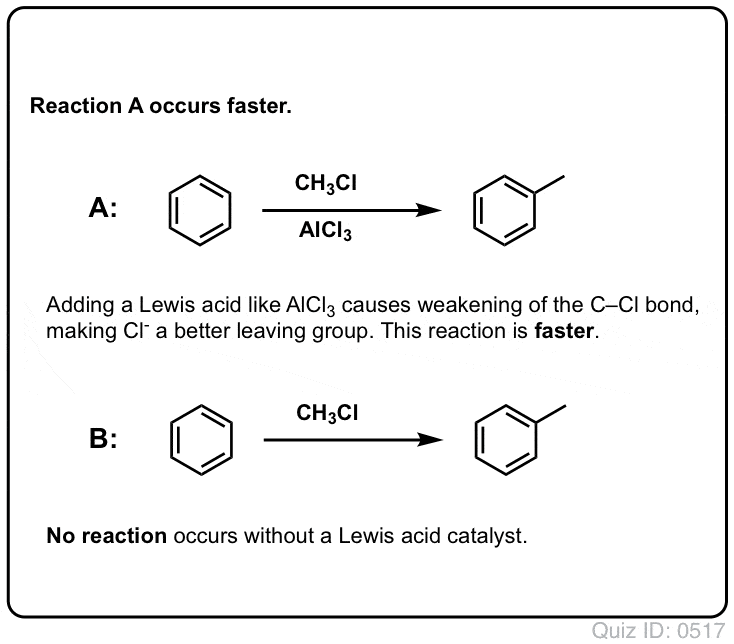
.