As Reações de Substituição Eletrofílica Aromática de Seis Chaves
Uma reação chave de compostos aromáticos é a substituição eletrofílica aromática, onde uma ligação C-H é quebrada e uma nova ligação C-E (sendo E um átomo eletrofílico como Cl, Br, N…) é formada.
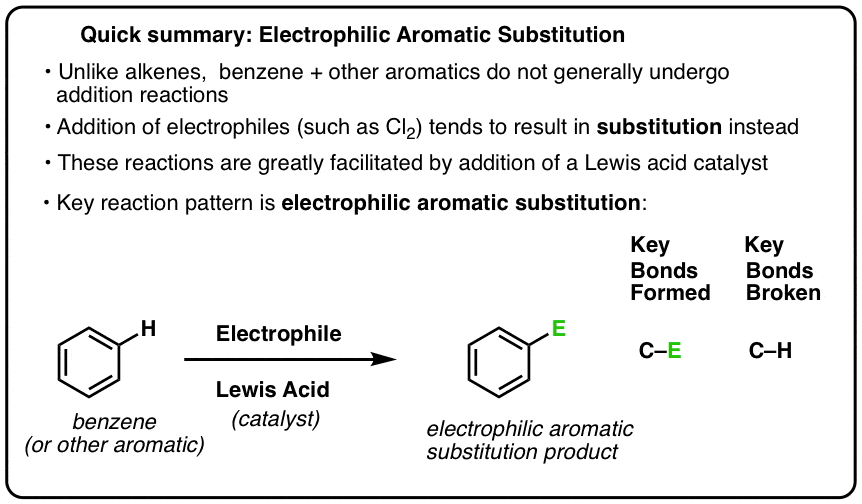
Tabela de Conteúdos
- Alkenes dão produtos “Adicionais” na Reação com Eletrofilos. Então, como o Benzeno se compara?
- Substituição Aromática Eletrofílica
- Lewis Ac Aciderate The Rate of Electrophilic Aromatic Substitution Reactions
- The Key Pattern For Six Important Electrophilic Aromatic Substitution Reactions
- Aromatic Chlorination and Bromination
- Aromatic Nitration and Sulfonation
- Friedel-Alquilação e Acilação dos Ofícios
- Sumário: As Reações de Substituição Eletrofílica de Seis Chaves Aromáticas
- Quiz Yourself!
>
>
>
>
>
- Alkenes dão produtos de “adição” na reação com os eletrofiltros. Então Como o Benzeno Compara?
- Substituição Aromática Eletrofílica
- Lewis Acids Accelerate The Rate of Electrophilic Aromatic Substitution Reactions
- O Padrão Chave para Seis Reações de Substituição Eletrofílica Aromática Importantes
- Cloração e Bromação de Moléculas Aromáticas
- Nitração e Sulfonação de Moléculas Aromáticas
- Alquilação e aciloação de Friedel-Crafts
- Sumário: As Reações de Substituição Eletrofílica Aromática de Seis Chaves
- Quiz Yourself!
Alkenes dão produtos de “adição” na reação com os eletrofiltros. Então Como o Benzeno Compara?
Quando cobrimos as reacções dos alcenos há algum tempo atrás – muitas reacções! – vimos que a grande maioria caiu na classe das reacções a que chamamos reacções de adição. É aí que quebramos uma ligação (relativamente fraca) C-C (pi) e formamos duas novas ligações únicas ao carbono. A cloração de alcenos com Cl2 é um exemplo clássico:
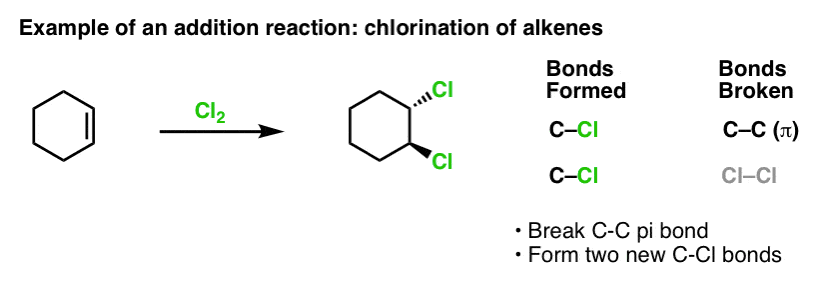
>Posto que estamos no tópico do benzeno, é natural que nos perguntemos como as ligações de pi nos sistemas aromáticos (como o benzeno) se comparam em reactividade às ligações de pi nos alcenos, e por extensão, como as reacções dos compostos aromáticos se comparam às reacções dos alcenos.
Vimos que o benzeno tem uma estabilidade incomum (36 kcal/mol de energia de ressonância) em relação ao que esperaríamos para o teórico “ciclohexatrieno”, o que certamente nos levaria a prever que as ligações de pi em moléculas aromáticas serão menos reativas, em relação aos alcenos.
Vocês também devem se lembrar que o benzeno em si é invulgarmente difícil de hidrogenar. O hidrogênio (H2) pode ser adicionado através da maioria dos alcenos na presença de uma quantidade catalítica de paládio finamente dividido no carbono (Pd/C), mas você realmente precisa quebrar a lata de Aldrich Brand Whup-Ass® (ou seja altas temperaturas, altas pressões de H2 , tempos de reação prolongados ) para adicionar H2 ao benzeno com sucesso, em relação aos alcenos “típicos”.
Sabendo isso, como podemos esperar que eletrofilos como Cl2 ou Br2 reajam com compostos aromáticos como o benzeno?
Substituição Aromática Eletrofílica
A nossa primeira suposição pode ser que o benzeno reage com Cl2 para dar um produto de “adição” como o mostrado abaixo (embora mais lentamente do que com um alceno “normal”):
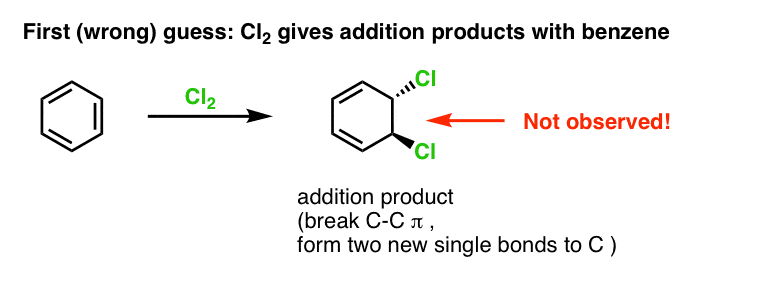
Esse não é realmente o produto que observamos!
Em vez disso, se você tratar o benzeno com Cl2 você irá eventualmente (e muito lentamente) obter o seguinte produto: clorobenzeno.
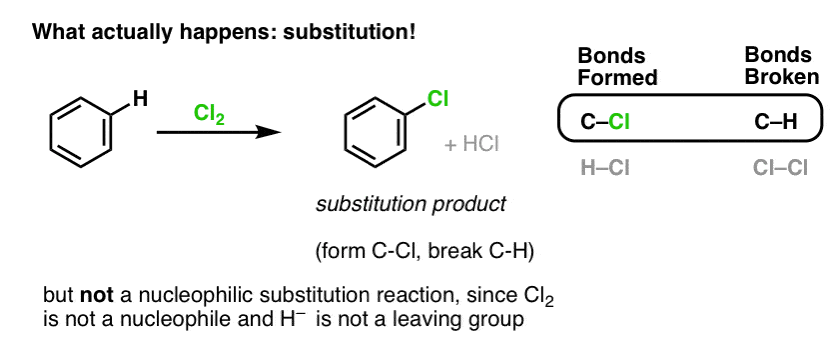
Que ligações se formaram e que ligações se quebraram nesta reação?
Formamos C-Cl e quebramos C-H . Como as ligações de pi estão todas intactas, esta não é uma reacção de adição. Em vez disso, é um tipo de reação de substituição, onde formamos e quebramos uma ligação em um único carbono.
Já vimos um exemplo de reações de substituição, mas essas foram substituições nucleofílicas, onde um nucleófilo (por exemplo RS- ) é adicionado a um eletrofilo de halogeneto de alquilo (por exemplo, R-Br), deslocando um grupo de saída (Br- aqui) formando uma ligação C-Nuc (C-S neste caso) e quebrando uma ligação C-LG (C-Br aqui).
Então a reação de Cl2 com benzeno também é uma reação de substituição nucleofílica? Não!
Cl2 é um nucleófilo extremamente pobre, reagindo como um doador de electrões apenas com ácidos Lewis fortes (e.g. AlCl3, abaixo). Quando combinado com um nucleófilo relativamente suave como o pi-bond em um alceno, comporta-se como um eletrofilo (aceitador de elétrons) como vimos em sua reação com alcenos.
A reação de Cl2 com benzeno é assim chamada uma substituição eletrofílica aromática (EAS para abreviar):
- Electrofílico, porque estamos a adicionar uma espécie pobre em electrões (electrófila),
- a um composto aromático (benzeno);
- substituição, porque estamos a quebrar C-H e a formar C-E, onde E é a nossa electrófila (Cl neste caso).
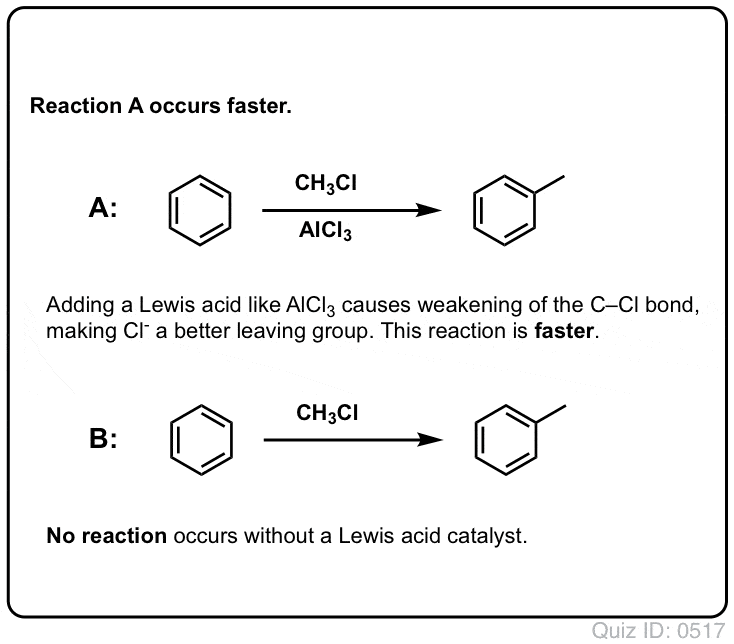
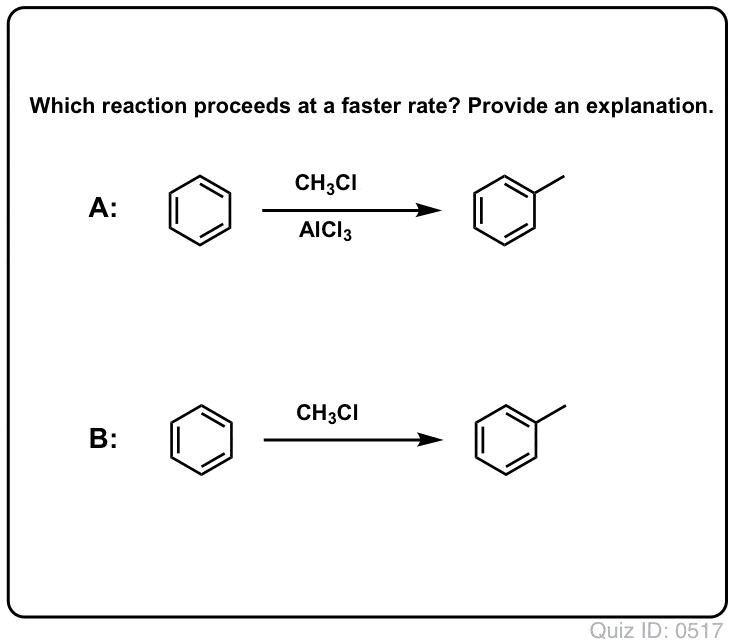
Lewis Acids Accelerate The Rate of Electrophilic Aromatic Substitution Reactions
The reaction of Cl2 with benzene is faster than toenail growth, but not by much (It is, however, much faster with more electron-rich arotics such as toluene and phenol). Assim, em vez de ficarmos semanas sentados no laboratório esperando por uma reação completa, podemos adicionar um reagente que “sopa” a reatividade do Cl2 para torná-lo em um eletrofilo ainda melhor: um catalisador, em outras palavras.
Adição de um bom ácido Lewis como AlCl3 ou FeCl3 faz o truque. . atualização: ver post sobre mecanismo
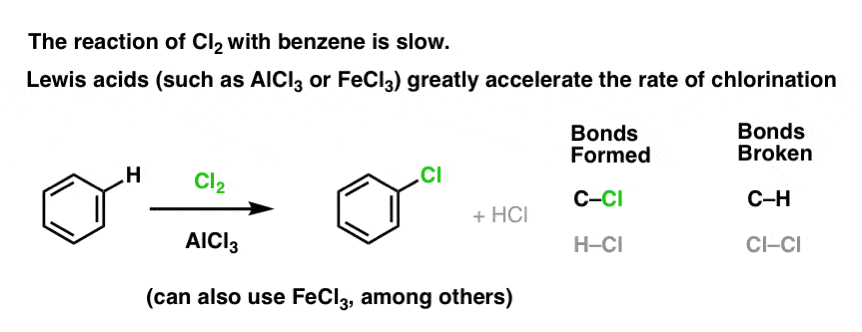
Como isso funciona?
De nossa série sobre álcoois você pode se lembrar que álcoois (R-OH) podem ser coaxados para participar de reações de substituição e eliminação se um ácido forte for adicionado ( formando R-OH2+ ). Isso porque o ácido conjugado é sempre um grupo de saída melhor; H2O é uma base mais fraca, e portanto um grupo de saída muito melhor, do que HO- . O etanol em si nunca reagirá com NaCl para dar cloreto de etilo, porque o grupo de saída resultante HO- é uma base demasiado forte em relação ao Cl- para que a reacção prossiga em qualquer extensão. Mas se convertermos o álcool em seu ácido conjugado R-OH2 + com um ácido forte como HCl, a reação pode então prosseguir, já que Cl- está deslocando a base muito mais fraca H2O.
Pode ser útil pensar em H+ como enfraquecendo a ligação C-O, e assim tornando o carbono ligado a ele um melhor eletrofilo.
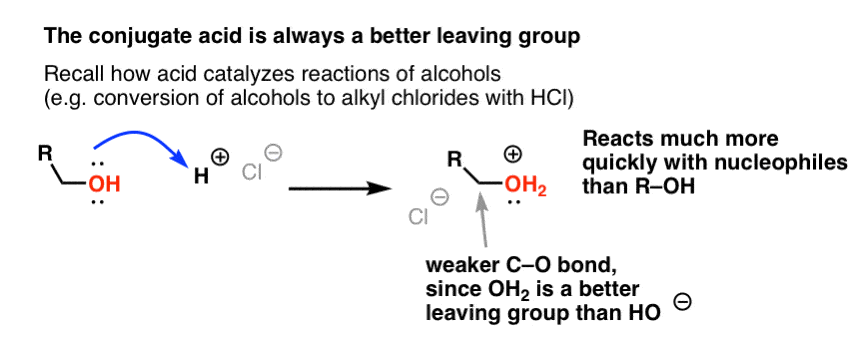
Apenas como ácido “primes” o carbono ligado ao grupo OH para uma reação subseqüente convertendo o grupo hidroxila em seu ácido conjugado, os ácidos de Lewis trabalham similarmente a mesma magia sobre o Cl2 (e para isso, todas as reações de substituição eletrofílica aromática que estaremos cobrindo envolverão algum tipo de catálise ácida).
No caso da cloração, o ácido Lewis (AlCl3, abaixo) aceita um par de elétrons de Cl2. Isto enfraquece a ligação Cl-Cl, transformando-a num nucleófilo ainda melhor. O ataque de um nucleófilo na distal Cl não libertará Cl- , mas a base ainda mais fraca (e portanto, melhor deixando o grupo) AlCl4(-).
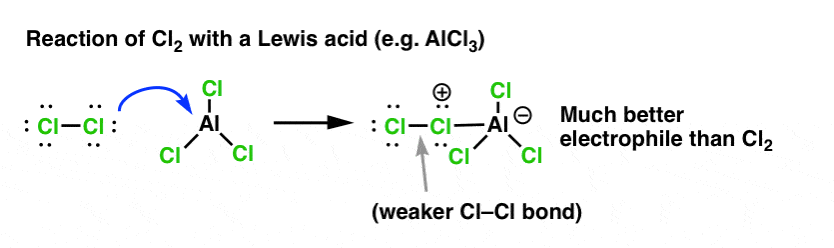
Adição de um ácido de Lewis (que, lembre-se, inclui ácidos Brønsted como H2SO4 ) é um fio comum nas seis substituições eletrofílicas aromáticas chave que são geralmente cobertas em química orgânica introdutória.
O Padrão Chave para Seis Reações de Substituição Eletrofílica Aromática Importantes
Nesta seção, vamos introduzir estas seis reações de substituição eletrofílica aromática chave, que se agrupam bem em três pares:
- cloração e bromação
- nitração e sulfonação
- alquilação de Friedel-Crafts e acylation de Friedel-Crafts
Ainda não vamos entrar nos mecanismos. A questão aqui é apenas seguir o que as ligações formam e quebram, para que você veja o padrão chave.
Aqui está:
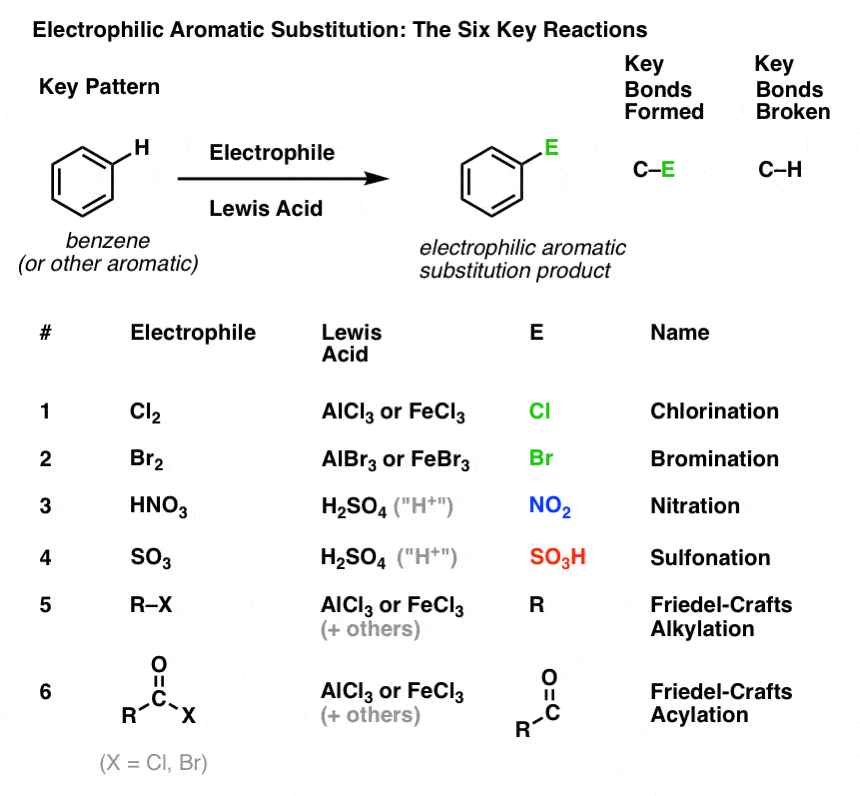
Cloração e Bromação de Moléculas Aromáticas
Vimos cloração (acima); a bromação é muito semelhante. Como o Br2 por si só não é um eletrofilo suficientemente forte para reagir com benzeno a um ritmo razoável, usamos um ácido Lewis como o AlBr3 ou FeBr3 para acelerar a reação. .
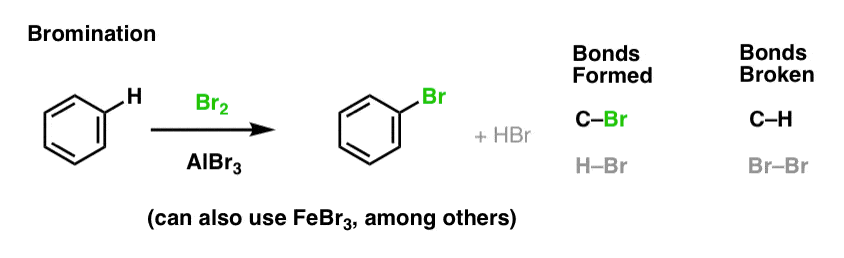
Nitração e Sulfonação de Moléculas Aromáticas
Nitração (substituição do H por um grupo NO2) não é uma reacção que vimos na nossa secção sobre alcenos, mas é uma reacção popular com moléculas aromáticas como o benzeno. Esta é a reação pela qual o metilbenzeno (tolueno) é convertido em 2,4,6-trinitrotolueno. É provável que esteja mais familiarizado com esta molécula como o TNT altamente explosivo.
Nitração é a substituição de H por NO2, utilizando ácido nítrico (HNO3) como fonte de NO2 e ácido sulfúrico (H2SO4) como o ácido Lewis:
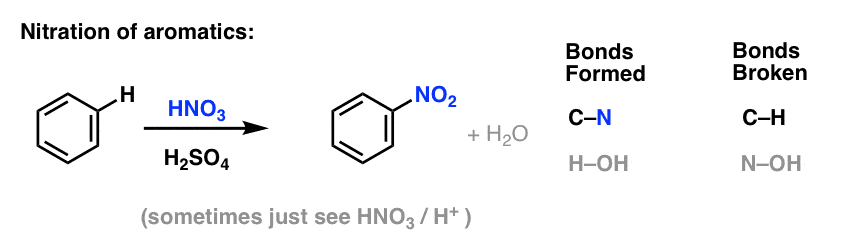
Sulfonação (substituição de H por um grupo SO3H) também se revela uma reacção útil. Pode ser realizada pela adição de trióxido de enxofre (SO3) na presença de ácido sulfúrico (H2SO4) como o ácido Lewis:
Alquilação e aciloação de Friedel-Crafts
Nas quatro reações acima, observamos a formação de C-Cl, C-Br, C-N e C-S.
Também é possível formar ligações carbono-carbono a moléculas aromáticas pela adição de halogenetos alquílicos ou acilglicos na presença de ácidos Lewis. Estas reacções são conhecidas como reacções de Friedel-Crafts, após os seus inventores (a reacção data de 1877).
Em Friedel-Crafts Alkylation, começamos com um halogeneto de alquilo “R-X” como CH3CH2Cl e depois adicionamos um ácido Lewis como AlCl3 ou FeCl3 . Como com Cl2, o ácido Lewis acelera a reação, coordenando-se com o halogênio, enfraquecendo a ligação C-Cl, e tornando-o um melhor grupo de saída, permitindo assim que o carbono ligado seja mais facilmente atacado por nucleófilos. Nenhuma reação ocorre sem o ácido Lewis.
Nota que aqui nós formamos C-C e quebramos C-H.
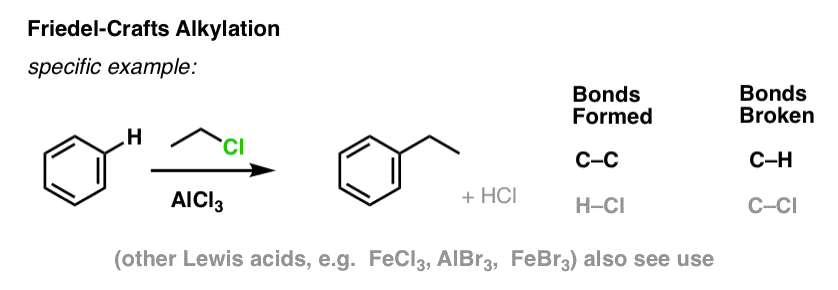
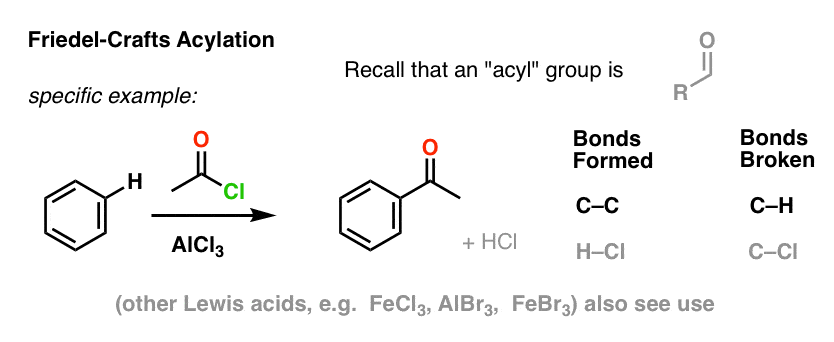
O Friedel-Crafts Acylation é similar, mas começamos com um halogeneto de acilo. A adição do nosso ácido Lewis resulta na formação de C-C e quebra de C-H.
Sumário: As Reações de Substituição Eletrofílica Aromática de Seis Chaves
Mostramos seis reações de substituição eletrofílica aromática (cloração, brominação, nitração, sulfonilação e alquilação Friedel-Crafts) e que todas elas envolvem a quebra do C-H e a formação do C-E (onde “E” é o eletrofilo em questão).
Mas conhecer as ligações que se formam e quebram é apenas o começo.
Aqui estão algumas perguntas que gostaríamos de saber a resposta a:
- Como é que os substitutos do benzeno afectam esta reacção? Por exemplo, como é que estas reacções podem ser afectadas se as realizámos em metilbenzeno? ou fenol? ou clorobenzeno?
- Como é que os substitutos com donativos de electrões ou com a extracção de electrões afectam a taxa da reacção?
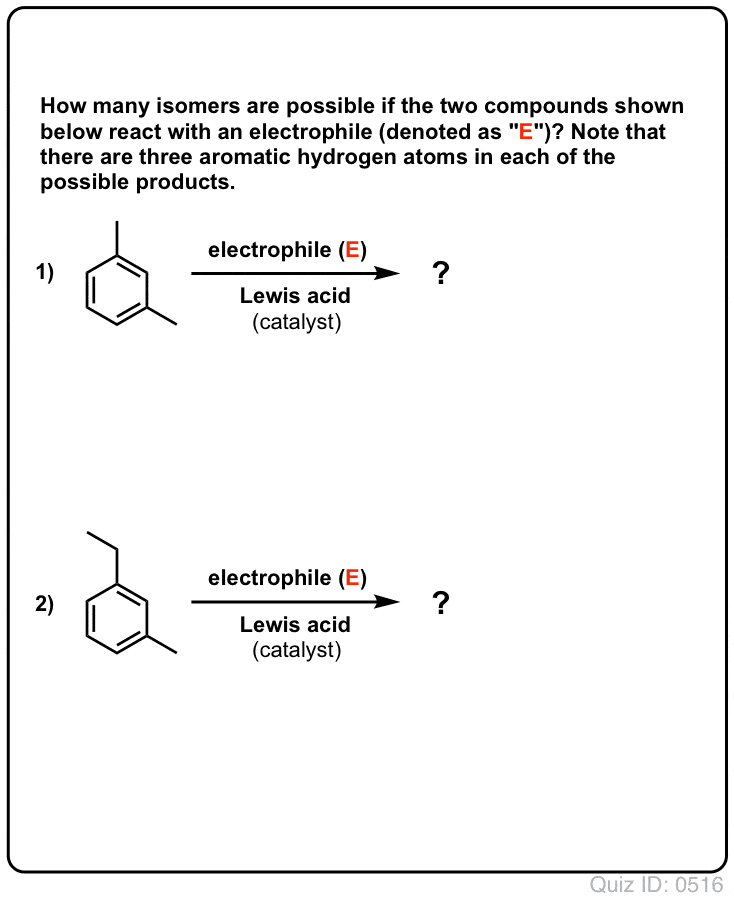
- Com o benzeno, apenas um produto mono-substituído pode eventualmente ser formado. Mas e se começarmos com um produto mono-substituído e fizermos uma substituição eletrofílica aromática sobre ele? Onde vão parar os substitutos?
- Como funciona a reacção? Como explicar a formação do C-E e a quebra do C-H ?
- E quanto a outros grupos aromáticos (além do benzeno)? Como se comparam as reacções de substituição electrofílica aromática em pirrol, piridina, naftaleno ou outros grupos?
No próximo post, discutiremos a primeira questão: o efeito da dádiva de electrões e da retirada de substitutos dos electrões. Vamos falar sobre ativar e desativar grupos.
Ponto seguinte: Activação e Desactivação de Grupos
Pelidos de leitura!
Muito obrigado a Matthew Knowe pela ajuda com este post.
Quiz Yourself!
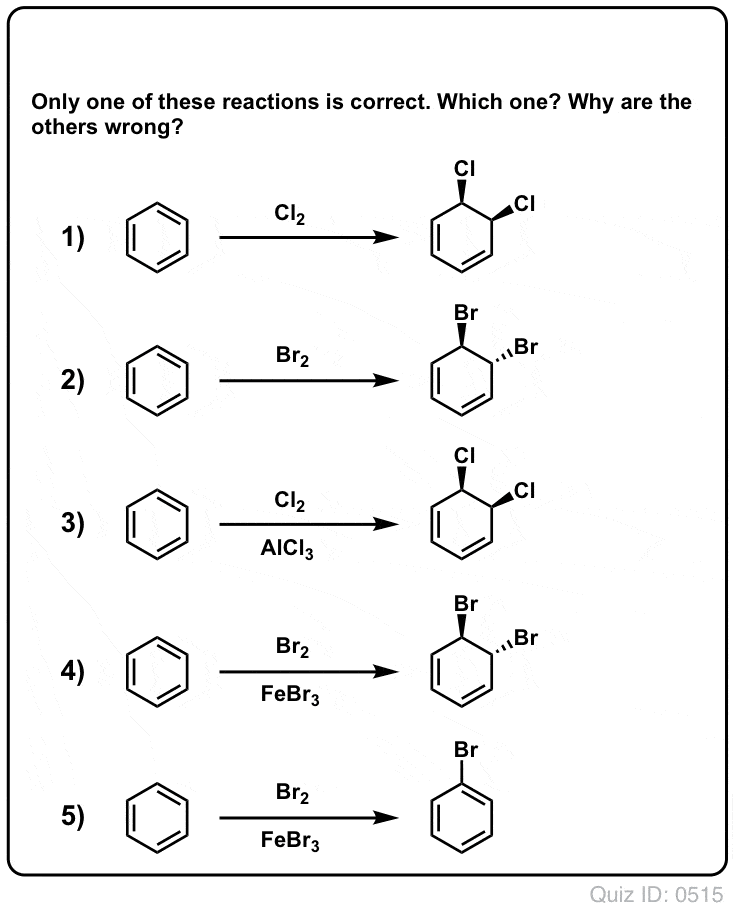 Clique para inverter
Clique para inverter 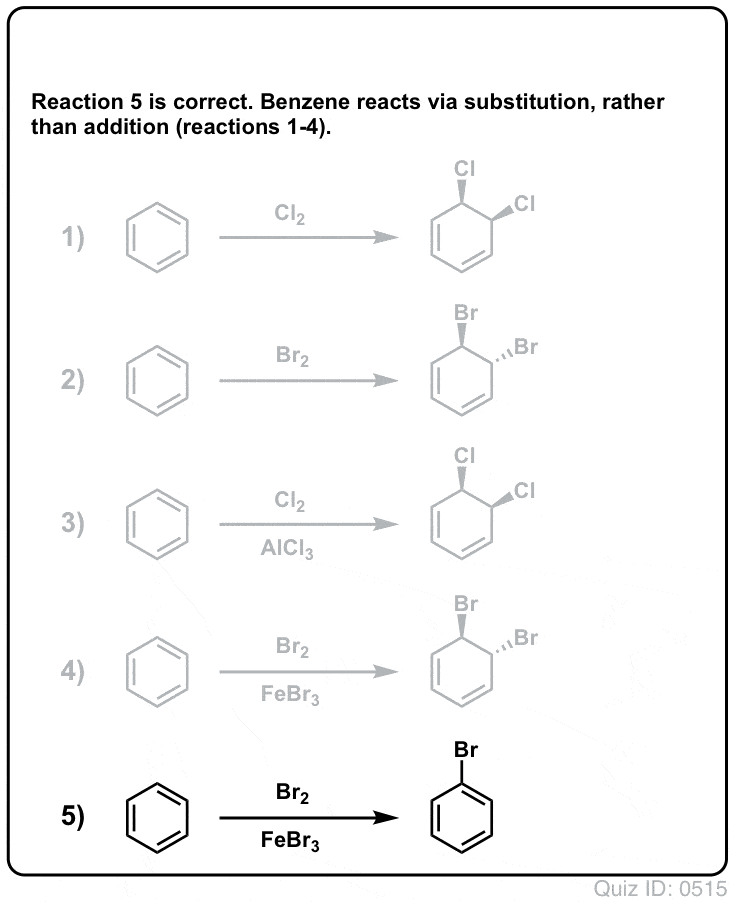
 Clique para inverter
Clique para inverter 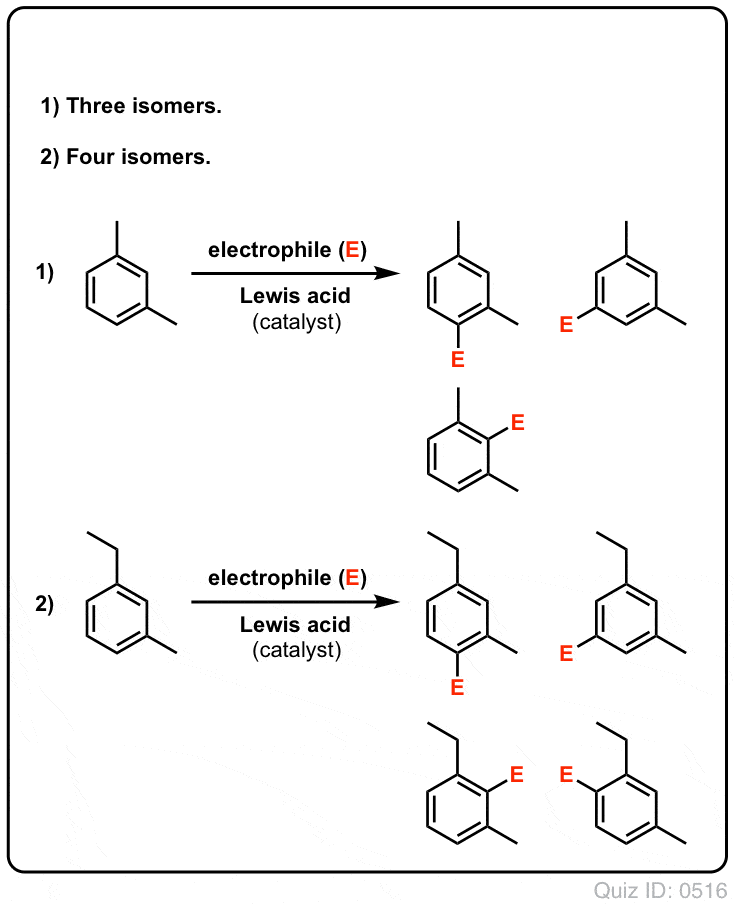
 Clique para inverter
Clique para inverter