Die sechs wichtigsten elektrophilen aromatischen Substitutionsreaktionen
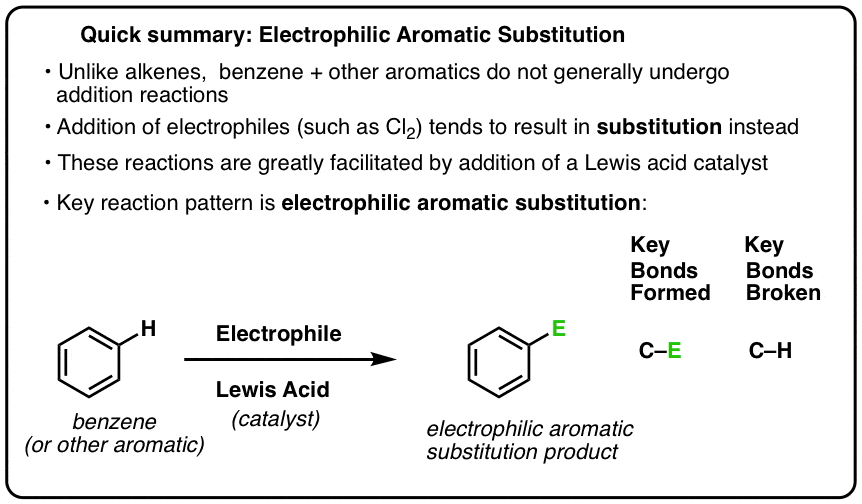
Eine Schlüsselreaktion bei aromatischen Verbindungen ist die elektrophile aromatische Substitution, bei der eine C-H-Bindung gebrochen und eine neue C-E-Bindung (E ist ein elektrophiles Atom wie Cl, Br, N…) gebildet wird.
Inhaltsverzeichnis
- Alkene ergeben bei der Reaktion mit Elektrophilen „Additionsprodukte“. Wie verhält sich Benzol im Vergleich dazu?
- Elektrophile aromatische Substitution
- Lewis-Säuren beschleunigen die Geschwindigkeit elektrophiler aromatischer Substitutionsreaktionen
- Das Schlüsselmuster für sechs wichtige elektrophile aromatische Substitutionsreaktionen
- Aromatische Chlorierung und Bromierung
- Aromatische Nitrierung und Sulfonierung
- Friedel-Handwerke Alkylierung und Acylierung
- Zusammenfassung: Die sechs wichtigsten elektrophilen aromatischen Substitutionsreaktionen
- Fragen Sie sich selbst!
- Alkene ergeben bei der Reaktion mit Elektrophilen „Additionsprodukte“. Wie verhält sich Benzol im Vergleich dazu?
- Elektrophile aromatische Substitution
- Lewis-Säuren beschleunigen die Geschwindigkeit elektrophiler aromatischer Substitutionsreaktionen
- Das Schlüsselmuster für sechs wichtige elektrophile aromatische Substitutionsreaktionen
- Chlorierung und Bromierung aromatischer Moleküle
- Nitrierung und Sulfonierung aromatischer Moleküle
- Friedel-Crafts-Alkylierung und -Acylierung
- Zusammenfassung: Die sechs wichtigsten elektrophilen aromatischen Substitutionsreaktionen
- Quiz yourself!
Alkene ergeben bei der Reaktion mit Elektrophilen „Additionsprodukte“. Wie verhält sich Benzol im Vergleich dazu?
Als wir vor einiger Zeit die Reaktionen von Alkenen behandelten – eine Menge Reaktionen! – haben wir gesehen, dass die überwiegende Mehrheit in die Klasse der Reaktionen fällt, die wir Additionsreaktionen nennen. Dabei wird eine (relativ schwache) C-C-(pi-)Bindung gebrochen und zwei neue Einfachbindungen zum Kohlenstoff gebildet. Die Chlorierung von Alkenen mit Cl2 ist ein klassisches Beispiel:
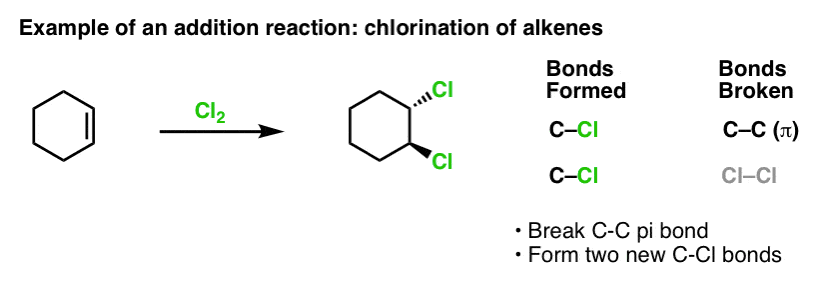
Da wir gerade beim Thema Benzol sind, stellt sich natürlich die Frage, wie reaktiv die pi-Bindungen in aromatischen Systemen (wie Benzol) im Vergleich zu den pi-Bindungen in Alkenen sind, und damit auch, wie die Reaktionen von aromatischen Verbindungen im Vergleich zu den Reaktionen von Alkenen sind.
Wir haben gesehen, dass Benzol eine ungewöhnliche Stabilität aufweist (36 kcal/mol Resonanzenergie) im Vergleich zu dem, was wir für ein theoretisches „Cyclohexatrien“ erwarten würden, was uns sicherlich zu der Vorhersage veranlassen würde, dass die pi-Bindungen in aromatischen Molekülen im Vergleich zu Alkenen weniger reaktiv sind.
Sie erinnern sich vielleicht auch daran, dass Benzol selbst ungewöhnlich schwer zu hydrieren ist. Wasserstoff (H2) lässt sich in Gegenwart einer katalytischen Menge von fein verteiltem Palladium auf Kohlenstoff (Pd/C) an die meisten Alkene anlagern, aber man muss wirklich die Dose Whup-Ass® der Marke Aldrich herausholen (d.h. hohe Temperaturen, hohe H2-Drücke, lange Reaktionszeiten), um erfolgreich H2 an Benzol zu addieren, im Vergleich zu „typischen“ Alkenen.
Wie können wir nun erwarten, dass Elektrophile wie Cl2 oder Br2 mit aromatischen Verbindungen wie Benzol reagieren?
Elektrophile aromatische Substitution
Unsere erste Vermutung wäre, dass Benzol mit Cl2 zu einem „Additionsprodukt“ wie dem unten gezeigten reagiert (wenn auch langsamer als bei einem „normalen“ Alken):
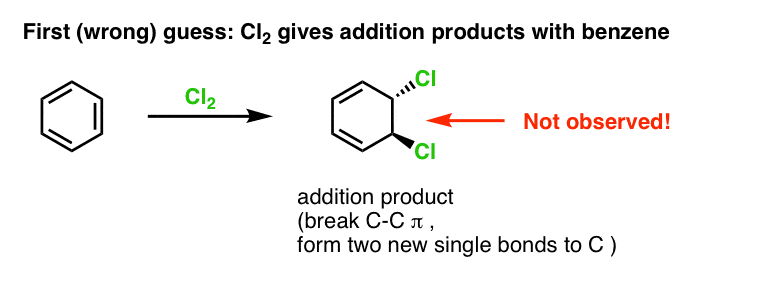
Das ist eigentlich nicht das Produkt, das wir beobachten!
Wenn man stattdessen Benzol mit Cl2 behandelt, erhält man schließlich (und sehr langsam) das folgende Produkt: Chlorbenzol.
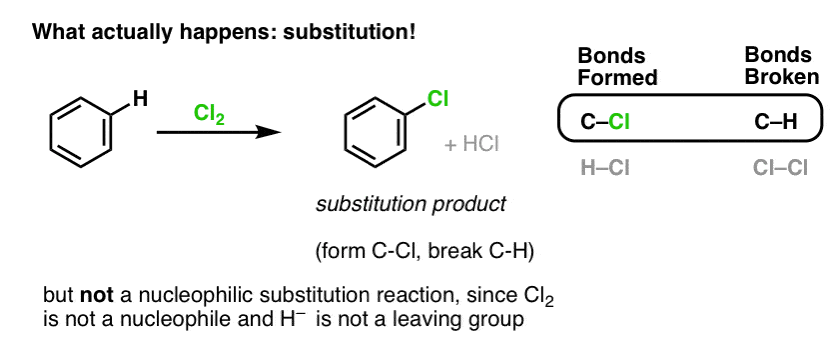
Welche Bindungen wurden bei dieser Reaktion gebildet und welche gebrochen?
Wir haben C-Cl gebildet und C-H gebrochen. Da die pi-Bindungen alle intakt sind, handelt es sich nicht um eine Additionsreaktion. Stattdessen handelt es sich um eine Substitutionsreaktion, bei der wir eine Bindung an einem einzelnen Kohlenstoffatom bilden und brechen.
Wir haben schon einmal ein Beispiel für eine Substitutionsreaktion gesehen, aber das waren nukleophile Substitutionen, bei denen ein Nukleophil (z.B. RS- ) an ein Alkylhalogenid-Elektrophil (z.B. R-Br) addiert wird, wobei es eine Abgangsgruppe (hier Br-) verdrängt, eine C-Nuc-Bindung (hier C-S) bildet und eine C-LG-Bindung (hier C-Br) bricht.
Ist also die Reaktion von Cl2 mit Benzol ebenfalls eine nukleophile Substitutionsreaktion? Nein!
Cl2 ist ein extrem schlechtes Nucleophil und reagiert als Elektronendonor nur mit starken Lewis-Säuren (z.B. AlCl3, unten). Wenn es mit einem relativ milden Nukleophil wie der pi-Bindung in einem Alken kombiniert wird, verhält es sich als Elektrophil (Elektronenakzeptor), wie wir bei seiner Reaktion mit Alkenen gesehen haben.
Die Reaktion von Cl2 mit Benzol wird daher als elektrophile aromatische Substitution (kurz EAS) bezeichnet:
- elektrophil, weil wir eine elektronenarme Spezies (Elektrophil),
- zu einer aromatischen Verbindung (Benzol) hinzufügen;
- Substitution, weil wir C-H aufbrechen und C-E bilden, wobei E unser Elektrophil ist (in diesem Fall Cl).
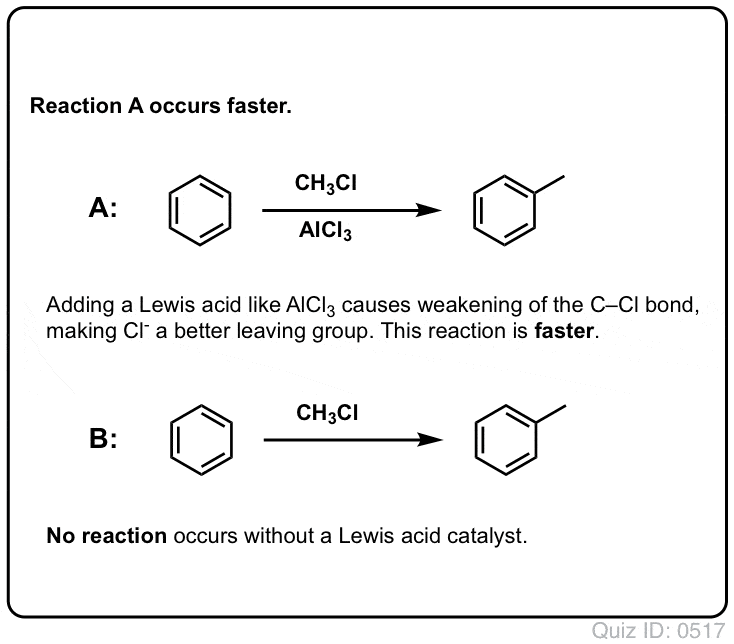
Lewis-Säuren beschleunigen die Geschwindigkeit elektrophiler aromatischer Substitutionsreaktionen
Die Reaktion von Cl2 mit Benzol ist schneller als das Wachstum von Zehennägeln, aber nicht viel schneller (bei elektronenreicheren Aromaten wie Toluol und Phenol ist sie jedoch viel schneller). Anstatt also wochenlang im Labor herumzusitzen und darauf zu warten, dass eine Reaktion abgeschlossen wird, können wir ein Reagenz hinzufügen, das die Reaktivität von Cl2 „aufpeppt“ und es zu einem noch besseren Elektrophil macht: ein Katalysator, mit anderen Worten.
Die Zugabe einer guten Lewis-Säure wie AlCl3 oder FeCl3 erfüllt den Zweck.
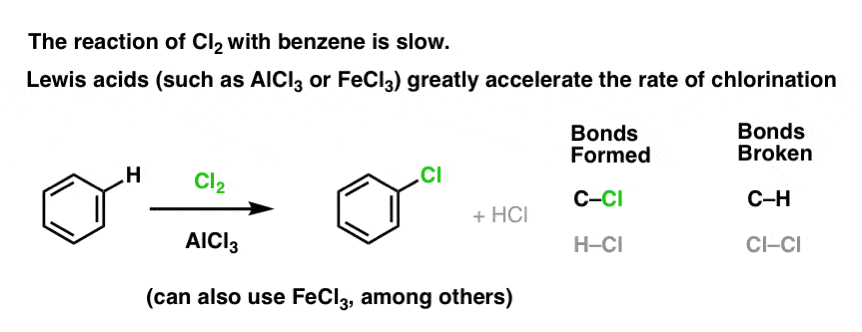
Wie funktioniert das?
Aus unserer Serie über Alkohole wissen Sie vielleicht noch, dass Alkohole (R-OH) zur Teilnahme an Substitutions- und Eliminierungsreaktionen überredet werden können, wenn man eine starke Säure hinzufügt (die R-OH2+ bildet). Das liegt daran, dass die konjugierte Säure immer eine bessere Abgangsgruppe ist; H2O ist eine schwächere Base und damit eine viel bessere Abgangsgruppe als HO- . Ethanol selbst wird niemals mit NaCl zu Ethylchlorid reagieren, da die entstehende Abgangsgruppe HO- eine zu starke Base im Vergleich zu Cl- ist, als dass die Reaktion in irgendeinem Umfang ablaufen könnte. Wenn wir jedoch den Alkohol mit einer starken Säure wie HCl in seine konjugierte Säure R-OH2 + umwandeln, kann die Reaktion ablaufen, da Cl- die viel schwächere Base H2O verdrängt.
Es kann hilfreich sein, sich vorzustellen, dass H+ die C-O-Bindung schwächt und damit den daran gebundenen Kohlenstoff zu einem besseren Elektrophil macht.
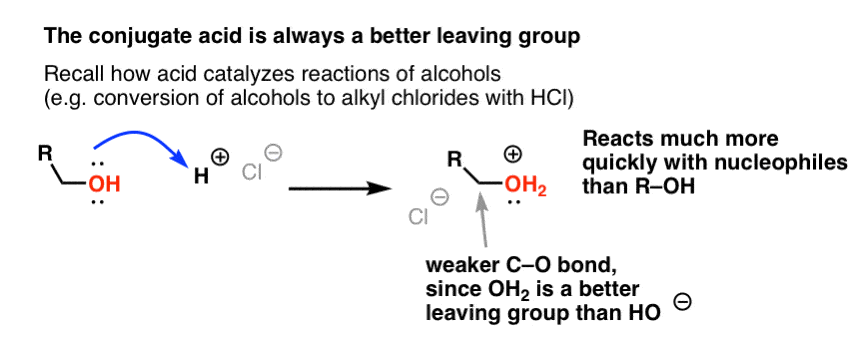
Gleich wie die Säure den an die OH-Gruppe gebundenen Kohlenstoff für eine nachfolgende Reaktion „präpariert“, indem sie die Hydroxylgruppe in ihre konjugierte Säure umwandelt, wirken Lewis-Säuren auf Cl2 die gleiche Magie (und im Übrigen werden alle elektrophilen aromatischen Substitutionsreaktionen, die wir behandeln werden, eine Art Säurekatalyse beinhalten).
Im Falle der Chlorierung nimmt die Lewis-Säure (AlCl3, unten) ein Elektronenpaar von Cl2 auf. Dadurch wird die Cl-Cl-Bindung geschwächt, was sie zu einem noch besseren Nukleophil macht. Durch den Angriff eines Nukleophils am distalen Cl wird nicht Cl- , sondern die noch schwächere Base (und damit bessere Abgangsgruppe) AlCl4(-) freigesetzt.
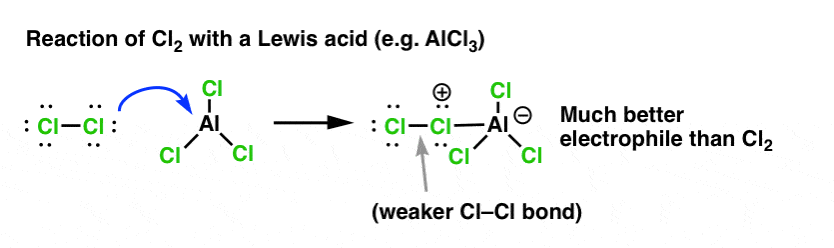
Die Addition einer Lewis-Säure (zu der auch Brønsted-Säuren wie H2SO4 gehören) ist ein roter Faden bei den sechs wichtigsten elektrophilen aromatischen Substitutionen, die im Allgemeinen in der Einführung in die organische Chemie behandelt werden.
Das Schlüsselmuster für sechs wichtige elektrophile aromatische Substitutionsreaktionen
In diesem Abschnitt werden wir diese sechs wichtigen elektrophilen aromatischen Substitutionsreaktionen vorstellen, die sich gut in drei Paare gliedern lassen:
- Chlorierung und Bromierung
- Nitrierung und Sulfonylierung
- Friedel-Crafts-Alkylierung und Friedel-Crafts-Acylierung
Wir werden noch nicht auf die Mechanismen eingehen. Hier geht es nur darum, zu verfolgen, welche Bindungen sich bilden und brechen, damit Sie das Schlüsselmuster sehen.
Hier ist es:
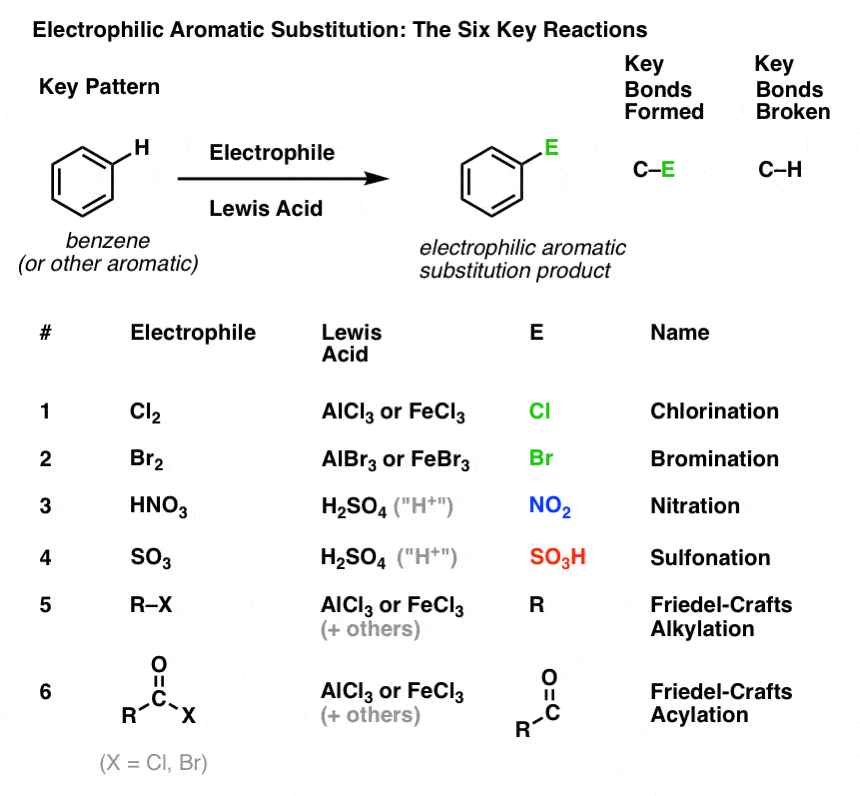
Chlorierung und Bromierung aromatischer Moleküle
Wir haben die Chlorierung (oben) gesehen; die Bromierung ist sehr ähnlich. Da Br2 allein nicht stark genug ist, um mit Benzol in angemessener Geschwindigkeit zu reagieren, verwenden wir eine Lewis-Säure wie AlBr3 oder FeBr3, um die Reaktion zu beschleunigen.
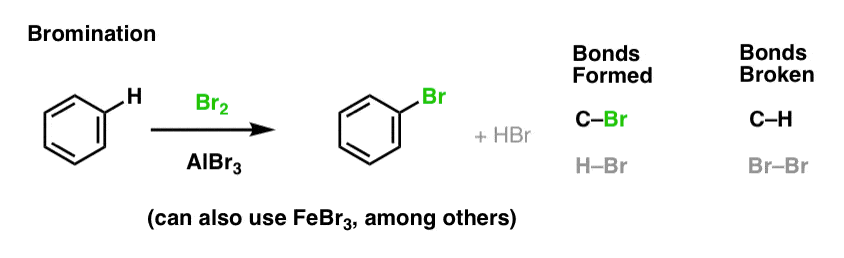
Nitrierung und Sulfonierung aromatischer Moleküle
Die Nitrierung (Ersatz von H durch eine NO2-Gruppe) ist keine Reaktion, die wir in unserem Abschnitt über Alkene gesehen haben, aber sie ist eine beliebte Reaktion mit aromatischen Molekülen wie Benzol. Dies ist die Reaktion, bei der Methylbenzol (Toluol) in 2,4,6-Trinitrotoluol umgewandelt wird. Sie kennen dieses Molekül wahrscheinlich eher als den Sprengstoff TNT.
Nitration ist die Substitution von H durch NO2, wobei Salpetersäure (HNO3) als NO2-Quelle und Schwefelsäure (H2SO4) als Lewis-Säure verwendet werden:
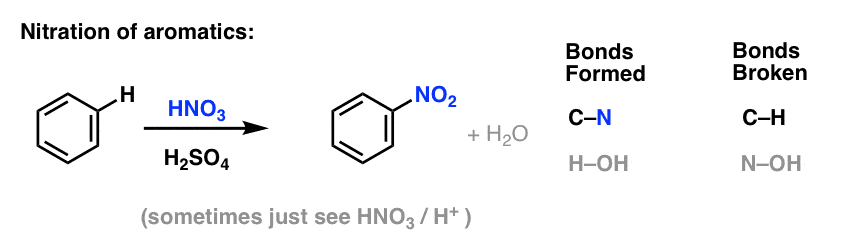
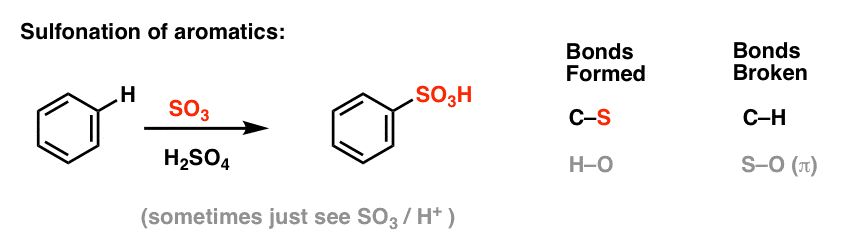
Sulfonierung (Ersatz von H durch eine SO3H-Gruppe) erweist sich ebenfalls als nützliche Reaktion. Sie kann durch Zugabe von Schwefeltrioxid (SO3) in Gegenwart von Schwefelsäure (H2SO4) als Lewis-Säure durchgeführt werden:
Friedel-Crafts-Alkylierung und -Acylierung
In den vier oben genannten Reaktionen haben wir die Bildung von C-Cl, C-Br, C-N und C-S beobachtet.
Es ist auch möglich, Kohlenstoff-Kohlenstoff-Bindungen zu aromatischen Molekülen zu bilden, indem man Alkyl- oder Acylhalogenide in Gegenwart von Lewis-Säuren hinzufügt. Diese Reaktionen werden nach ihren Erfindern als Friedel-Crafts-Reaktionen bezeichnet (die Reaktion geht auf das Jahr 1877 zurück).
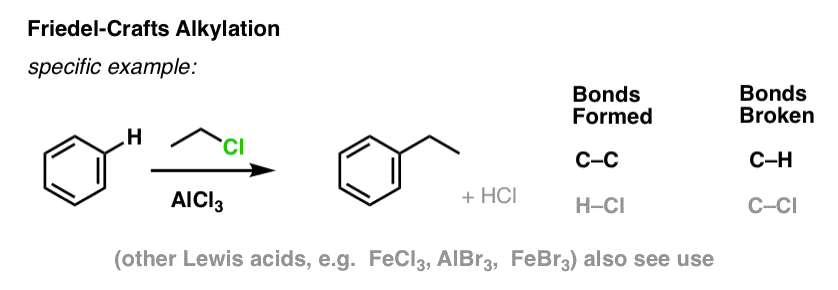
Bei der Friedel-Crafts-Alkylierung beginnt man mit einem Alkylhalogenid „R-X“ wie CH3CH2Cl und fügt dann eine Lewis-Säure wie AlCl3 oder FeCl3 hinzu. Wie bei Cl2 beschleunigt die Lewis-Säure die Reaktion, indem sie sich mit dem Halogen koordiniert, die C-Cl-Bindung schwächt und zu einer besseren Abgangsgruppe macht, so dass der gebundene Kohlenstoff leichter von Nukleophilen angegriffen werden kann. Ohne die Lewis-Säure findet keine Reaktion statt.
Beachte, dass wir hier C-C bilden und C-H brechen.
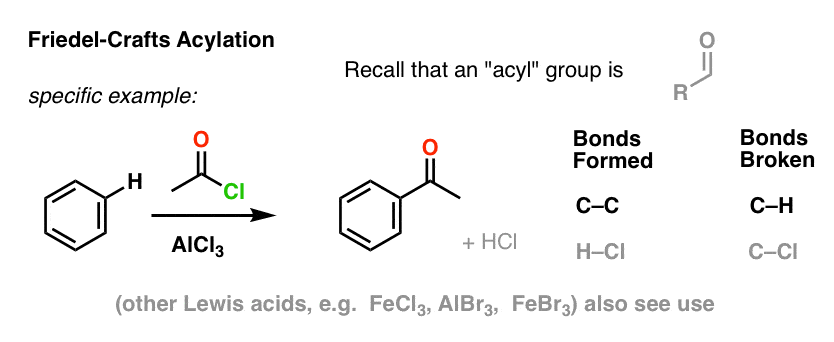
Die Friedel-Crafts-Acylierung ist ähnlich, aber wir beginnen mit einem Acylhalogenid. Die Zugabe unserer Lewis-Säure führt zur Bildung von C-C und zur Spaltung von C-H.
Zusammenfassung: Die sechs wichtigsten elektrophilen aromatischen Substitutionsreaktionen
Wir haben sechs wichtige elektrophile aromatische Substitutionsreaktionen gezeigt (Chlorierung, Bromierung, Nitrierung, Sulfonylierung und die Friedel-Crafts-Alkylierung und -Acylierung) und dass sie alle den Bruch von C-H und die Bildung von C-E beinhalten (wobei „E“ das betreffende Elektrophil ist).
Aber die Kenntnis der Bindungen, die sich bilden und brechen, ist nur der Anfang.
Hier sind einige Fragen, auf die wir gerne die Antwort wüssten:
- Wie beeinflussen Substituenten am Benzol diese Reaktion? Wie könnten diese Reaktionen beispielsweise beeinflusst werden, wenn wir sie mit Methylbenzol, Phenol oder Chlorbenzol durchführen würden?
- Wie wirken sich elektronenabgebende oder elektronenziehende Substituenten auf die Reaktionsgeschwindigkeit aus?
- Bei Benzol kann nur ein monosubstituiertes Produkt gebildet werden. Was aber, wenn man von einem monosubstituierten Produkt ausgeht und daran eine elektrophile aromatische Substitution durchführt? Wo landen die Substituenten?
- Wie läuft die Reaktion ab? Wie erklären wir die Bildung von C-E und die Abspaltung von C-H?
- Was ist mit anderen aromatischen Gruppen (außer Benzol). Wie sehen elektrophile aromatische Substitutionsreaktionen an Pyrrol, Pyridin, Naphthalin oder anderen Gruppen aus?
Im nächsten Beitrag werden wir die erste Frage erörtern: die Wirkung von elektronenabgebenden und elektronenziehenden Substituenten. Wir werden über aktivierende und deaktivierende Gruppen sprechen.
Nächster Beitrag: Aktivierende und deaktivierende Gruppen
Danke fürs Lesen!
Vielen Dank an Matthew Knowe für die Unterstützung bei diesem Beitrag.
Quiz yourself!
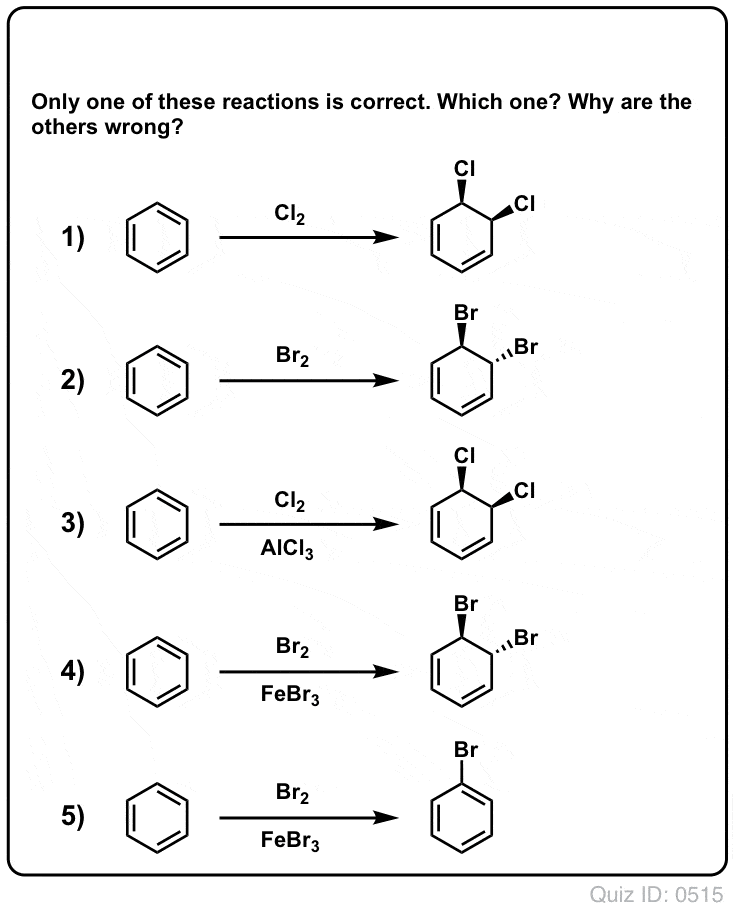 Zum Umdrehen klicken
Zum Umdrehen klicken 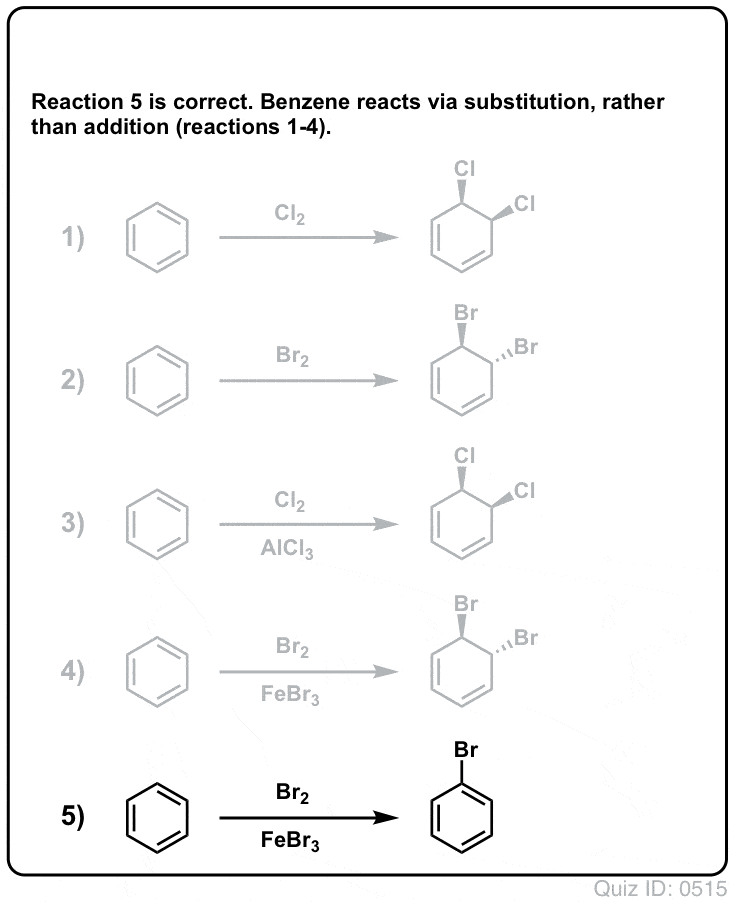
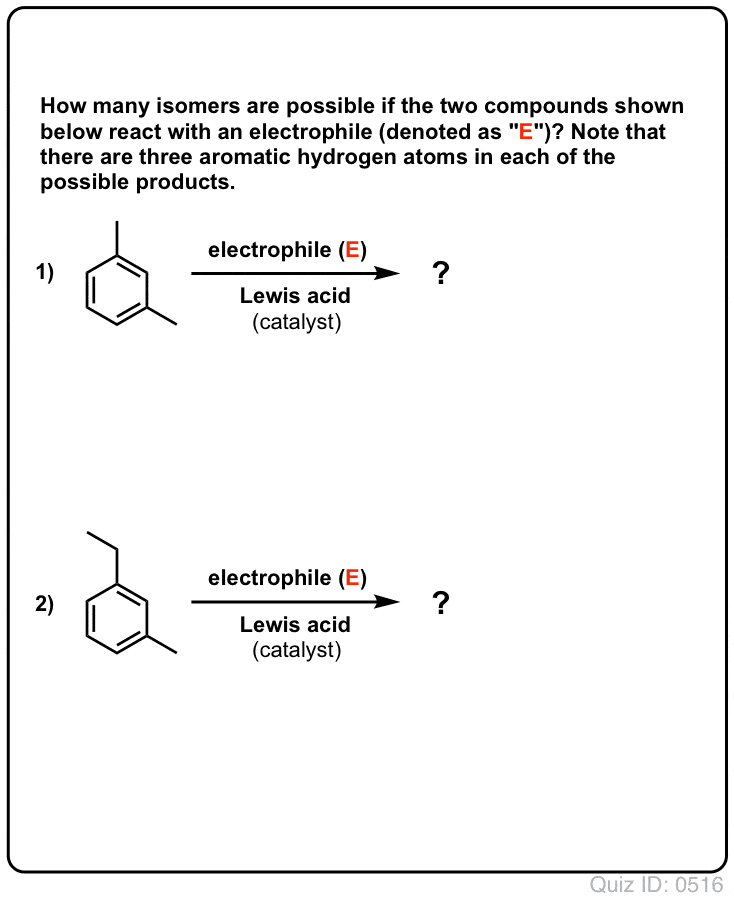 Klick zum Umdrehen
Klick zum Umdrehen 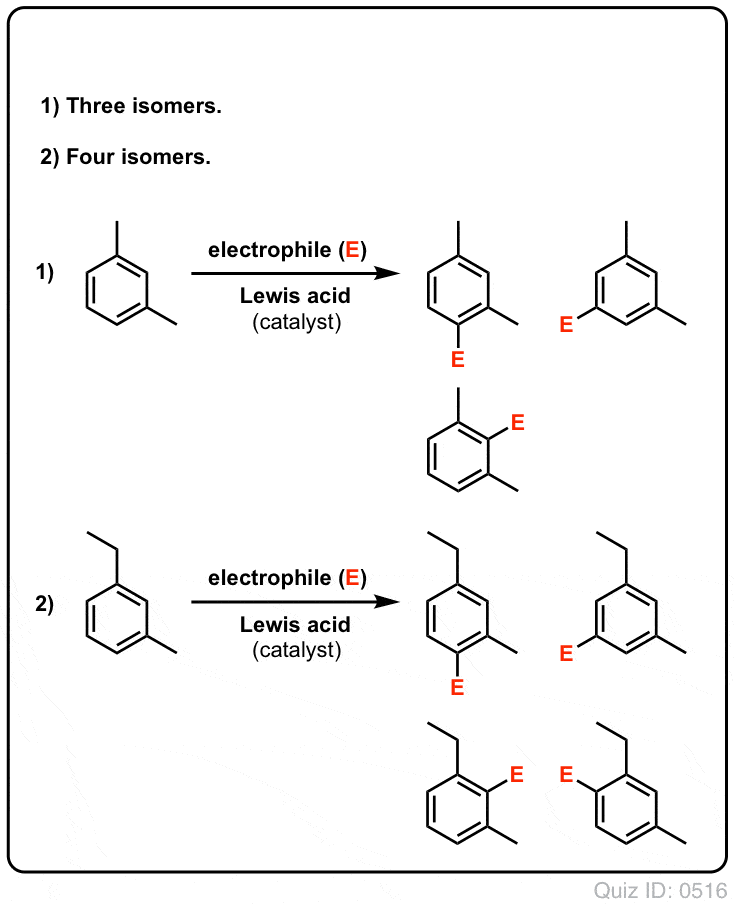
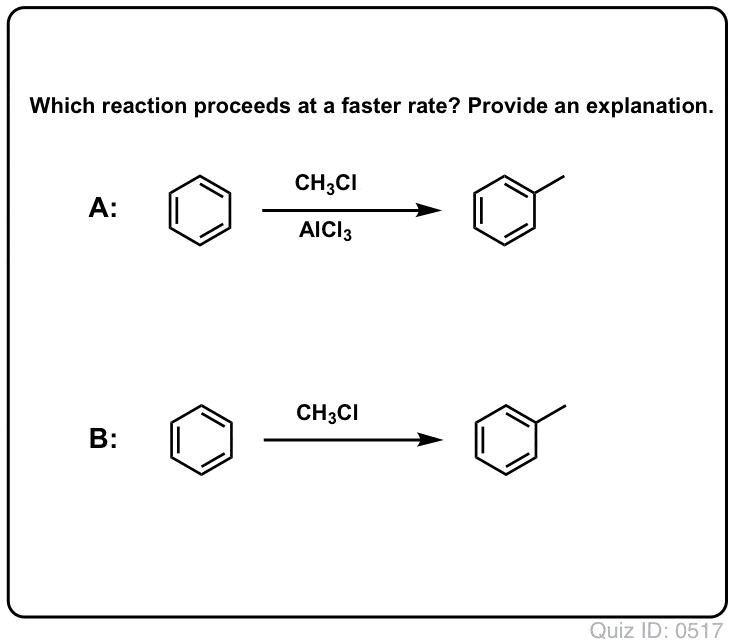 Klick zum Umdrehen
Klick zum Umdrehen