Le Sei Reazioni Chiave di Sostituzione Aromatica Elettrofila
Una reazione chiave dei composti aromatici è la sostituzione aromatica elettrofila, dove un legame C-H è rotto e si forma un nuovo legame C-E (E è un atomo elettrofilo come Cl, Br, N…).
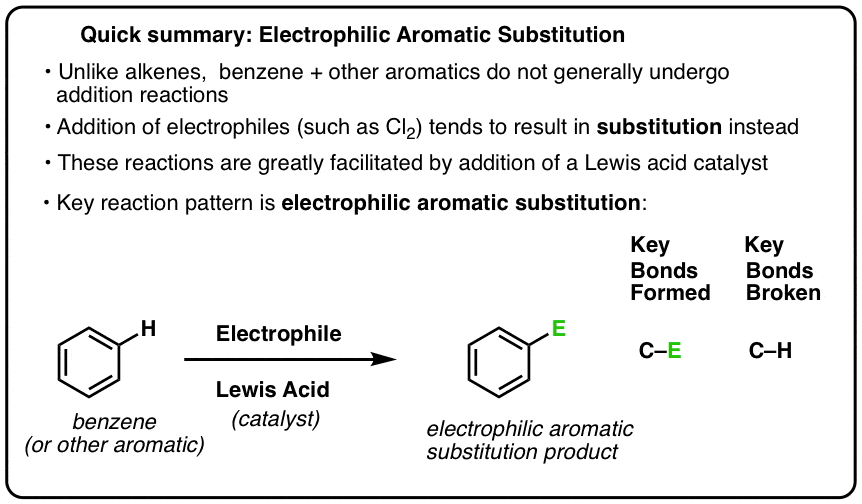
Tabella dei Contenuti
- Gli alcheni danno prodotti di “addizione” alla reazione con elettrofili. Come si confronta il benzene?
- Sostituzione aromatica elettrofila
- Gli acidi di Lewis accelerano la velocità delle reazioni di sostituzione aromatica elettrofila
- Lo schema chiave per sei importanti reazioni di sostituzione aromatica elettrofila
- Clorazione e brominazione aromatica
- Nitrazione e solfonazione aromatica
- Friedel-Crafts Alchilazione e Acilazione
- Sommario: Le sei reazioni di sostituzione aromatica elettrofila chiave
- Quiz Yourself!
- Gli alcheni danno prodotti di “addizione” alla reazione con gli elettrofili. Quindi, come si confronta il benzene?
- Sostituzione aromatica elettrofila
- Gli acidi di Lewis accelerano la velocità delle reazioni di sostituzione elettrofila aromatica
- Lo schema chiave per sei importanti reazioni di sostituzione elettrofila aromatica
- Clorazione e brominazione di molecole aromatiche
- Nitrazione e solfonazione di molecole aromatiche
- Friedel-Crafts Alchilazione e Acilazione
- Sommario: Le sei reazioni chiave di sostituzione aromatica elettrofila
- Quiz Yourself!
Gli alcheni danno prodotti di “addizione” alla reazione con gli elettrofili. Quindi, come si confronta il benzene?
Quando abbiamo coperto le reazioni degli alcheni qualche tempo fa – un sacco di reazioni! – abbiamo visto che la stragrande maggioranza cadeva nella classe di reazioni che chiamiamo reazioni di addizione. Questo è dove rompiamo un (relativamente debole) legame C-C (pi) e formiamo due nuovi legami singoli al carbonio. La clorurazione degli alcheni con Cl2 è un classico esempio:
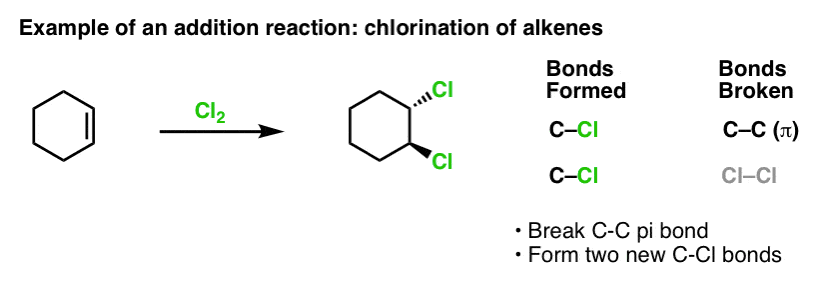
Siccome siamo sull’argomento benzene, è naturale chiedersi quanto bene i legami pi nei sistemi aromatici (come il benzene) si confrontano in reattività con i legami pi negli alcheni, e per estensione, come le reazioni dei composti aromatici si confrontano con le reazioni degli alcheni.
Abbiamo visto che il benzene ha una stabilità insolita (36 kcal/mol di energia di risonanza) rispetto a quella che ci aspetteremmo per il “cicloesatriene” teorico, il che ci porterebbe certamente a prevedere che i legami pi nelle molecole aromatiche saranno meno reattivi, rispetto agli alcheni.
Si potrebbe anche ricordare che il benzene stesso è insolitamente difficile da idrogenare. L’idrogeno (H2) può essere fatto aggiungere attraverso la maggior parte degli alcheni in presenza di una quantità catalitica di palladio finemente suddiviso su carbonio (Pd/C), ma è davvero necessario tirare fuori il barattolo di Aldrich Brand Whup-Ass® (cioè alte temperature, alte pressioni di H2, tempi di reazione prolungati) per aggiungere con successo H2 al benzene, rispetto ai “tipici” alcheni.
Sapendo questo, come potremmo aspettarci che elettrofili come Cl2 o Br2 reagiscano con composti aromatici come il benzene?
Sostituzione aromatica elettrofila
La nostra prima ipotesi potrebbe essere che il benzene reagisca con Cl2 per dare un prodotto di “addizione” come quello mostrato qui sotto (anche se più lentamente che con un alchene “normale”):
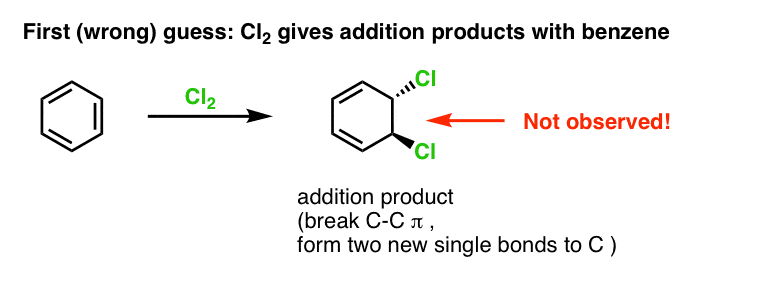
Questo in realtà non è il prodotto che osserviamo!
Invece, se tratti il benzene con Cl2 otterrai alla fine (e molto lentamente) il seguente prodotto: clorobenzene.
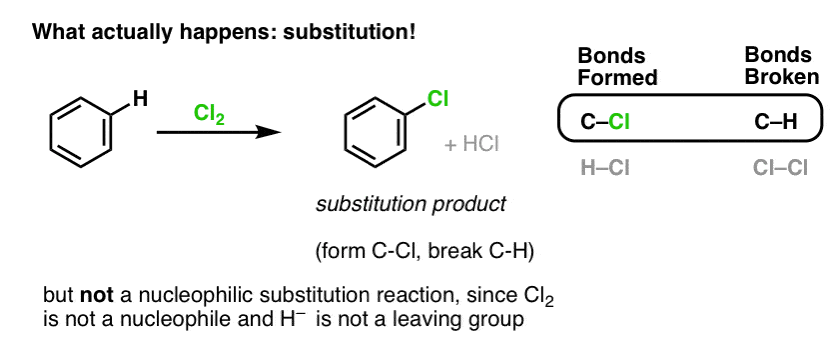
Quali legami si sono formati e quali si sono rotti in questa reazione?
Abbiamo formato C-Cl e rotto C-H . Poiché i legami pi sono tutti intatti, questa non è una reazione di addizione. Invece, questo è quindi un tipo di reazione di sostituzione, dove formiamo e rompiamo un legame su un singolo carbonio.
Abbiamo visto un esempio di reazioni di sostituzione prima, ma quelle erano sostituzioni nucleofile, dove un nucleofilo (es. RS- ) viene aggiunto ad un alogenuro alchilico elettrofilo (ad esempio R-Br), spostando un gruppo lasciante (Br- qui) formando un legame C-Nuc (C-S in questo caso) e rompendo un legame C-LG (C-Br qui).
Quindi anche la reazione di Cl2 con il benzene è una reazione di sostituzione nucleofila? No!
Cl2 è un nucleofilo estremamente povero, reagendo come elettron-donatore solo con forti acidi di Lewis (ad esempio AlCl3, sotto). Quando è combinato con un nucleofilo anche relativamente blando come il pi-bond in un alchene, si comporta come un elettrofilo (accettore di elettroni) come abbiamo visto nella sua reazione con gli alcheni.
La reazione di Cl2 con il benzene è così chiamata una sostituzione aromatica elettrofila (EAS in breve):
- Elettrofilo, perché stiamo aggiungendo una specie povera di elettroni (elettrofilo),
- a un composto aromatico (benzene);
- sostituzione, perché stiamo rompendo C-H e formando C-E, dove E è il nostro elettrofilo (Cl in questo caso).
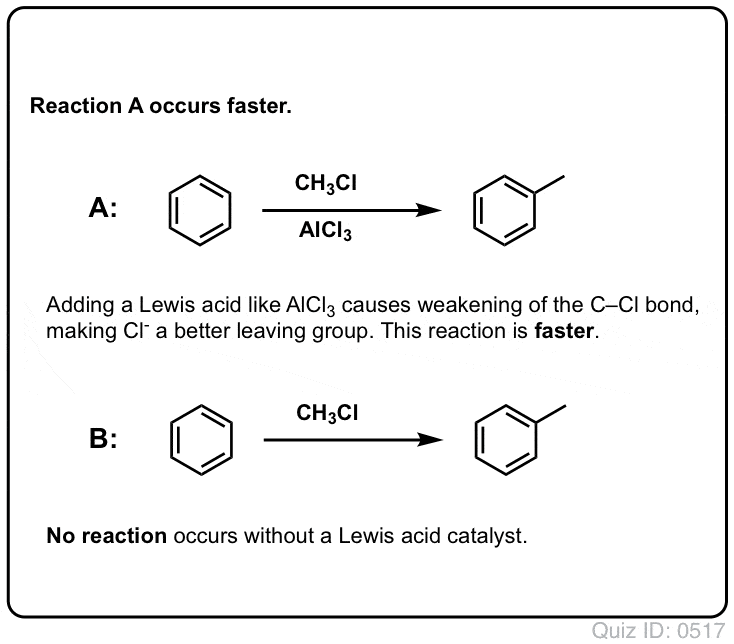
Gli acidi di Lewis accelerano la velocità delle reazioni di sostituzione elettrofila aromatica
La reazione di Cl2 con il benzene è più veloce della crescita delle unghie dei piedi, ma non di molto (è, tuttavia, molto più veloce con aromatici più ricchi di elettroni come il toluene e il fenolo). Quindi, invece di stare seduti in laboratorio per settimane ad aspettare che la reazione si completi, possiamo aggiungere un reagente che “addolcisca” la reattività del Cl2 per renderlo un elettrofilo ancora migliore: un catalizzatore, in altre parole.
L’aggiunta di un buon acido di Lewis come AlCl3 o FeCl3 fa il trucco. . aggiornamento: vedi post sul meccanismo
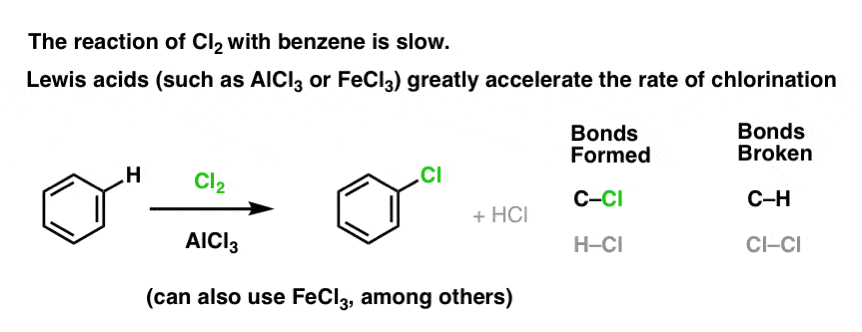
Come funziona?
Dalla nostra serie sugli alcoli si può ricordare che gli alcoli (R-OH) possono essere convinti a partecipare a reazioni di sostituzione ed eliminazione se viene aggiunto un acido forte (formando R-OH2+). Questo perché l’acido coniugato è sempre un gruppo di partenza migliore; H2O è una base più debole, e quindi un gruppo di partenza molto migliore di HO- . L’etanolo stesso non reagirà mai con NaCl per dare cloruro di etile, perché il gruppo lasciante risultante HO- è una base troppo forte rispetto a Cl- perché la reazione possa procedere in qualche misura. Ma se convertiamo l’alcol nel suo acido coniugato R-OH2 + con un acido forte come l’HCl, la reazione può procedere, poiché Cl- sta spostando la base molto più debole H2O.
Può essere utile pensare a H+ come un indebolimento del legame C-O, e quindi rendere il carbonio collegato ad esso un migliore elettrofilo.
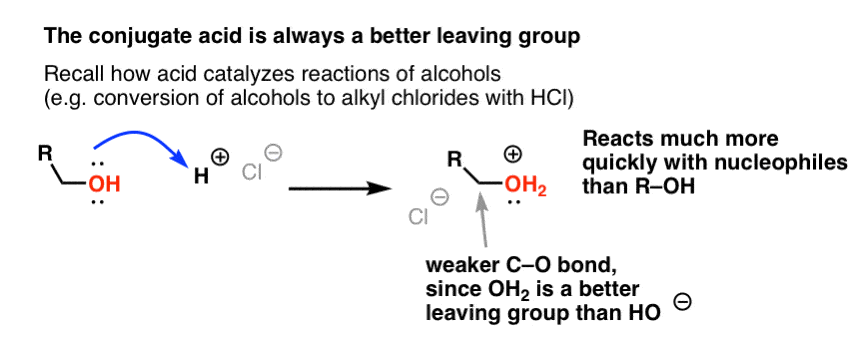
Così come l’acido “innesca” il carbonio attaccato al gruppo OH per una reazione successiva convertendo il gruppo idrossile nel suo acido coniugato, gli acidi di Lewis allo stesso modo fanno la stessa magia su Cl2 (e per questo, tutte le reazioni di sostituzione aromatica elettrofila che copriremo coinvolgeranno qualche tipo di catalisi dell’acido).
Nel caso della clorazione, l’acido di Lewis (AlCl3, sotto) accetta una coppia di elettroni da Cl2. Questo indebolisce il legame Cl-Cl, rendendolo un nucleofilo ancora migliore. L’attacco di un nucleofilo al Cl distale libererà non Cl-, ma la base ancora più debole (e quindi, un migliore gruppo lasciante) AlCl4(-).
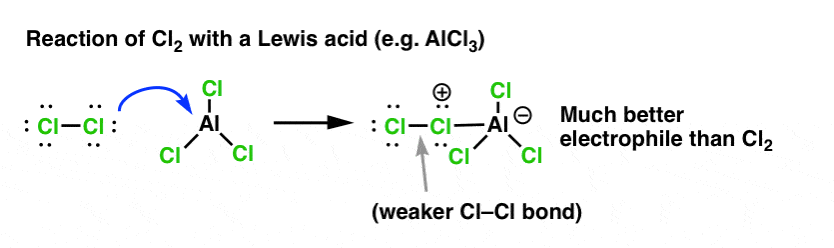
L’aggiunta di un acido di Lewis (che, ricordiamo, include acidi di Brønsted come H2SO4) è un filo comune nelle sei sostituzioni aromatiche elettrofile chiave che sono generalmente coperte nella chimica organica introduttiva.
Lo schema chiave per sei importanti reazioni di sostituzione elettrofila aromatica
In questa sezione, introdurremo queste sei reazioni chiave di sostituzione elettrofila aromatica, che si raggruppano in tre coppie:
- clorazione e brominazione
- nitrazione e solfonilazione
- alchilazione di Friedel-Crafts e acilazione di Friedel-Crafts
Non entreremo ancora nei meccanismi. Il punto qui è solo seguire quali legami si formano e si rompono, in modo da vedere il modello chiave.
Ecco qui:
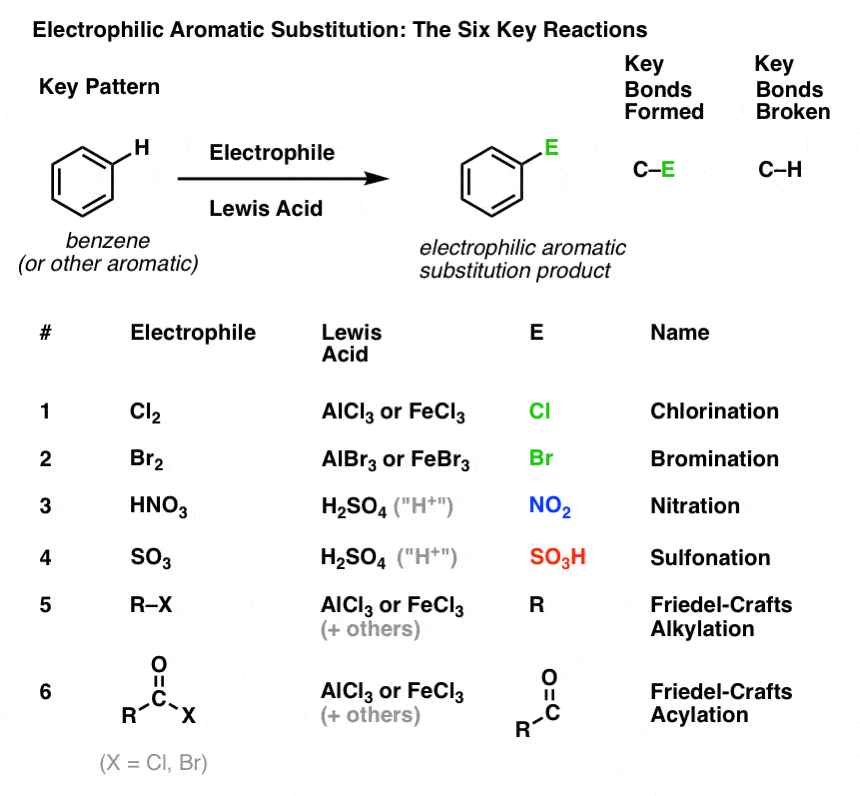
Clorazione e brominazione di molecole aromatiche
Abbiamo visto la clorazione (sopra); la brominazione è molto simile. Poiché Br2 da solo non è un elettrofilo abbastanza forte da reagire con il benzene ad una velocità ragionevole, usiamo un acido di Lewis come AlBr3 o FeBr3 per accelerare la reazione. .
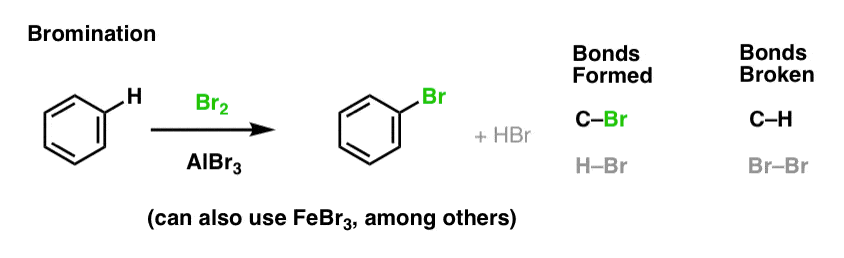
Nitrazione e solfonazione di molecole aromatiche
La nitrazione (sostituzione di H con un gruppo NO2) non è una reazione che abbiamo visto nella nostra sezione sugli alcheni, ma è una reazione popolare con molecole aromatiche come il benzene. Questa è la reazione con cui il metilbenzene (toluene) viene convertito in 2,4,6-trinitrotoluene. Probabilmente hai più familiarità con questa molecola come l’alto esplosivo TNT.
Nitrazione è la sostituzione di H con NO2, usando l’acido nitrico (HNO3) come fonte di NO2 e l’acido solforico (H2SO4) come acido di Lewis:
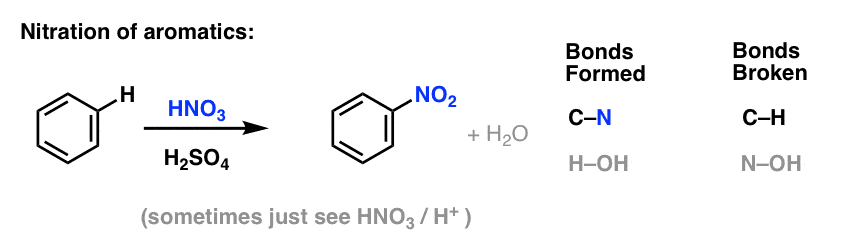
Anche la solfonazione (sostituzione di H con un gruppo SO3H) risulta essere una reazione utile. Può essere eseguita aggiungendo triossido di zolfo (SO3) in presenza di acido solforico (H2SO4) come acido di Lewis:
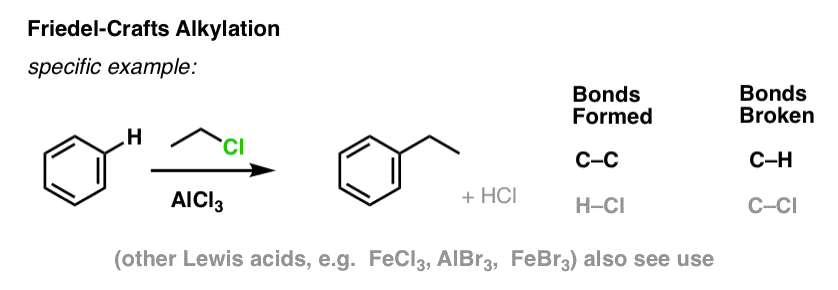
Friedel-Crafts Alchilazione e Acilazione
Nelle quattro reazioni precedenti, abbiamo osservato la formazione di C-Cl, C-Br, C-N e C-S.
È anche possibile formare legami carbonio-carbonio a molecole aromatiche aggiungendo alogenuri alchilici o acilici in presenza di acidi di Lewis. Queste reazioni sono conosciute come reazioni di Friedel-Crafts, dal nome dei loro inventori (la reazione risale al 1877).
Nella alchilazione di Friedel-Crafts, si inizia con un alogenuro alchilico “R-X” come CH3CH2Cl e poi si aggiunge un acido di Lewis come AlCl3 o FeCl3 . Come con Cl2, l’acido di Lewis accelera la reazione coordinandosi all’alogeno, indebolendo il legame C-Cl, e rendendolo un gruppo di partenza migliore e permettendo così al carbonio attaccato di essere attaccato più facilmente dai nucleofili. Nessuna reazione avviene senza l’acido di Lewis.
Nota che qui formiamo C-C e rompiamo C-H.
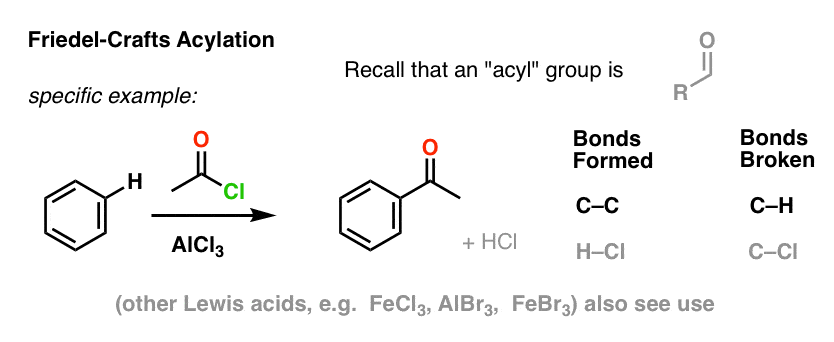
L’acilazione di Friedel-Crafts è simile, ma si inizia con un alogenuro acilico. L’aggiunta del nostro acido di Lewis porta alla formazione di C-C e alla rottura di C-H.
Sommario: Le sei reazioni chiave di sostituzione aromatica elettrofila
Abbiamo mostrato sei reazioni chiave di sostituzione aromatica elettrofila (clorinazione, brominazione, nitrazione, sulfonilazione, e l’alchilazione e acilazione di Friedel-Crafts) e che tutte implicano la rottura di C-H e la formazione di C-E (dove “E” è l’elettrofilo in questione).
Ma conoscere i legami che si formano e si rompono è solo l’inizio.
Ecco alcune domande di cui vorremmo conoscere la risposta:
- In che modo i sostituenti sul benzene influenzano questa reazione? Per esempio, come potrebbero essere influenzate queste reazioni se le eseguissimo sul metilbenzene? o sul fenolo? o sul clorobenzene?
- Come influiscono i sostituenti che donano o che tolgono elettroni sulla velocità della reazione?
- Con il benzene, si può formare solo un prodotto mono-sostituito. Ma cosa succede se partiamo da un prodotto monosostituito e facciamo una sostituzione aromatica elettrofila su di esso? Dove finiscono i sostituenti?
- Come funziona la reazione? Come si spiega la formazione di C-E e la rottura di C-H?
- Che dire di altri gruppi aromatici (oltre il benzene). Come si confrontano le reazioni di sostituzione aromatica elettrofila su pirrolo, piridina, naftalene o altri gruppi?
Nel prossimo post, discuteremo la prima domanda: l’effetto dei sostituenti elettron-donanti e elettron-donanti. Parleremo dei gruppi attivanti e disattivanti.
Next Post: Gruppi attivanti e disattivanti
Grazie per aver letto!
Molti ringraziamenti a Matthew Knowe per l’assistenza con questo post.
Quiz Yourself!
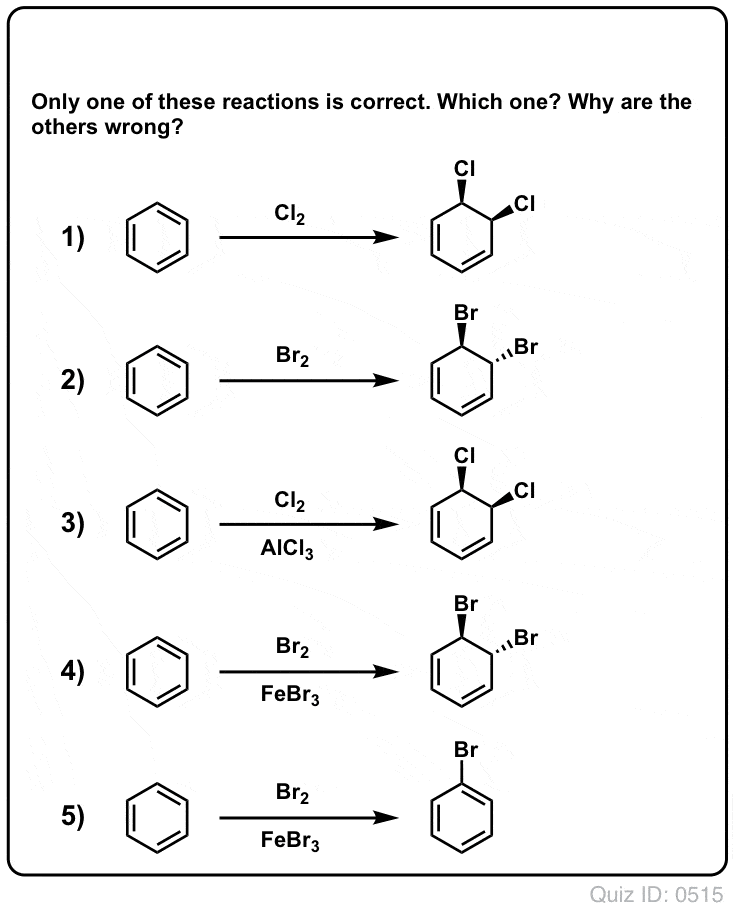 Clicca per lanciare
Clicca per lanciare 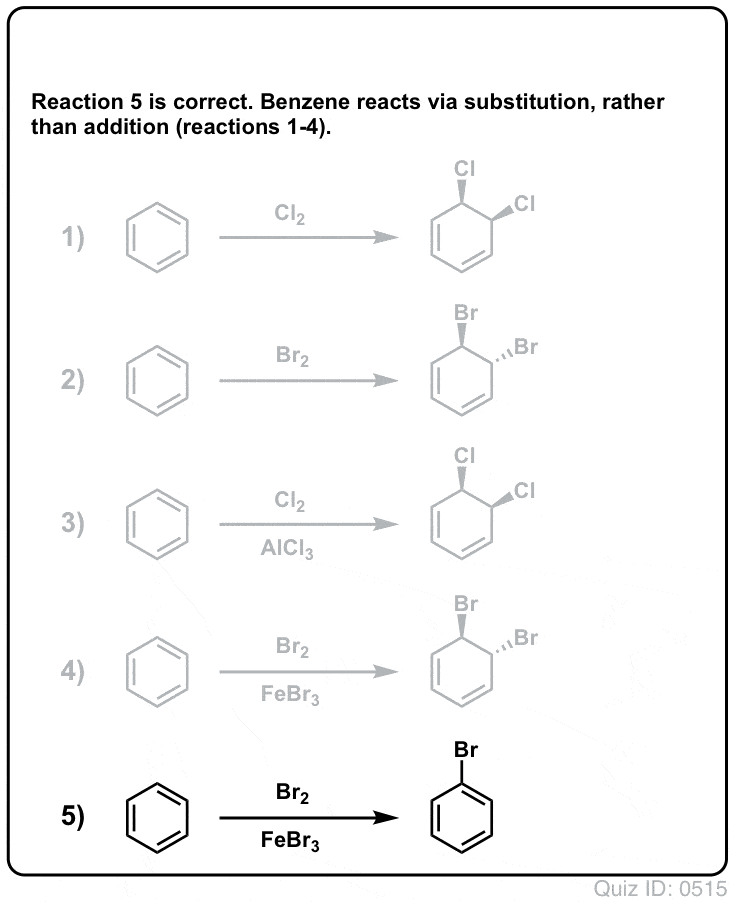
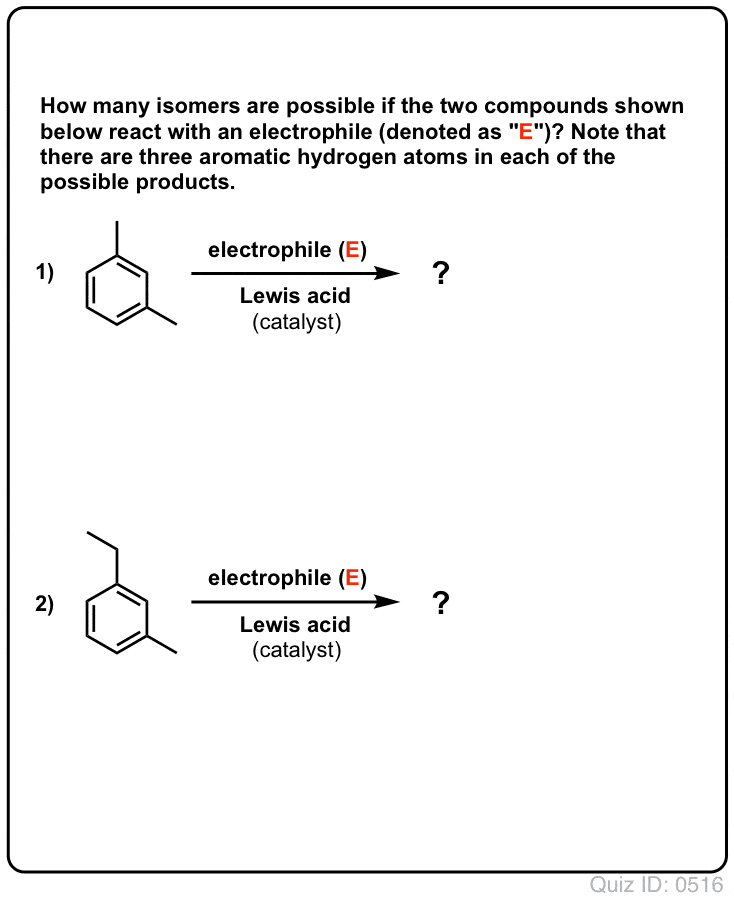 Clicca per capovolgere
Clicca per capovolgere 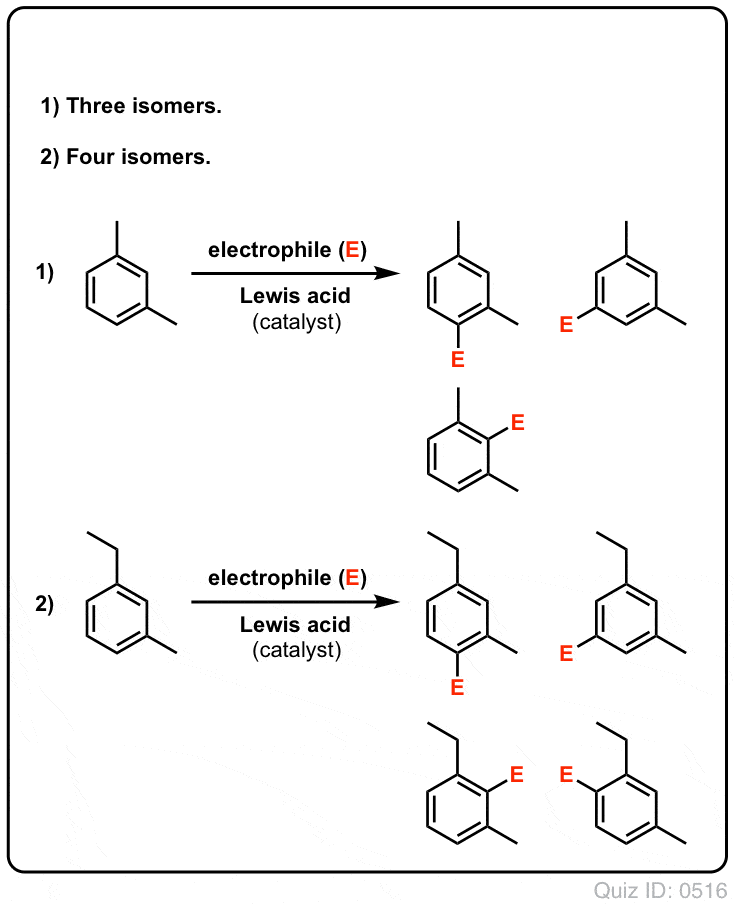
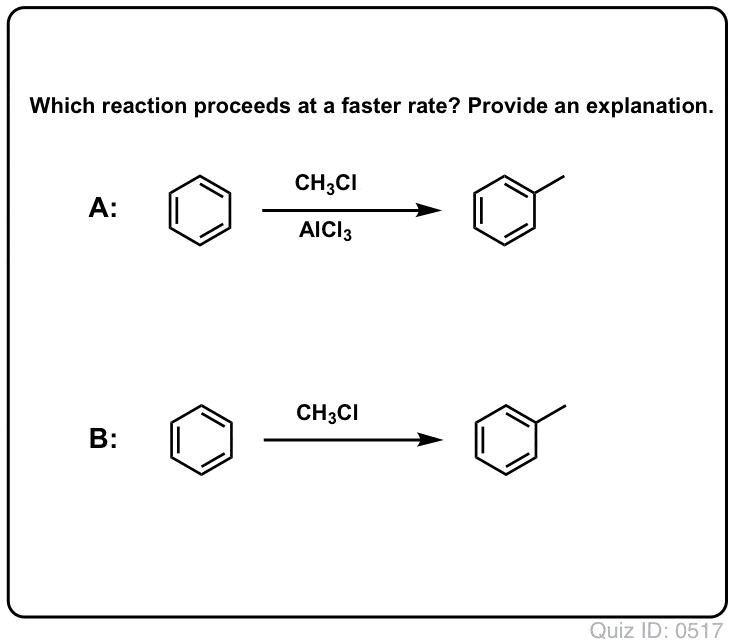 Clicca per capovolgere
Clicca per capovolgere