Las seis reacciones clave de sustitución aromática electrófila
Una reacción clave de los compuestos aromáticos es la sustitución aromática electrófila, en la que se rompe un enlace C-H y se forma un nuevo enlace C-E (siendo E un átomo electrófilo como Cl, Br, N…).
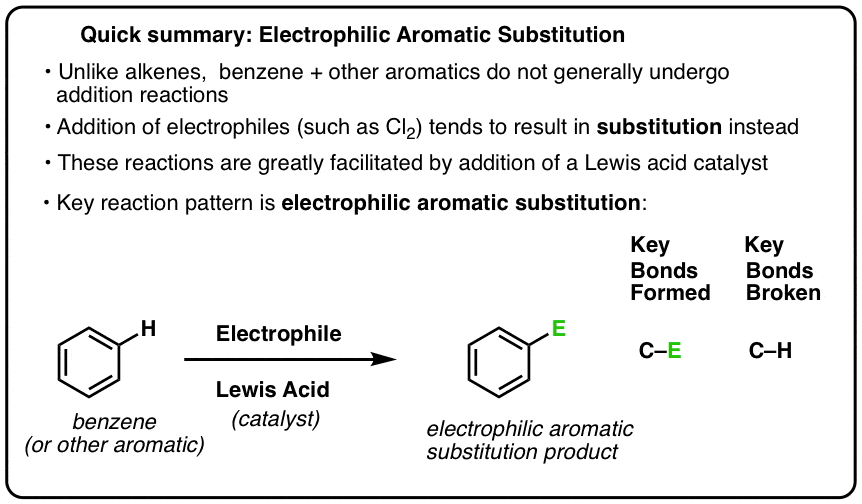
Tabla de contenidos
- Los alquenos dan productos de «adición» al reaccionar con electrófilos. ¿Cómo se compara el benceno?
- Sustitución aromática electrófila
- Los ácidos de Lewis aceleran la velocidad de las reacciones de sustitución aromática electrófila
- El patrón clave para seis importantes reacciones de sustitución aromática electrófila
- Cloración y bromación aromática
- Nitración y sulfonación aromática
- Friedel-Crafts Alkylation and Acylation
- Summary: Las seis reacciones clave de sustitución aromática electrofílica
- ¡Consúltese!
- Los alquenos dan productos de «adición» al reaccionar con electrófilos. ¿Cómo se compara el benceno?
- Sustitución aromática electrófila
- Los ácidos de Lewis aceleran la velocidad de las reacciones de sustitución aromática electrófila
- El patrón clave para seis importantes reacciones de sustitución aromática electrófila
- Cloración y bromación de moléculas aromáticas
- Nitración y Sulfonación de Moléculas Aromáticas
- Alquilación y acilación de Friedel-Crafts
- Resumen: Las seis reacciones clave de sustitución aromática electrófila
- ¡Ponte a prueba!
Los alquenos dan productos de «adición» al reaccionar con electrófilos. ¿Cómo se compara el benceno?
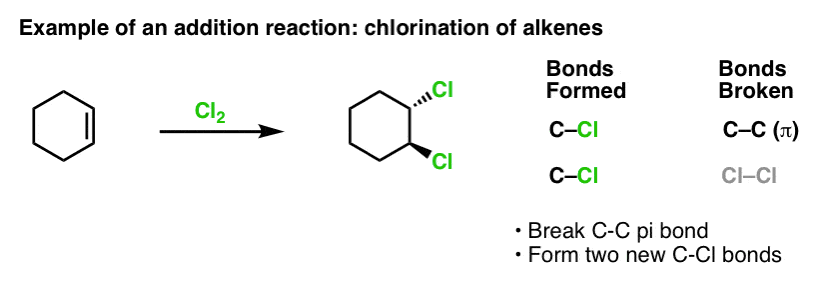
Cuando cubrimos las reacciones de los alquenos hace un tiempo -¡muchas reacciones! – vimos que la gran mayoría caían en la clase de reacciones que llamamos reacciones de adición. En ellas rompemos un enlace (relativamente débil) C-C (pi) y formamos dos nuevos enlaces simples con el carbono. La cloración de los alquenos con Cl2 es un ejemplo clásico:
Ya que estamos en el tema del benceno, es natural preguntarse en qué medida los enlaces pi de los sistemas aromáticos (como el benceno) se comparan en reactividad con los enlaces pi de los alquenos y, por extensión, cómo se comparan las reacciones de los compuestos aromáticos con las de los alquenos.
Hemos visto que el benceno tiene una estabilidad inusual (36 kcal/mol de energía de resonancia) en relación con lo que esperaríamos para el «ciclohexatrieno» teórico, lo que ciertamente nos llevaría a predecir que los enlaces pi en las moléculas aromáticas serán menos reactivos, en relación con los alquenos.
También podría recordar que el propio benceno es inusualmente difícil de hidrogenar. Se puede hacer que el hidrógeno (H2) se añada a través de la mayoría de los alquenos en presencia de una cantidad catalítica de paladio sobre carbono finamente dividido (Pd/C), pero realmente hay que sacar la lata de Whup-Ass® de la marca Aldrich (es decir altas temperaturas, altas presiones de H2 , tiempos de reacción prolongados ) para añadir con éxito H2 al benceno, en relación con los alquenos «típicos».
Sabiendo esto, ¿cómo podríamos esperar que los electrófilos como Cl2 o Br2 reaccionen con compuestos aromáticos como el benceno?
Sustitución aromática electrófila
Nuestra primera suposición podría ser que el benceno reacciona con Cl2 para dar un producto de «adición» como el que se muestra a continuación (aunque más lentamente que con un alqueno «normal»):
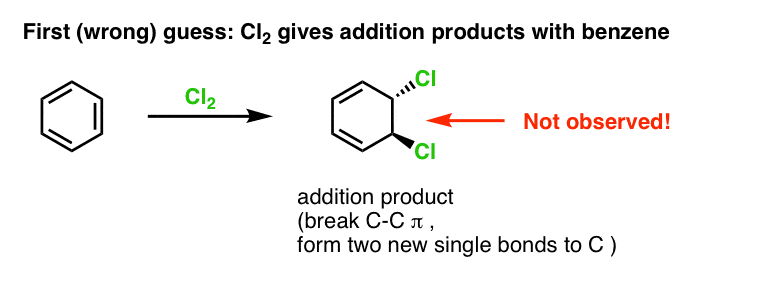
¡Ese no es en realidad el producto que observamos!
En cambio, si tratas el benceno con Cl2 finalmente (y muy lentamente) obtendrás el siguiente producto: clorobenceno.
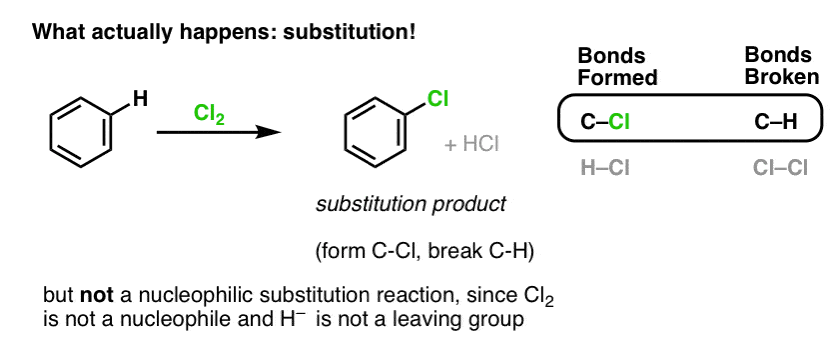
¿Qué enlaces se formaron y qué enlaces se rompieron en esta reacción?
Formamos C-Cl y rompimos C-H . Como los enlaces pi están todos intactos, no se trata de una reacción de adición. Por lo tanto, se trata de un tipo de reacción de sustitución, en la que formamos y rompemos un enlace en un solo carbono.
Hemos visto un ejemplo de reacciones de sustitución antes, pero esas eran sustituciones nucleofílicas, en las que un nucleófilo (por ejemplo RS- ) se añade a un electrófilo de haluro de alquilo (por ejemplo, R-Br), desplazando un grupo saliente (Br- aquí) formando un enlace C-Nuc (C-S en este caso) y rompiendo un enlace C-LG (C-Br aquí).
¿Entonces la reacción del Cl2 con el benceno es igualmente una reacción de sustitución nucleófila? No.
El Cl2 es un nucleófilo extremadamente pobre, reaccionando como donador de electrones sólo con ácidos de Lewis fuertes (por ejemplo, AlCl3, abajo). Cuando se combina incluso con un nucleófilo relativamente suave como el enlace pi en un alqueno, se comporta como un electrófilo (aceptor de electrones) como vimos en su reacción con alquenos.
La reacción del Cl2 con el benceno se denomina por tanto sustitución aromática electrófila (EAS para abreviar):
- Electrofílica, porque estamos añadiendo una especie pobre en electrones (electrófilo),
- a un compuesto aromático (benceno);
- sustitución, porque estamos rompiendo C-H y formando C-E, donde E es nuestro electrófilo (Cl en este caso).
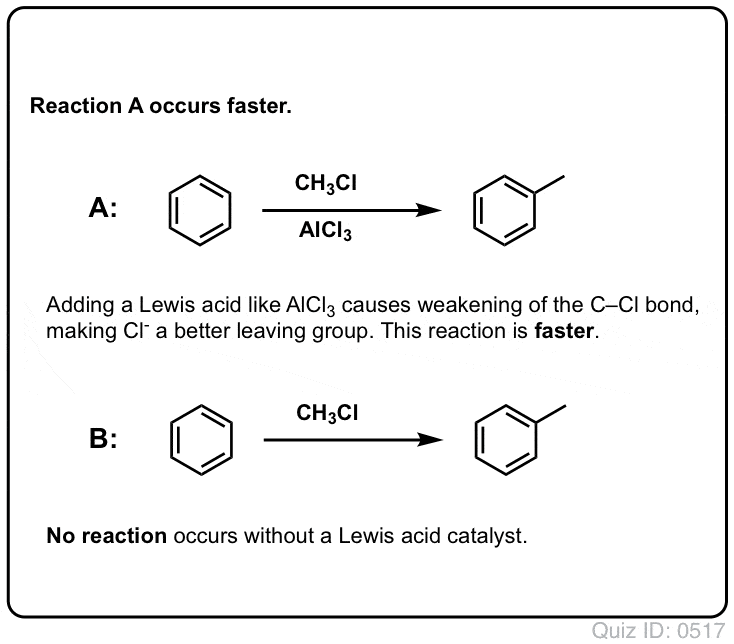
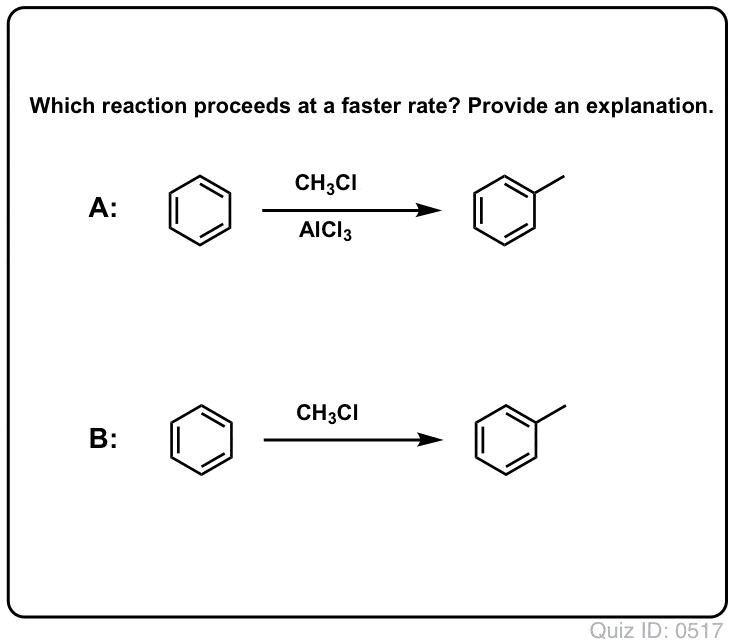
Los ácidos de Lewis aceleran la velocidad de las reacciones de sustitución aromática electrófila
La reacción del Cl2 con el benceno es más rápida que el crecimiento de las uñas de los pies, pero no por mucho (Sin embargo, es mucho más rápida con aromáticos más ricos en electrones como el tolueno y el fenol). Así que en lugar de sentarse en el laboratorio durante semanas esperando a que una reacción se complete, podemos añadir un reactivo que «sopa» la reactividad de Cl2 para convertirlo en un electrófilo aún mejor: un catalizador, en otras palabras.
La adición de un buen ácido de Lewis como AlCl3 o FeCl3 hace el truco. . actualización: ver post sobre el mecanismo
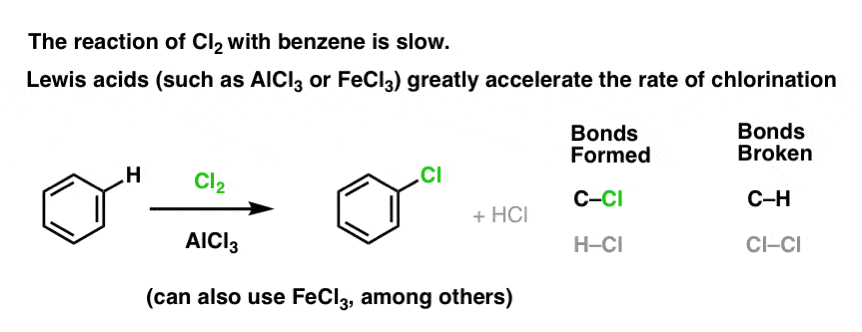
¿Cómo funciona esto?
De nuestra serie sobre alcoholes puede recordar que los alcoholes (R-OH) pueden ser engatusados para participar en reacciones de sustitución y eliminación si se añade un ácido fuerte ( formando R-OH2+ ). Esto se debe a que el ácido conjugado es siempre un mejor grupo saliente; el H2O es una base más débil, y por tanto un grupo saliente mucho mejor, que el HO- . El etanol por sí mismo nunca reaccionará con el NaCl para dar cloruro de etilo, porque el grupo saliente HO- resultante es una base demasiado fuerte en relación con el Cl- para que la reacción proceda en alguna medida. Pero si convertimos el alcohol en su ácido conjugado R-OH2 + con un ácido fuerte como el HCl, la reacción puede entonces proceder, ya que el Cl- está desplazando a la base mucho más débil H2O.
Puede ser útil pensar en el H+ como un debilitamiento del enlace C-O, y así hacer que el carbono unido a él sea un mejor electrófilo.
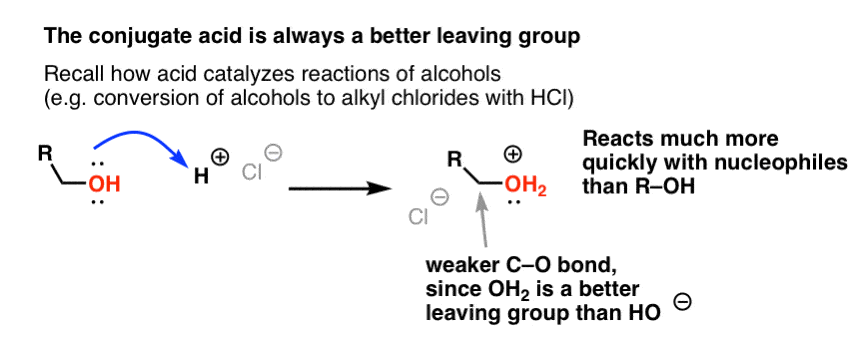
Así como el ácido «ceba» el carbono unido al grupo OH para una reacción posterior convirtiendo el grupo hidroxilo en su ácido conjugado, los ácidos de Lewis hacen la misma magia sobre el Cl2 (y para ello, todas las reacciones de sustitución aromática electrófila que cubriremos implicarán algún tipo de catálisis ácida).
En el caso de la cloración, el ácido de Lewis (AlCl3, abajo) acepta un par de electrones del Cl2. Esto debilita el enlace Cl-Cl, convirtiéndolo en un nucleófilo aún mejor. El ataque de un nucleófilo en el Cl distal liberará no Cl- , sino la base aún más débil (y por lo tanto, mejor grupo saliente) AlCl4(-).
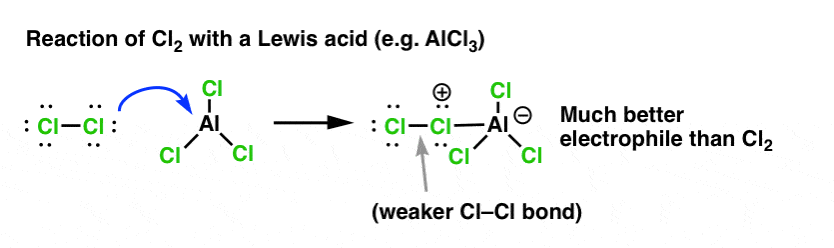
La adición de un ácido de Lewis (que, recordemos, incluye los ácidos de Brønsted como el H2SO4 ) es un hilo común en las seis sustituciones aromáticas electrofílicas clave que generalmente se cubren en la química orgánica introductoria.
El patrón clave para seis importantes reacciones de sustitución aromática electrófila
En esta sección, presentaremos estas seis reacciones clave de sustitución aromática electrófila, que se agrupan muy bien en tres pares:
- cloración y bromación
- nitración y sulfonilación
- Alquilación de Friedel-Crafts y acilación de Friedel-Crafts
No vamos a entrar todavía en los mecanismos. El punto aquí es sólo para seguir lo que los enlaces se forman y se rompen, para que usted vea el patrón clave.
Aquí está:
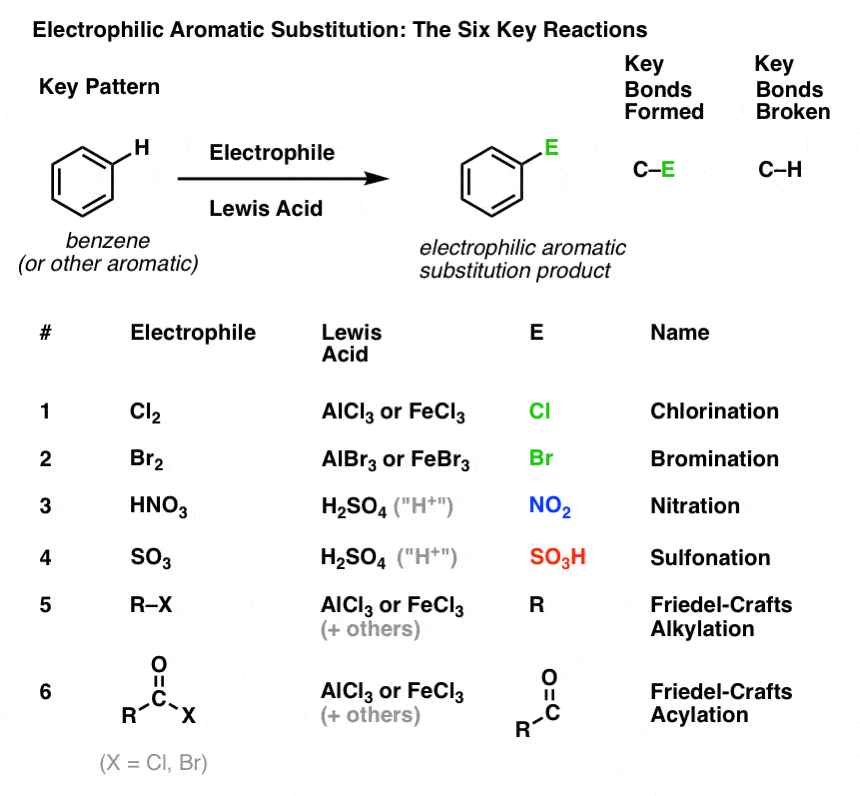
Cloración y bromación de moléculas aromáticas
Hemos visto la cloración (arriba); la bromación es muy similar. Dado que el Br2 por sí mismo no es un electrófilo lo suficientemente fuerte como para reaccionar con el benceno a una velocidad razonable, utilizamos un ácido de Lewis como AlBr3 o FeBr3 para acelerar la reacción. .
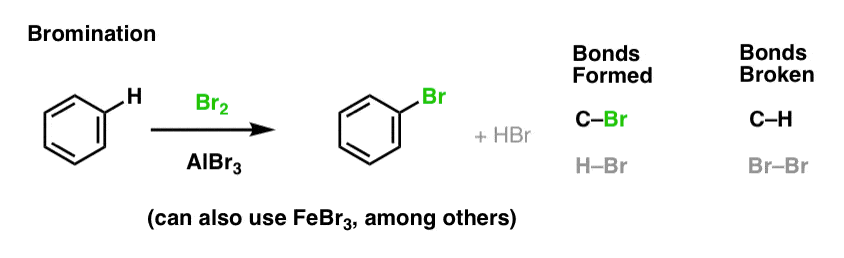
Nitración y Sulfonación de Moléculas Aromáticas
La nitración (sustitución de H por un grupo NO2) no es una reacción que vimos en nuestra sección sobre alquenos, pero es una reacción popular con moléculas aromáticas como el benceno. Es la reacción por la que el metilbenceno (tolueno) se convierte en 2,4,6-trinitrotolueno. Es probable que esté más familiarizado con esta molécula como el alto explosivo TNT.
La nitración es la sustitución de H por NO2, utilizando ácido nítrico (HNO3) como fuente de NO2 y ácido sulfúrico (H2SO4) como ácido de Lewis:
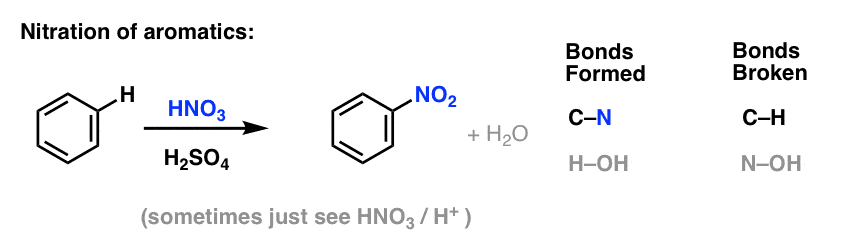
La sulfonación (sustitución de H por un grupo SO3H) también resulta ser una reacción útil. Puede realizarse añadiendo trióxido de azufre (SO3) en presencia de ácido sulfúrico (H2SO4) como ácido de Lewis:
Alquilación y acilación de Friedel-Crafts
En las cuatro reacciones anteriores, observamos la formación de C-Cl, C-Br, C-N y C-S.
También es posible formar enlaces carbono-carbono en moléculas aromáticas añadiendo haluros de alquilo o de acilo en presencia de ácidos de Lewis. Estas reacciones se conocen como reacciones de Friedel-Crafts, en honor a sus inventores (la reacción se remonta a 1877).
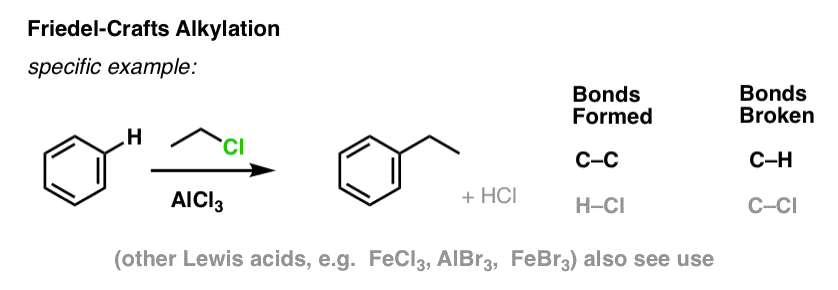
En la alquilación de Friedel-Crafts, comenzamos con un haluro de alquilo «R-X» como CH3CH2Cl y luego añadimos un ácido de Lewis como AlCl3 o FeCl3 . Al igual que con el Cl2, el ácido de Lewis acelera la reacción al coordinarse con el halógeno, debilitando el enlace C-Cl y convirtiéndolo en un mejor grupo saliente y permitiendo así que el carbono unido sea atacado más fácilmente por los nucleófilos. No se produce ninguna reacción sin el ácido de Lewis.
Nótese que aquí formamos el C-C y rompemos el C-H.
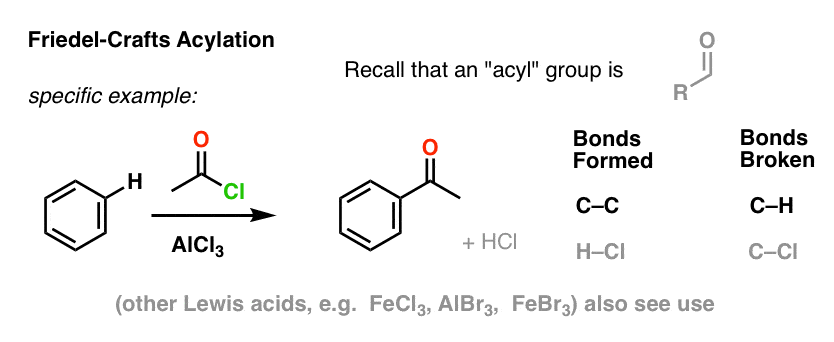
La acilación de Friedel-Crafts es similar, pero empezamos con un haluro de acilo. La adición de nuestro ácido de Lewis da lugar a la formación de C-C y a la ruptura de C-H.
Resumen: Las seis reacciones clave de sustitución aromática electrófila
Hemos mostrado seis reacciones clave de sustitución aromática electrófila (cloración, bromación, nitración, sulfonilación, y la alquilación y acilación de Friedel-Crafts) y que todas implican la ruptura de C-H y la formación de C-E (donde «E» es el electrófilo en cuestión).
Pero conocer los enlaces que se forman y rompen es sólo el principio.
Aquí hay algunas preguntas cuya respuesta nos gustaría conocer:
- ¿Cómo afectan los sustituyentes del benceno a esta reacción? Por ejemplo, ¿cómo se verían afectadas estas reacciones si las realizáramos con metilbenceno? o con fenol? o con clorobenceno?
- ¿Cómo afectan los sustituyentes que donan o retiran electrones a la velocidad de la reacción?
- Con el benceno, sólo se puede formar un producto monosustituido. Pero, ¿qué pasa si empezamos con un producto monosustituido y hacemos una sustitución aromática electrofílica en él? ¿Dónde terminan los sustituyentes?
- ¿Cómo funciona la reacción? ¿Cómo se explica la formación de C-E y la ruptura de C-H?
- ¿Qué pasa con otros grupos aromáticos (más allá del benceno). ¿Cómo se comparan las reacciones de sustitución aromática electrofílica en el pirrol, la piridina, el naftaleno u otros grupos?
En el próximo post, discutiremos la primera pregunta: el efecto de los sustituyentes donadores y retiradores de electrones. Hablaremos de los grupos activadores y desactivadores.
Siguiente post: Grupos activadores y desactivadores
¡Gracias por leer!
Muchas gracias a Matthew Knowe por su ayuda en este post.
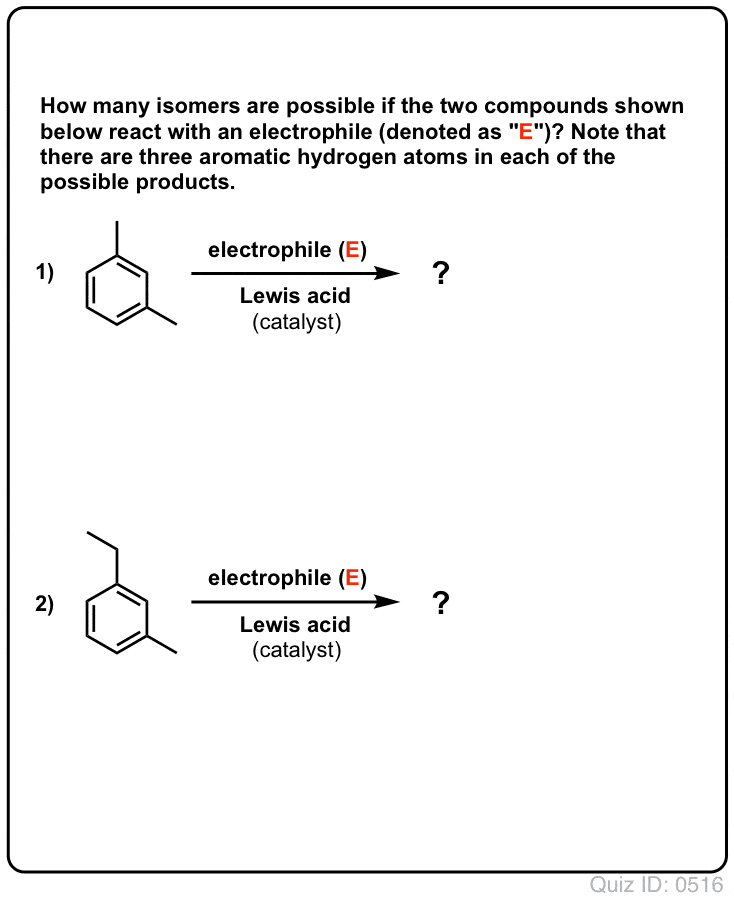
¡Ponte a prueba!
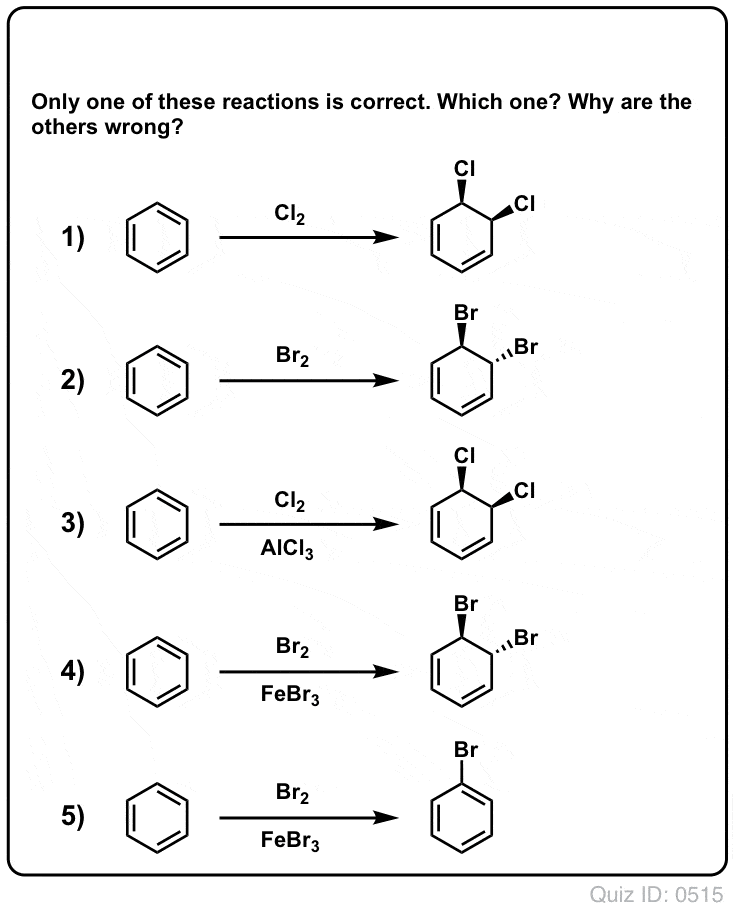 Haz clic para voltear
Haz clic para voltear 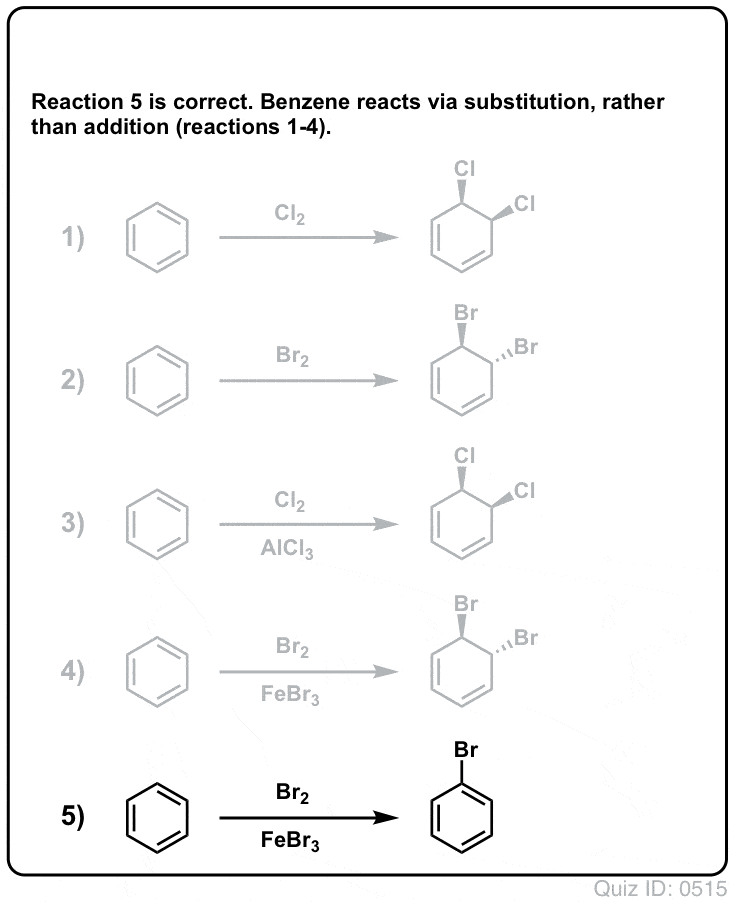
 Click to Flip
Click to Flip 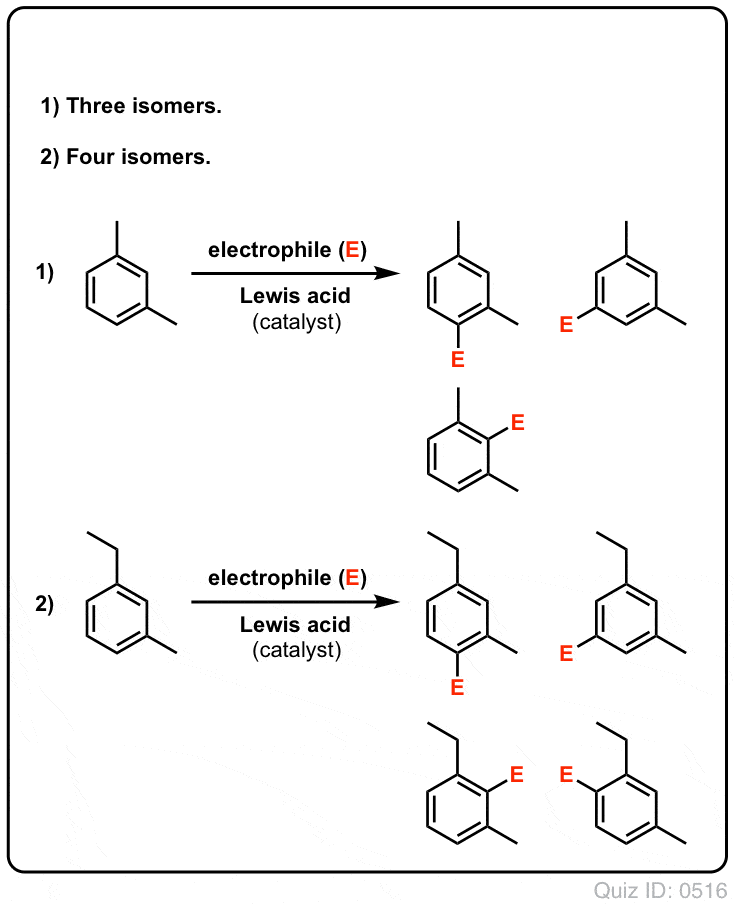
 Click to Flip
Click to Flip