Cele șase reacții cheie de substituție aromatică electrofilă
O reacție cheie a compușilor aromatici este substituția aromatică electrofilă, în care se rupe o legătură C-H și se formează o nouă legătură C-E (E fiind un atom electrofil, cum ar fi Cl, Br, N…).
Tabel de materii
- Alchenele dau produse de „adiție” la reacția cu electrofile. Deci, cum se compară benzenul?
- Substituția aromatică electrofilă
- Acizii Lewis accelerează rata reacțiilor de substituție aromatică electrofilă
- Planul cheie pentru șase reacții importante de substituție aromatică electrofilă
- Clorurarea și bromurarea aromatică
- Naturarea și sulfonarea aromatică
- Friedel-Crafts Alchilare și acilare
- Rezumat: Cele șase reacții cheie de substituție aromatică electrofilă
- Întrebați-vă pe voi înșivă!
- Alchenele dau produse de „adiție” la reacția cu electrofile. Deci, cum se compară benzenul?
- Substituție aromatică electrofilă
- Acizii Lewis accelerează viteza reacțiilor de substituție aromatică electrofilă
- Schema cheie pentru șase reacții importante de substituție aromatică electrofilă
- Clorurarea și bromurarea moleculelor aromatice
- Nitrarea și sulfonarea moleculelor aromatice
- Alchilarea și acilarea Friedel-Crafts
- Rezumat: Cele șase reacții cheie de substituție aromatică electrofilă
- Testează-te pe tine însuți!
Alchenele dau produse de „adiție” la reacția cu electrofile. Deci, cum se compară benzenul?
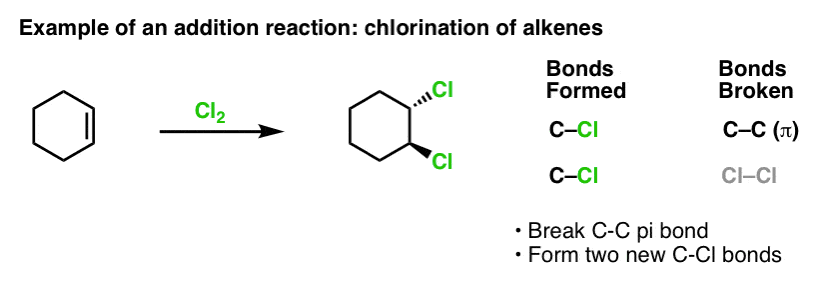
Când am abordat reacțiile alchenelor cu ceva timp în urmă – o mulțime de reacții! – am văzut că marea majoritate se încadrează în clasa de reacții pe care le numim reacții de adiție. Adică atunci când rupem o legătură (relativ slabă) C-C (pi) și formăm două noi legături simple cu carbonul. Clorurarea alchenelor cu Cl2 este un exemplu clasic:
Dacă tot suntem la subiectul benzenului, este firesc să ne întrebăm cât de bine se compară reactivitatea legăturilor pi din sistemele aromatice (cum ar fi benzenul) cu cea a legăturilor pi din alchene și, prin extensie, cum se compară reacțiile compușilor aromatici cu cele ale alchenelor.
Am văzut că benzenul are o stabilitate neobișnuită (36 kcal/mol de energie de rezonanță) în raport cu ceea ce ne-am aștepta pentru „ciclohexatriena” teoretică, ceea ce ne-ar conduce cu siguranță să prezicem că legăturile pi din moleculele aromatice vor fi mai puțin reactive, în raport cu alchenele.
S-ar putea să vă amintiți, de asemenea, că benzenul însuși este neobișnuit de dificil de hidrogenat. Hidrogenul (H2) poate fi făcut să se adauge peste majoritatea alchenelor în prezența unei cantități catalitice de paladiu fin divizat pe carbon (Pd/C), dar trebuie neapărat să scoateți cutia de Whup-Ass® marca Aldrich (i.e. temperaturi ridicate, presiuni ridicate de H2 , timpi de reacție prelungiți ) pentru a reuși să adaugi cu succes H2 la benzen, în raport cu alchenele „tipice”.
Cunoscând acest lucru, cum ne-am putea aștepta ca electrofilii precum Cl2 sau Br2 să reacționeze cu compuși aromatici precum benzenul?
Substituție aromatică electrofilă
Prima noastră presupunere ar putea fi că benzenul reacționează cu Cl2 pentru a da un produs de „adiție” ca cel prezentat mai jos (deși mai lent decât în cazul unei alchene „normale”):
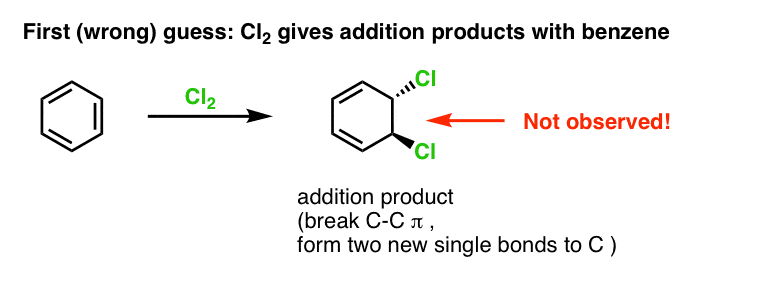
De fapt, acesta nu este produsul pe care îl observăm!
În schimb, dacă tratați benzenul cu Cl2 veți obține în cele din urmă (și foarte lent) următorul produs: clorobenzen.
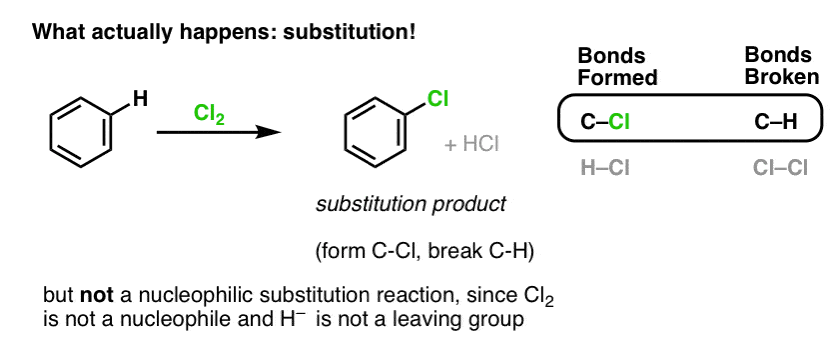
Ce legături s-au format și ce legături s-au rupt în această reacție?
Am format C-Cl și am rupt C-H . Deoarece legăturile pi sunt toate intacte, aceasta nu este o reacție de adiție. În schimb, aceasta este, prin urmare, un tip de reacție de substituție, în care formăm și rupem o legătură pe un singur carbon.
Am mai văzut un exemplu de reacții de substituție înainte, dar acelea erau substituții nucleofile, în care un nucleofil (de ex. RS- ) este adăugat la un electrofil al unei halogenuri de alchil (de exemplu, R-Br), deplasând o grupare care pleacă (Br- aici) formând o legătură C-Nuc (C-S în acest caz) și rupând o legătură C-LG (C-Br aici).
Așa că reacția Cl2 cu benzenul este, de asemenea, o reacție de substituție nucleofilă? Nu!
Cl2 este un nucleofil extrem de slab, reacționând ca donator de electroni doar cu acizi Lewis puternici (de exemplu, AlCl3, mai jos). Atunci când este combinat chiar și cu un nucleofil relativ slab, cum ar fi legătura pi dintr-o alchenă, se comportă ca un electrofil (acceptor de electroni), așa cum am văzut în reacția sa cu alchenele.
Reacția Cl2 cu benzenul se numește astfel o substituție aromatică electrofilă (EAS pe scurt):
- Electrofilă, pentru că adăugăm o specie săracă în electroni (electrofil),
- la un compus aromatic (benzen);
- substituție, pentru că rupem C-H și formăm C-E, unde E este electrofilul nostru (Cl în acest caz).
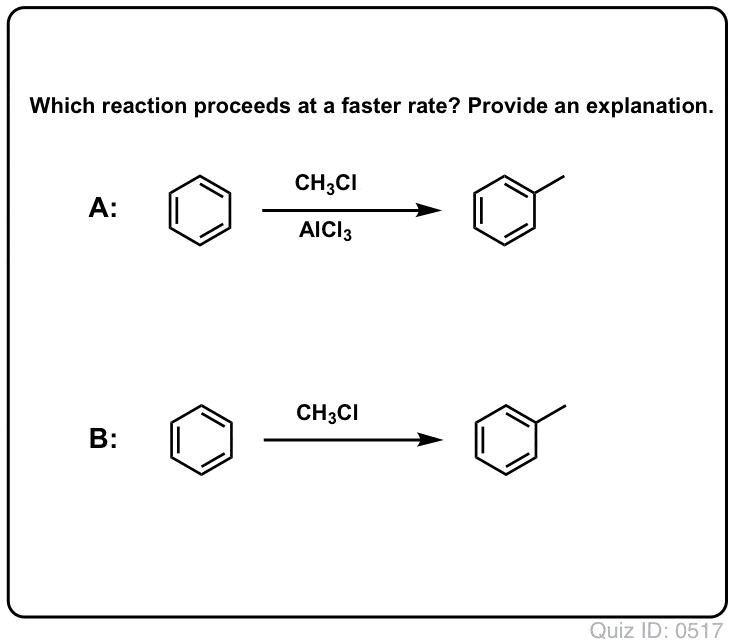
Acizii Lewis accelerează viteza reacțiilor de substituție aromatică electrofilă
Reacția lui Cl2 cu benzenul este mai rapidă decât creșterea unghiilor de la picioare, dar nu cu mult (Este, totuși, mult mai rapidă cu substanțe aromatice mai bogate în electroni, cum ar fi toluenul și fenolul). Așadar, în loc să stăm în laborator săptămâni întregi așteptând ca o reacție să se finalizeze, putem adăuga un reactiv care să „acutizeze” reactivitatea Cl2 pentru a-l transforma într-un electrofil și mai bun: cu alte cuvinte, un catalizator.
Adăugarea unui acid Lewis bun, cum ar fi AlCl3 sau FeCl3, face treaba. . update: vezi postarea despre mecanism
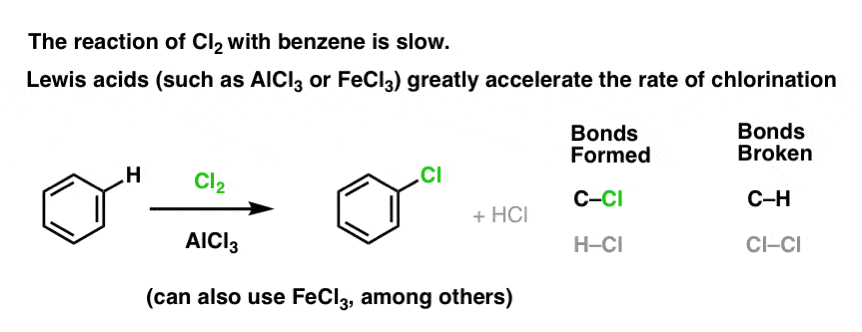
Cum funcționează acest lucru?
Din seria noastră despre alcooli vă amintiți probabil că alcoolii (R-OH) pot fi convinși să participe la reacții de substituție și eliminare dacă se adaugă un acid puternic ( formând R-OH2+ ). Acest lucru se datorează faptului că acidul conjugat este întotdeauna o grupare de plecare mai bună; H2O este o bază mai slabă și, prin urmare, o grupare de plecare mult mai bună decât HO- . Etanolul însuși nu va reacționa niciodată cu NaCl pentru a da clorură de etil, deoarece grupul de plecare rezultat HO- este o bază prea puternică în raport cu Cl- pentru ca reacția să aibă loc în orice măsură. Dar dacă transformăm alcoolul în acidul său conjugat R-OH2 + cu un acid puternic, cum ar fi HCl, reacția poate avea loc, deoarece Cl- înlocuiește baza mult mai slabă H2O.
Este util să ne gândim că H+ slăbește legătura C-O și, astfel, face din carbonul atașat la aceasta un electrofil mai bun.
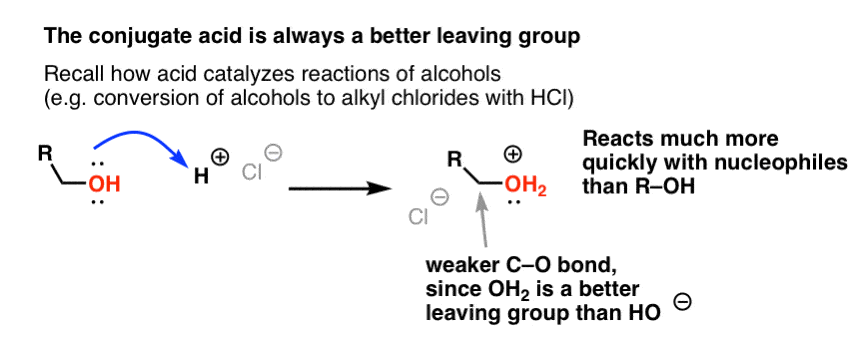
La fel cum acidul „pregătește” carbonul atașat la gruparea OH pentru o reacție ulterioară prin transformarea grupării hidroxil în acidul său conjugat, acizii Lewis acționează în mod similar aceeași magie asupra Cl2 (și, de altfel, toate reacțiile de substituție aromatică electrofilă pe care le vom aborda vor implica un anumit tip de cataliză acidă).
În cazul clorurării, acidul Lewis (AlCl3, mai jos) acceptă o pereche de electroni de la Cl2. Acest lucru slăbește legătura Cl-Cl, transformându-l într-un nucleofil și mai bun. Atacul de către un nucleofil la Cl distal va elibera nu Cl- , ci baza și mai slabă (și, prin urmare, un grup de plecare mai bun) AlCl4(-).
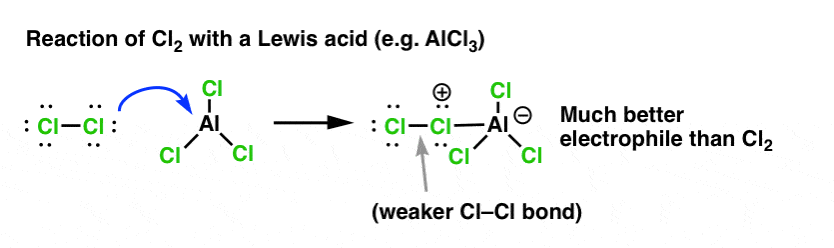
Aducerea unui acid Lewis (care, reamintim, include acizii Brønsted, cum ar fi H2SO4 ) este un fir comun în cele șase substituții aromatice electrofile cheie care sunt în general tratate în cadrul cursului introductiv de chimie organică.
Schema cheie pentru șase reacții importante de substituție aromatică electrofilă
În această secțiune, vom prezenta aceste șase reacții cheie de substituție aromatică electrofilă, care se grupează frumos în trei perechi:
- clorare și bromurare
- nitratare și sulfonilare
- alchilare Friedel-Crafts și acilare Friedel-Crafts
Nu vom intra încă în mecanisme. Ideea aici este doar să urmăriți ce legături se formează și se rup, astfel încât să vedeți modelul cheie.
Iată-l:
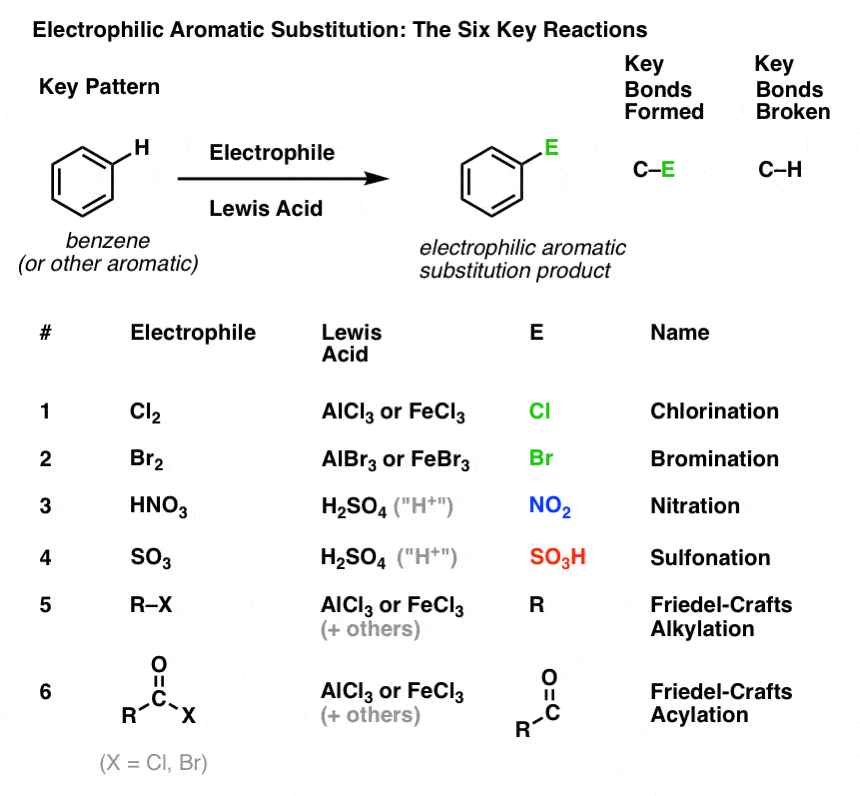
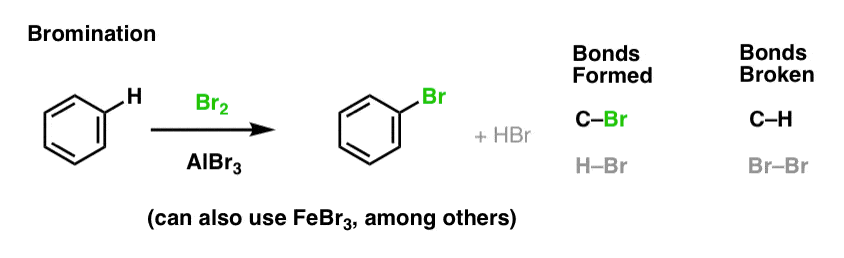
Clorurarea și bromurarea moleculelor aromatice
Am văzut clorurarea (mai sus); bromurarea este foarte asemănătoare. Deoarece Br2 de unul singur nu este un electrofil suficient de puternic pentru a reacționa cu benzenul cu o viteză rezonabilă, folosim un acid Lewis, cum ar fi AlBr3 sau FeBr3, pentru a accelera reacția. .
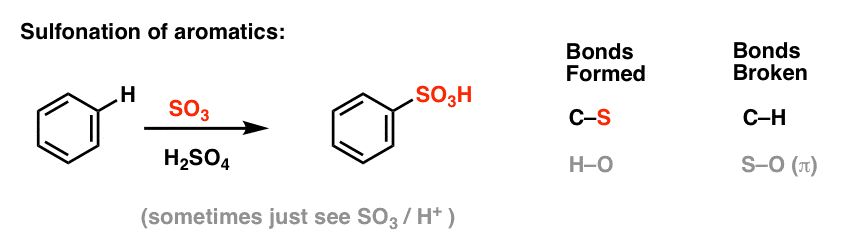
Nitrarea și sulfonarea moleculelor aromatice
Nitrarea (înlocuirea lui H cu o grupare NO2) nu este o reacție pe care am văzut-o în secțiunea noastră despre alchene, dar este o reacție populară cu moleculele aromatice cum ar fi benzenul. Aceasta este reacția prin care metilbenzenul (toluenul) este transformat în 2,4,6-trinitrotoluen. Probabil că sunteți mai familiarizați cu această moleculă ca fiind explozivul de mare putere TNT.
Nitrarea este înlocuirea lui H cu NO2, folosind acidul azotic (HNO3) ca sursă de NO2 și acidul sulfuric (H2SO4) ca acid Lewis:
Sulfonarea (înlocuirea lui H cu o grupare SO3H) se dovedește, de asemenea, a fi o reacție utilă. Ea poate fi realizată prin adăugarea de trioxid de sulf (SO3) în prezența acidului sulfuric (H2SO4) ca acid Lewis:
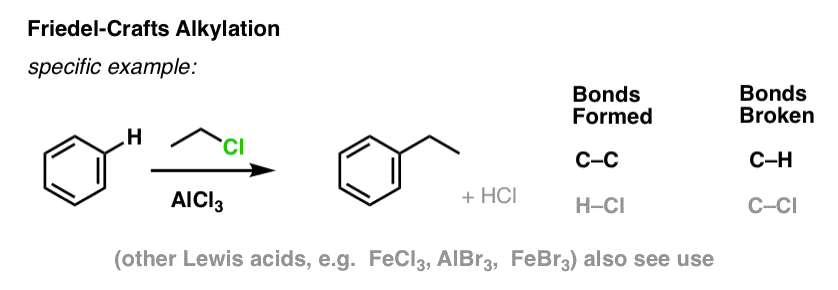
Alchilarea și acilarea Friedel-Crafts
În cele patru reacții de mai sus, am observat formarea de C-Cl, C-Br, C-N și C-S.
Este, de asemenea, posibil să se formeze legături carbon-carbon la moleculele aromatice prin adăugarea de halogenuri de alchil sau acil în prezența acizilor Lewis. Aceste reacții sunt cunoscute sub numele de reacții Friedel-Crafts, după numele inventatorilor lor (reacția datează din 1877).
În alchilarea Friedel-Crafts, începem cu o halogenură de alchil „R-X”, cum ar fi CH3CH2Cl și apoi adăugăm un acid Lewis, cum ar fi AlCl3 sau FeCl3 . La fel ca și în cazul Cl2, acidul Lewis accelerează reacția prin coordonarea cu halogenul, slăbind legătura C-Cl și făcându-l o grupare de plecare mai bună și permițând astfel ca carbonul atașat să fie atacat mai ușor de nucleofili. Nici o reacție nu are loc fără acidul Lewis.
Rețineți că aici formăm C-C și rupem C-H.
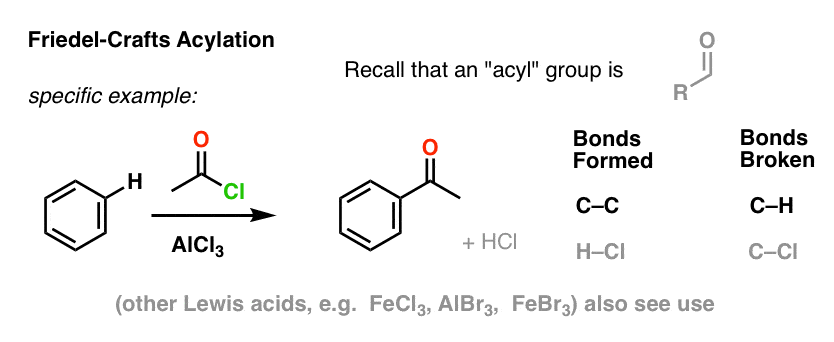
Acilația Friedel-Crafts este similară, dar începem cu o halogenură de aciil. Adăugarea acidului nostru Lewis are ca rezultat formarea de C-C și ruperea de C-H.
Rezumat: Cele șase reacții cheie de substituție aromatică electrofilă
Am arătat șase reacții cheie de substituție aromatică electrofilă (clorinare, brominare, nitrare, sulfonilare și alchilarea și acilarea Friedel-Crafts) și faptul că toate implică ruperea lui C-H și formarea lui C-E (unde „E” este electrofilul în cauză).
Dar cunoașterea legăturilor care se formează și se rup este doar începutul.
Iată câteva întrebări la care am dori să aflăm răspunsul:
- Cum afectează substituenții de pe benzen această reacție? De exemplu, cum ar putea fi afectate aceste reacții dacă le-am efectua pe metilbenzen? sau fenol? sau clorobenzen?
- Cum influențează substituenții donatori de electroni sau retractori de electroni viteza reacției?
- Cu benzenul, este posibil să se formeze un singur produs monosubstituit. Dar ce se întâmplă dacă pornim de la un produs monosubstituit și facem o substituție aromatică electrofilă asupra acestuia? Unde ajung substituenții?
- Cum funcționează reacția? Cum explicăm formarea lui C-E și ruperea lui C-H?
- Ce se întâmplă cu alte grupări aromatice (în afară de benzen). Cum se compară reacțiile de substituție aromatică electrofilă asupra pirrolului, piridinei, naftalinei sau a altor grupări?
În următoarea postare, vom discuta prima întrebare: efectul substituenților donatori și retractori de electroni. Vom vorbi despre grupele activatoare și dezactivatoare.
Postul următor: Activarea și dezactivarea grupurilor
Mulțumim pentru lectură!
Mulțumiri lui Matthew Knowe pentru ajutorul acordat la această postare.
Testează-te pe tine însuți!
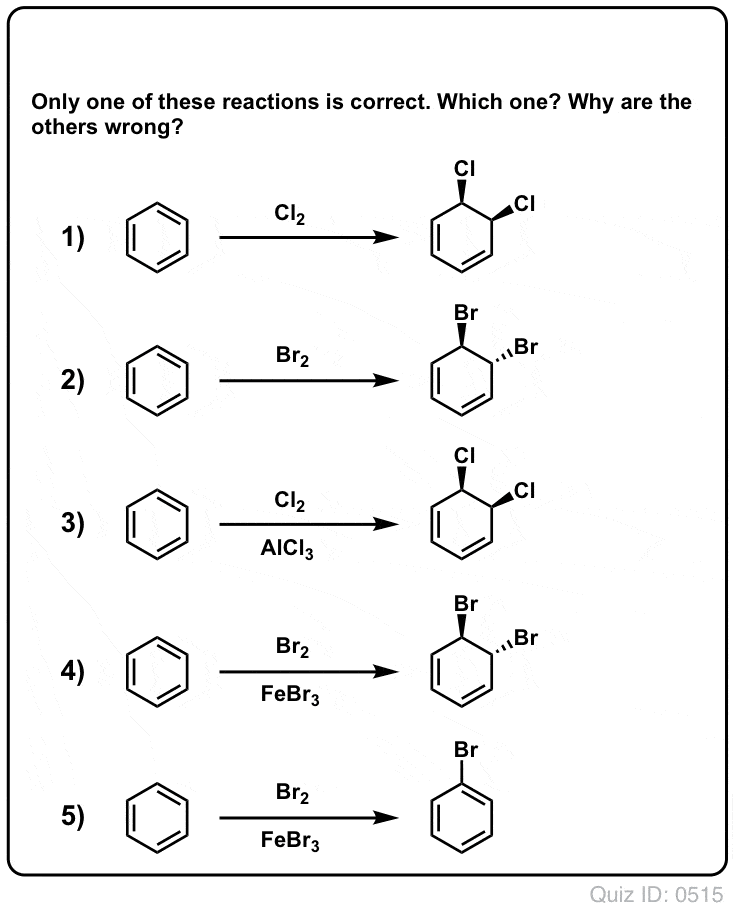 Click to Flip
Click to Flip 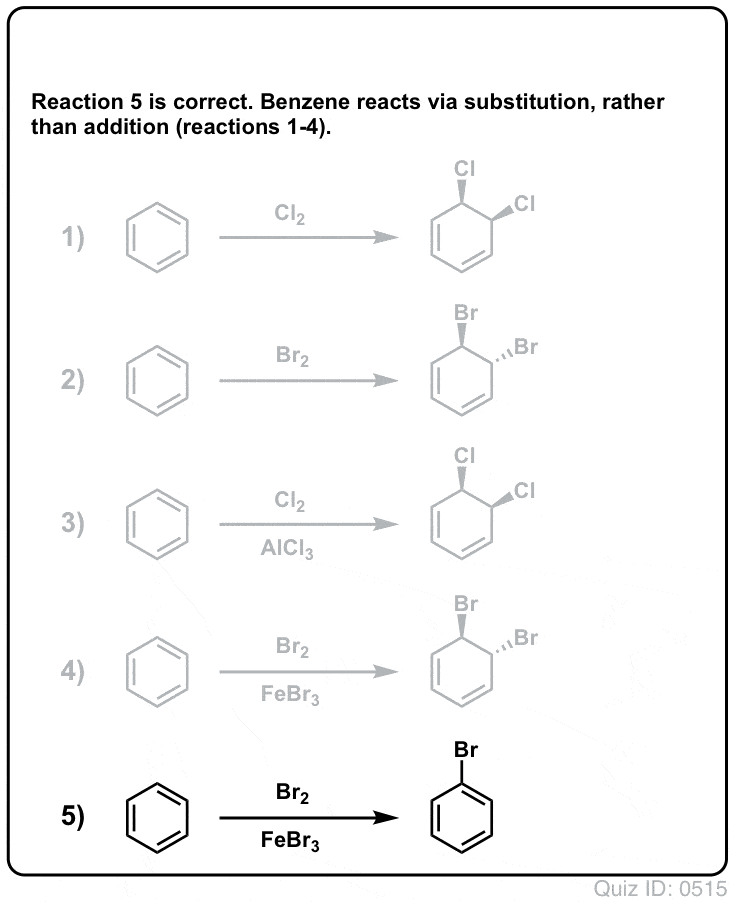
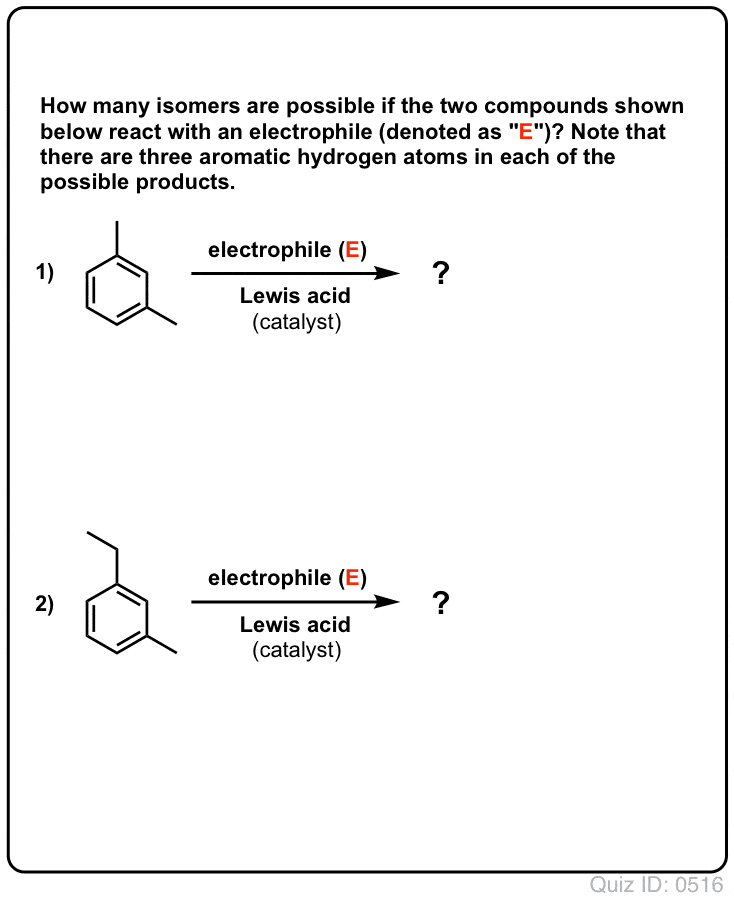 Click to Flip
Click to Flip 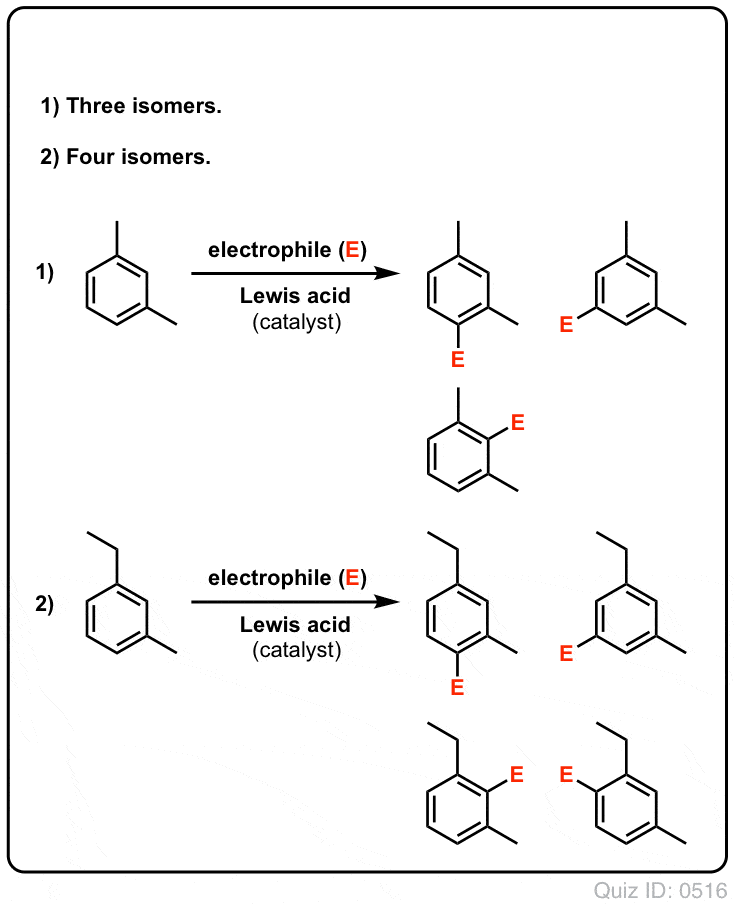
 Click to Flip
Click to Flip 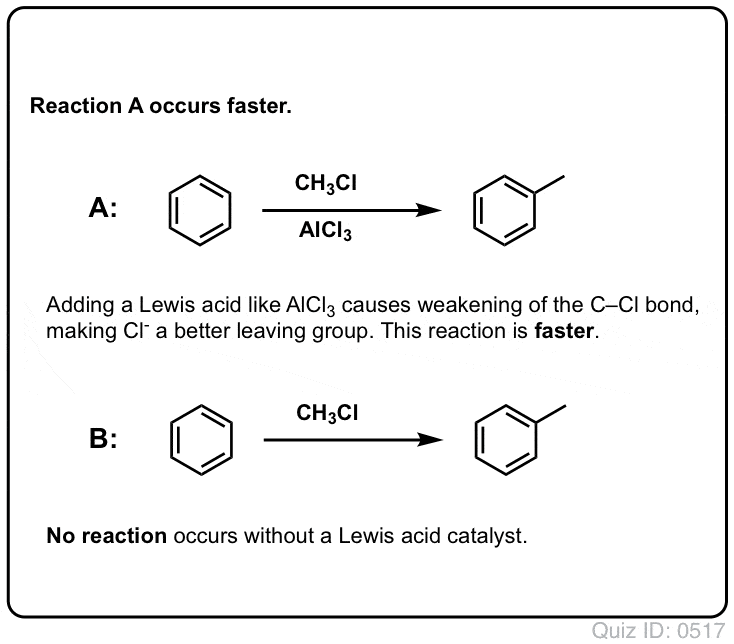
.