Chemiosmosis, Proton Motive Force, and Oxidative Phosphorylation
ETSを通して電子が移動するたびに電子はエネルギーを失いますが、いくつかの移動ではそのエネルギーを使って水素イオン(H+)を膜越しに送り出し、位置エネルギーとして蓄えられます。 原核細胞では、H+は細胞質膜の外側(グラム陰性菌やグラム陽性菌ではペリプラズム腔と呼ばれる)に、真核細胞ではミトコンドリアマトリックスからミトコンドリア内膜を越えて膜間腔に汲み上げられる。 H+イオンはプラスに帯電しており(電気的)、膜の片側で濃度が高い(化学的)ため、膜を挟んでH+が偏在し、電気化学的勾配が確立される。 このように膜の片側にH+(プロトンとも呼ばれる)が蓄積して形成される電気化学的勾配をプロトン起電力(PMF)と呼ぶことにしている。 イオンがH+であるため、H+の濃度が高い側の膜が酸性になるというpH勾配も形成される。 この章で説明したように、ATPを作るためにPMFを使用する以外にも、栄養輸送や運動のための鞭毛回転など、エネルギー的に不利なプロセスを駆動するためにPMFを使用することができる。
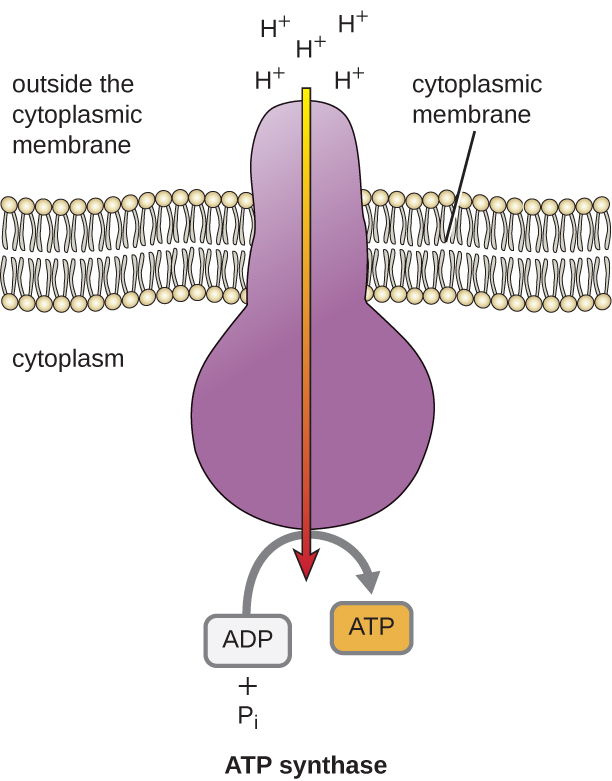
ETSによって発生したこの電気化学勾配の位置エネルギーは、膜(原核細胞では細胞膜、真核細胞ではミトコンドリア内膜)を越えてH+が拡散するようにする。 この膜を横切る水素イオンの流れは化学浸透と呼ばれ、ATP合成酵素という膜結合型酵素複合体を介して膜内のチャネルを通過する必要があります(図(㊦))。 このような運動の傾向は、ダムの片側に溜まった水が、開放されるとダムの中を移動するのとよく似ている。 ATP合成酵素は(水力発電のダムの取水口と発電機を合わせたような)複雑なタンパク質で、酵素の中を拡散するH+の力で、互いに反発し合うH+が多いところから少ないところへ、その電気化学的勾配を下って回る、小さな発電機の役割を担っているのです。 原核細胞では、H+は細胞質膜の外側から細胞質内へ流れるが、真核生物のミトコンドリアでは、H+は膜間部からミトコンドリアマトリックスへ流れる。 この分子機械の部品の回転により、ADPと無機リン酸(Pi)から酸化的リン酸化によってATPが再生される。電気化学的勾配の中に蓄えられた位置エネルギーを収穫するATPを作る第2のメカニズムである
グルコースの異化作用から生成されるATP分子の数は様々である。 例えば、電子輸送系複合体が膜を通して送り出すことのできる水素イオンの数は、生物の種類によって異なる。 ミトコンドリアでの好気呼吸では、1分子のNADHから電子が通過すると、酸化的リン酸化により3分子のATPを作るのに十分なプロトン運動力が発生するが、1分子のFADH2から電子が通過すると、2分子のATPしか作れないプロトン運動力が発生する。 したがって、解糖、転移反応、クレブスサイクルにおいてグルコース1個あたり10個のNADH分子が30個のATP分子を作るのに十分なエネルギーを運ぶのに対し、これらの過程でグルコース1個あたり2個のFADH2が作られると、4個のATP分子を作るのに十分なエネルギーとなる。 グルコースの完全な好気性呼吸で作られるATPの理論的な最大収量は、基質レベルのリン酸化で4分子、酸化的リン酸化で34分子となる(図(˶‾᷄ -̫ ‾᷅˵) )。 実際には、好気性呼吸か嫌気性呼吸かによってATPの総量は1〜34個と少なく、真核細胞では細胞質からミトコンドリアへの中間体の輸送に多少のエネルギーが使われ、ATP量に影響を及ぼしている。
Figure \(\PageIndex{2}) は、グルコース1分子を完全に好気呼吸する際の、さまざまなプロセスによるATPの理論上の最大収率をまとめたものである。 グルコース1分子を完全に好気呼吸させたときの、さまざまなプロセスからのATPの理論上の最大収量
Exercise \(\PageIndex{1})
Proton motive forceの機能とは何か