Używanie zakrzywionych strzałek
Powrócimy teraz do naszego starego przyjaciela, \(CH_3CNO\), który wprowadziliśmy, gdy po raz pierwszy rozmawialiśmy o strukturach rezonansowych. Używamy tego związku do dalszego zilustrowania, jak ruchome elektrony są „popychane”, aby dotrzeć z jednej struktury rezonansowej do drugiej.
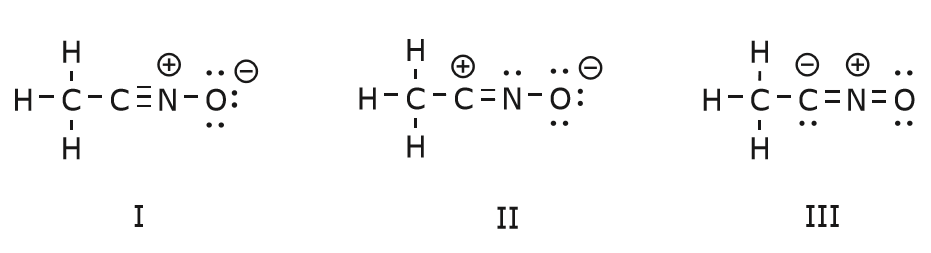
Ruch elektronów, który ma miejsce, aby dotrzeć do struktury II ze struktury I zaczyna się od wiązania potrójnego pomiędzy węglem i azotem. Przesuniemy jedno z dwóch wiązań, które tworzą część wiązania potrójnego w kierunku dodatniego ładunku azotu, jak pokazano na rysunku:
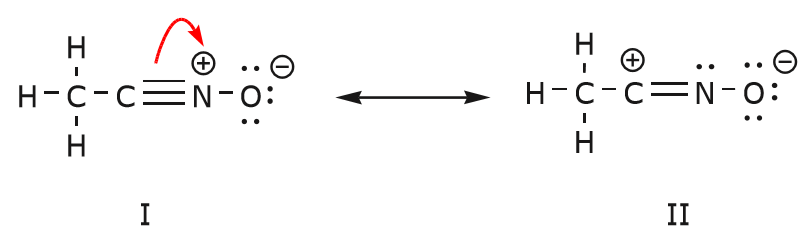
Gdy to zrobimy, zwracamy baczną uwagę na nowy status dotkniętych atomów i dokonujemy wszelkich niezbędnych zmian w ładunkach, wiązaniach i nie dzielonych elektronach, aby zachować ważność wynikowych wzorów. W tym przypadku, na przykład, węgiel, który tworzy część wiązania potrójnego w strukturze I musi uzyskać ładunek dodatni w strukturze II, ponieważ stracił jeden elektron. Azot, z drugiej strony, jest teraz neutralny, ponieważ zyskał jeden elektron i tworzy trzy wiązania zamiast czterech.
Możemy również dotrzeć od struktury I do struktury III, przesuwając elektrony w następujący sposób. Strzałki zostały ponumerowane w tym przykładzie, aby wskazać, który ruch zaczyna się jako pierwszy, ale to nie jest część konwencji stosowanych w formalizmie zakrzywionej strzałki.
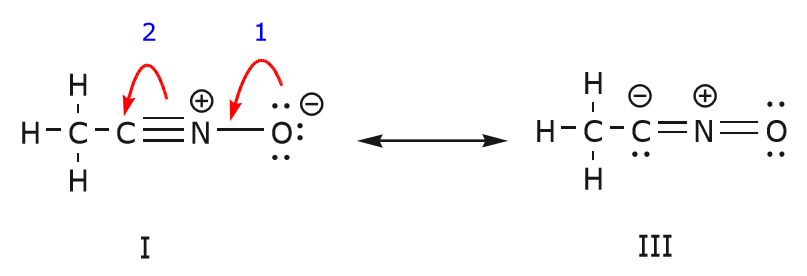
Jak przesuwamy parę elektronów nieudzielonych z tlenu w kierunku atomu azotu, jak pokazano w kroku 1, jesteśmy zmuszeni do przesunięcia elektronów z azotu w kierunku węgla, jak pokazano w kroku 2. W przeciwnym razie skończylibyśmy z azotem z 5 wiązaniami, co jest niemożliwe, nawet jeśli tylko chwilowo. Ponownie, zauważ, że w kroku 1 strzałka zaczyna się od nieprzydzielonej pary elektronów z tlenu i przesuwa się w kierunku dodatniego ładunku na azocie. Pomiędzy azotem i tlenem tworzy się nowe wiązanie. W tym samym czasie, elektrony przesunięte w kierunku węgla w kroku 2 stają się parą nieobsługiwanych elektronów w strukturze III. Wreszcie, zmienia się również stan hybrydyzacji niektórych atomów. Na przykład atom węgla w strukturze I jest zhybrydyzowany sp, ale w strukturze III jest zhybrydyzowany ^3.
Możesz chcieć pobawić się trochę więcej i zobaczyć, czy możesz dojść od struktury II do struktury III, itd. Bądź jednak ostrzeżony, że czasami jest to bardziej skomplikowane niż może się wydawać na pierwszy rzut oka.
Dodatkowe zasady przenoszenia elektronów w celu napisania Struktur Rezonansowych:
- Pary elektronów mogą się przemieszczać tylko do sąsiednich pozycji. Sąsiednie pozycje oznaczają sąsiednie atomy i/lub wiązania.
- Struktury Lewisa, które wynikają z przesunięcia elektronów muszą być ważne i muszą zawierać taki sam ładunek netto jak wszystkie inne struktury rezonansowe.
Następujący przykład ilustruje, jak samotna para elektronów z węgla może zostać przeniesiona, aby utworzyć nowe wiązanie z sąsiednim węglem, oraz jak elektrony pomiędzy węglem a tlenem mogą zostać przeniesione, aby stać się parą nieobsługiwanych elektronów na tlenie. Żadna z poprzednich reguł nie została naruszona w żadnym z tych przykładów.
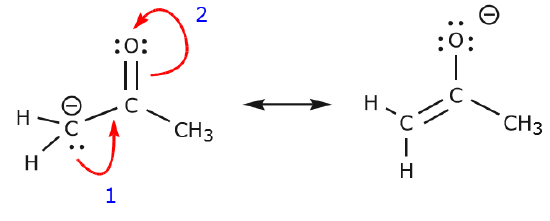
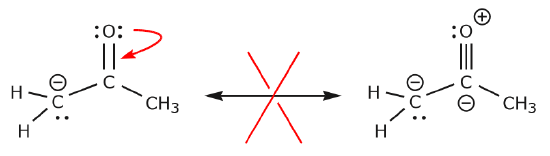
Przyjrzyjrzyjmy się teraz kilku przykładom JAK NIE PRZENOSIĆ ELEKTRONÓW. Używając tego samego przykładu, ale przesuwając elektrony w inny sposób, ilustrujemy, jak taki ruch skutkowałby nieważnymi wzorami Lewisa, a zatem jest nie do przyjęcia. Nie tylko przenosimy elektrony w złym kierunku (z dala od bardziej elektroujemnego atomu), ale również struktura powstała w ten sposób narusza kilka konwencji. Po pierwsze, centralny węgiel ma pięć wiązań, a więc narusza zasadę oktetu. Po drugie, całkowity ładunek drugiej struktury jest inny niż pierwszej. Aby uniknąć posiadania węgla z pięcioma wiązaniami musielibyśmy zniszczyć jedno z wiązań pojedynczych C-C, niszcząc przy okazji szkielet cząsteczki.
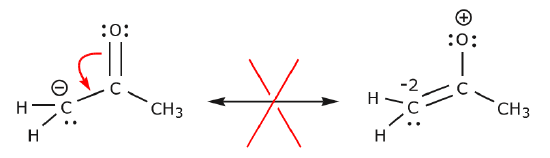
W poniższym przykładzie elektrony są przemieszczane w kierunku obszaru o dużej gęstości elektronowej (ładunek ujemny), a nie w kierunku ładunku dodatniego. Ponadto, reguła oktetu jest naruszona dla węgla w powstałej strukturze, gdzie dzieli on więcej niż osiem elektronów.
Dodatkowe przykłady dalej ilustrują reguły, o których mówiliśmy.
(a) Niedzielone pary elektronowe (samotne pary) znajdujące się na danym atomie mogą przemieścić się na sąsiednią pozycję tylko w celu utworzenia nowego wiązania z następnym atomem.
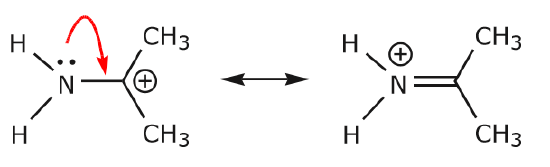
(b) O ile na następnym atomie (węgiel powyżej) nie ma ładunku dodatniego, inne elektrony będą musiały zostać przemieszczone, aby zachować regułę oktetu. W strukturach rezonansowych są to prawie zawsze elektrony ∗, a prawie nigdy elektrony sigma.
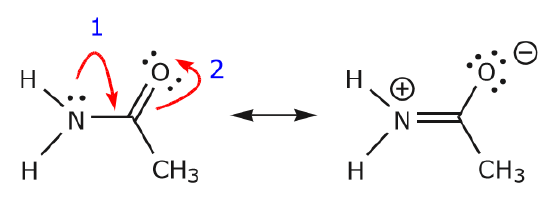
Jak elektrony z samotnej pary azotu przesuwają się w kierunku sąsiedniego węgla, aby utworzyć nowe wiązanie, elektrony tworzące wiązanie C=O muszą być przesunięte w kierunku tlenu, aby uniknąć zakończenia z pięcioma wiązaniami do centralnego węgla.
c) Jak widać powyżej, elektrony mogą przesunąć się w kierunku jednego z dwóch atomów, które dzielą, aby utworzyć nową parę samotną. W powyższym przykładzie, elektrony z wiązania C=O przesunęły się w kierunku tlenu tworząc nową samotną parę. Innym przykładem jest:
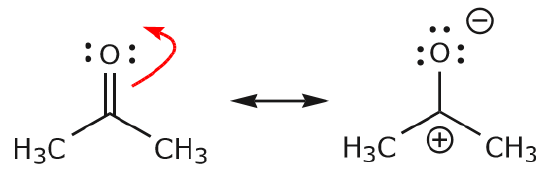
(d) elektrony z wiązania C=O mogą również przesunąć się na sąsiednie pozycje, aby utworzyć nową parę samotną. Ponownie należy przestrzegać zasady oktetu:
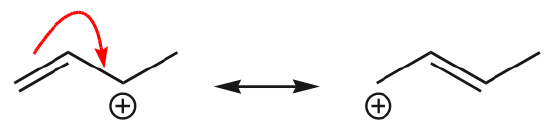
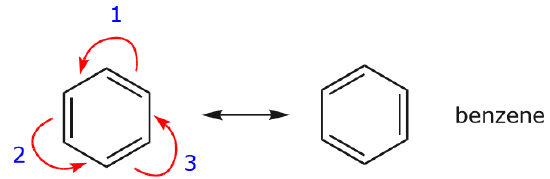
Jeden z najczęstszych przykładów tej cechy obserwuje się przy pisaniu form rezonansowych dla benzenu i podobnych pierścieni.