Hydroksychlorochina, sprzedawana pod nazwą handlową Plaquenil (Sanofi-Aventis), jest lekiem przeciwmalarycznym, który zyskał szerokie zastosowanie w leczeniu różnych chorób autoimmunologicznych, w tym tocznia rumieniowatego układowego i reumatoidalnego zapalenia stawów.1 Według niektórych szacunków, ponad 150 000 pacjentów jest na długotrwałej terapii tym lekiem w samej Ameryce.2 Toksyczność siatkówki związana ze stosowaniem HCQ jest stosunkowo rzadka, szacowana na 1 procent po pięciu latach i wzrasta wraz z kontynuacją terapii.3 Jednak retinopatia, opisywana jako „bull’s-eye”, jest nieuleczalna i ma tendencję do postępu nawet po zaprzestaniu stosowania leku. W związku z tym w ostatnich latach coraz większy nacisk kładzie się na skuteczniejsze badania przesiewowe z wykorzystaniem multimodalnych technik obrazowania w celu wykrycia wczesnych objawów toksyczności, zanim charakterystyczne zaawansowane zmiany ujawnią się klinicznie. W niniejszym przeglądzie podsumowano prezentację kliniczną retinopatii HCQ, aktualne wytyczne American Academy of Ophthalmology dotyczące badań przesiewowych oraz udział pomocniczych badań obrazowych w ustaleniu rozpoznania w odpowiednim czasie.
Prezentacja kliniczna &Badanie
W najwcześniejszych stadiach toksyczności HCQ pacjenci są często bezobjawowi z zachowaną ostrością wzroku. Jednak osoby spostrzegawcze mogą zgłaszać trudności z widzeniem w nocy, jaskrą lub skotomią przyśrodkową, która przeszkadza w czytaniu.4-6 Skotoma zazwyczaj staje się widoczna dla pacjenta na długo przed pojawieniem się zmian w badaniu. Chociaż w niektórych przypadkach wczesnej toksyczności opisywano rozpoznanie subtelnej depigmentacji foveal, było to możliwe dopiero po potwierdzeniu za pomocą pomocniczych badań obrazowych.7
Z drugiej strony, widoczna retinopatia typu „byczego oka”, charakteryzująca się pierścieniem zwyrodnienia nabłonka pigmentu siatkówki, często z pominięciem centrum foveal, jest późnym odkryciem wskazującym na zaawansowane uszkodzenie (patrz Rycina 1). W związku z tym sama oftalmoskopia nie jest wystarczającym badaniem przesiewowym w kierunku toksyczności HCQ.7,8 To powiedziawszy, szczegółowe badanie przedniego i tylnego odcinka w celu oceny występowania verticillata rogówki, jak również współistniejącej choroby plamki (tj. zwyrodnienia plamki związanego z wiekiem), pozostaje ważne w długoterminowym monitorowaniu tych pacjentów.
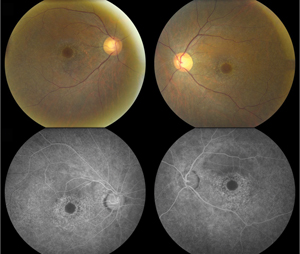
Rycina 1. Zdjęcia dna oka (u góry) wykazują rozległą, przyśrodkową depigmentację nabłonka barwnikowego siatkówki z pominięciem centralnej części fovea, obustronnie, co odpowiada makulopatii byka. Angiografia fluoresceinowa (dolna) wykazuje parafowkową ziarnistą hiperfluorescencję korelującą z fragmentarycznym uszkodzeniem RPE i następowym defektem okienka.
Wytyczne dotyczące badań przesiewowych
W 2002 roku AAO opublikowało wstępne preferowane wzorce postępowania dotyczące badań przesiewowych w kierunku retinopatii HCQ w odpowiedzi na różne schematy zalecane w tamtym czasie.9 Zalecenia te zostały zweryfikowane w 2011 roku w celu odzwierciedlenia zwiększonej czułości nowszych technik obrazowania diagnostycznego.4
Jeśli pacjenta uznano za osobę o niskim ryzyku wystąpienia retinopatii, zalecono wykonywanie badań kontrolnych, począwszy od pięciu lat terapii po początkowym okresie podstawowym. Jeśli u pacjenta stwierdzono wysokie ryzyko, zalecano coroczną kontrolę. Wysokie ryzyko zdefiniowano jako osobę z czasem stosowania HCQ dłuższym niż pięć lat, ponad 1000 gramów skumulowanego spożycia, ponad 6,5 mg/kg/d dawki dobowej, podwyższony wiek (nie określono punktu odcięcia), współistniejąca choroba wątroby/nerek lub wcześniej istniejąca makulopatia o innej etiologii.4
Oprócz badania okulistycznego i automatycznego progowego badania pola widzenia Humphreya z wzorcem białych 10-2 (które powinno być interpretowane z niskim progiem dla nieprawidłowości i z powtórzeniem badania w przypadku zauważenia nieprawidłowości), zaleca się co najmniej jedno z następujących uzupełniających obiektywnych badań obrazowych: 1) optyczna koherentna tomografia ze spektralną domeną; 2) autofluorescencja dna oka; lub 3) wieloogniskowa elektroretinografia, na poziomie wyjściowym i corocznie podczas każdej wizyty po pięciu latach stosowania HCQ.4 Co znamienne, w tych wytycznych nie zalecono angiografii fluoresceinowej. Chociaż FA może ujawnić wzór „byczego oka” ziarnistej hiperfluorescencji i może być w stanie wyjaśnić subtelne defekty RPE, nie udowodniono, że jest tak czuła jak wyżej wymienione badania i wiąże się z dodatkową chorobowością ze względu na jej inwazyjność.4
Spectral-Domain OCT
Generując wysokiej rozdzielczości, przekrojowe obrazy siatkówki in vivo, SD-OCT może wykryć znaczące zmiany strukturalne przed rozwojem widocznej retinopatii HCQ. Wcześniej opisane wyniki OCT w przypadku toksyczności HCQ obejmują utratę zewnętrznej błony ograniczającej, przerwanie zewnętrznej strefy elipsoidalnej, parafowkowe ścieńczenie zewnętrznej warstwy jądrowej i uszkodzenie RPE.6,7,10 Pomimo tych różnych zmian liczne badania potwierdzają tezę, że w przypadku toksyczności HCQ powszechna jest względna „odporność na fowizm”, na co wskazuje zachowanie podfowialnych zewnętrznych warstw siatkówki, co odpowiada nienaruszonej centralnej ostrości wzroku, którą można zaobserwować nawet w zaawansowanych stanach chorobowych.6 Ten oszczędzający się fragment bruzdy służy jako podstawa dla objawu „latającego spodka” retinopatii HCQ opisanego przez Erica Chena, MD, i współpracowników, gdzie owalny wygląd jest tworzony przez nienaruszone centralne zewnętrzne struktury siatkówki w centralnej części bruzdy, kontrastujące z sąsiadującą okołopołówkową utratą pasma elipsoidalnego fotoreceptorów i atrofią ONL (patrz Rycina 2).11
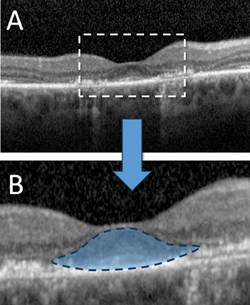
Rycina 2. Optyczna koherentna tomografia z domeną spektralną ukazująca zaawansowaną retinopatię hydroksychlorochinową z parafowkową utratą błony granicznej zewnętrznej, przerwaniem strefy elipsoidalnej zewnętrznej, ścieńczeniem zewnętrznej warstwy jądrowej i przerwaniem leżącej pod nią warstwy nabłonka pigmentu siatkówki (A). Względne oszczędzenie struktur podtwardówkowych skutkuje charakterystycznym objawem „latającego spodka”, będącym oznaką zaawansowanej toksyczności (B).11
Choć znaczna część literatury koncentruje się na zmianach w siatkówce zewnętrznej w retinopatii HCQ, najwcześniejsze wyniki SD-OCT wskazujące na toksyczność mogą w rzeczywistości lokalizować się w siatkówce wewnętrznej. Sirichai Pasadhika, MD, i współpracownicy zaobserwowali selektywne ścieńczenie wewnętrznej siatkówki okołoramkowej w SD-OCT, zwłaszcza wewnętrznej warstwy splotowatej i warstwy komórek zwojowych, u pacjentów leczonych długotrwale HCQ (ponad pięć lat) przy braku zmian strukturalnych w siatkówce zewnętrznej/RPE lub innej klinicznie widocznej toksyczności.12 Co ciekawe, u tych pacjentów nie stwierdzono ścieńczenia warstwy włókien nerwowych siatkówki, co według autorów ma miejsce dopiero po wystąpieniu istotnej degeneracji komórek zwojowych siatkówki. W oddzielnym badaniu mającym na celu porównanie przewlekle leczonych pacjentów z oftalmoskopowymi dowodami toksyczności i bez nich, u pacjentów z klinicznie jawną toksycznością siatkówki zaobserwowano znaczne ścieńczenie siatkówki wewnętrznej, zewnętrznej i pełnej grubości, podczas gdy w grupie bez zmian w dnie oka wykryto jedynie wybiórcze ścieńczenie siatkówki wewnętrznej.13 Po raz kolejny ścieńczenie RNFL nie występowało u pacjentów z przewlekłą ekspozycją na HCQ i bez zmian w dnie oka; jednak w grupie ze zmianami w dnie oka związanymi z toksycznością leku wykazano ścieńczenie RNFL w okolicy okołorównikowej. Ostatnio Ulviye Yigit i współautorzy potwierdzili te wyniki, stwierdzając znaczne ścieńczenie siatkówki wewnętrznej podczas terapii HCQ, zwłaszcza w obszarach para- i perifovealnych, przy braku klinicznych zmian na dnie oka.14 Wyjątkowe w ich badaniu było włączenie pacjentów otrzymujących HCQ przez mniej niż pięć lat (średni czas trwania: 2,5 roku).
Należy przeprowadzić więcej badań z udziałem większej liczby pacjentów, aby lepiej określić, jakie wskaźniki oparte na SD-OCT mogą być wiarygodnie oceniane we wczesnej toksyczności HCQ. Jednakże, biorąc pod uwagę szybki czas akwizycji obrazu, nieinwazyjny charakter i szeroką dostępność w wielu klinikach, większość praktyków nadal preferuje SD-OCT jako podstawowy dodatek do badania pola widzenia w badaniach przesiewowych HCQ.
Autofluorescencja fundusowa
Obrazy z FAF mogą pomóc w wyjaśnieniu toksycznych zmian w RPE, leżących u podłoża długotrwałej terapii HCQ. Zwiększony sygnał FAF zwykle wskazuje na akumulację lipofuscyny, w szczególności fluoroforu A2E, w obrębie RPE w wyniku nieprawidłowego metabolizmu ze zwiększoną fagocytozą segmentów zewnętrznych fotoreceptorów lub wrodzonego/nabytego defektu procesów fagocytotwórczych.15,16 Z kolei wygaszony sygnał FAF wskazuje na śmierć komórek RPE.17
Wczesne stwierdzenie okołośrodkowego pierścienia o zwiększonej intensywności FAF, pojawiającego się jako hiperfluorescencyjna poświata, może być widoczne w przypadku toksyczności HCQ, zanim rozwinie się zwyrodnienie RPE, i uważa się, że reprezentuje ono obszary wczesnego uszkodzenia fotoreceptorów w wyniku nagromadzenia szczątków segmentu zewnętrznego.4,18,19 Może to być jednak dość subtelne i może być łatwo przeoczone przez niewprawnego recenzenta. Jeśli obserwowano współistniejące nieprawidłowości w mfERG lub SD-OCT, sugerowano patofizjologiczne podłoże wyników FAF.7,18 Mimo to nadal brakuje dowodów potwierdzających przydatność FAF w wykrywaniu wczesnej subklinicznej toksyczności, co czyni ją mniej wiarygodną jako podstawowe narzędzie przesiewowe.
Prawdziwa wartość FAF, ważniejsza niż badania przesiewowe, polega na jej zdolności do monitorowania progresji w znanych przypadkach retinopatii wywołanej HCQ, na przykład gdy pacjentowi odstawiono lek, ale nadal wymaga on okresowych badań kontrolnych. W tym kontekście FAF stanowi czuły wskaźnik degeneracji RPE w miarę postępu toksyczności, szczególnie w zaawansowanych stadiach. W miarę zaniku RPE, intensywność FAF w plamce okołośrodkowej zmienia się na cętkowaną lub plamistą, a ostatecznie łączy się w ciemne obszary braku sygnału FAF po obumarciu komórek (patrz Rycina 3).
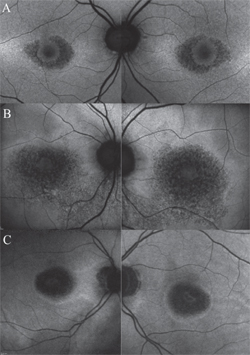
Rycina 3. Wzory autofluorescencji dna oka w różnych stadiach retinopatii hydroksychlorochinowej. Klasyczny wygląd makulopatii „byczego oka” (A). W miarę zaniku RPE, intensywność FAF w plamce okołośrodkowej zmienia się na cętkowaną lub plamistą (B) i ostatecznie łączy się w ciemne obszary braku sygnału FAF po obumarciu komórek (C). Te ciemne obszary mogą być ograniczone przez obwódkę zwiększonej autofluorescencji (A-C), wskazując, które komórki RPE ulegną degeneracji w następnej kolejności.
Te ciemne regiony mogą być otoczone obwódką zwiększonej autofluorescencji, wskazując, które komórki RPE ulegną degeneracji w następnej kolejności.17 Należy zauważyć, że nie wszystkie przypadki związane z zaawansowanym zanikiem siatkówki potwierdzonym innymi technikami (tj. SD-OCT) mają wyraźny wygląd w FAF. To odkrycie podkreśla znaczenie wytycznych AAO, aby przy identyfikacji toksycznego działania HCQ stosować więcej niż jedną metodę obrazowania.
Wieloogniskowa elektroretinografia
Tradycyjna pełnopolowa elektroretinografia stanowi badanie globalnej funkcji siatkówki w odpowiedzi na stymulację fotogenną. Ponieważ nie jest ona wrażliwa na zmiany czynnościowe zlokalizowane w plamce żółtej, przypadki toksyczności HCQ mogą wykazywać nieprawidłowości dopiero po wystąpieniu rozproszonego uszkodzenia siatkówki, co ogranicza jej przydatność w programach przesiewowych.4,9
I odwrotnie, wieloogniskowa ERG, dzięki możliwości rejestrowania zlokalizowanych centralnych uszkodzeń siatkówki, zyskała akceptację jako doskonały kandydat do wykrywania subtelnych zmian we wczesnych stadiach toksyczności.20 Raj Maturi, MD, i współpracownicy po raz pierwszy donieśli o wyraźnym zmniejszeniu centralnej amplitudy 16˚ mfERG u pacjenta z jawną retinopatią HCQ w otoczeniu prawidłowego ERG w pełnym polu.21 Podobne wyniki uzyskano w kolejnych badaniach charakteryzujących osoby stosujące HCQ. Timothy Y.Y. Lai, MMedSc, MRCS, i współpracownicy zaobserwowali podłużne pogorszenie funkcji siatkówki u pacjentów otrzymujących długotrwale HCQ i zaproponowali, że seryjne badanie mfERG może pomóc w wykryciu wczesnych zmian siatkówki związanych z toksycznością.22 W kolejnym badaniu wykazali, że odpowiedzi mfERG korelowały z wartościami średniego odchylenia HVF 10-2, a zatem mogą uzupełniać badanie pola widzenia, zapewniając obiektywny pomiar funkcji siatkówki u pacjentów stosujących HCQ.23
Najbardziej specyficznym wzorem fali obserwowanym u pacjentów z toksycznością HCQ jest paracentralny ubytek amplitudy, wskazujący na zmniejszoną funkcję siatkówki w podatnym perifovea. W innym badaniu dr Maturi i współpracownicy zaproponowali, że wydłużony czas implikacji, obserwowany w połączeniu z przyśrodkową utratą amplitudy, może być bardziej specyficzną cechą toksyczności HCQ.24 Ponadto wykazali oni trzy dodatkowe konfiguracje, poza utratą przyśrodkową, nieprawidłowych zmian amplitudy mfERG: 1) centralny ubytek fowialny; 2) ubytek obwodowy; i 3) uogólniony ubytek.24 Ich system klasyfikacji wzorców zmian w mfERG został potwierdzony przez inne grupy.20,22
Dążąc do zwiększenia czułości standardowej interpretacji mfERG w wykrywaniu wczesnej toksyczności HCQ, dr Jonathan S. Lyons i dr Matthew L. Severns opracowali nowatorski algorytm tabelarycznego przedstawiania danych mfERG, nazwany „metodą stosunku pierścieni” (patrz ryc. 4).20,25 Biorąc pod uwagę, że amplituda pojedynczego podania mfERG może różnić się nawet o 30% w kolejnych badaniach,26 stosunek pierścieni został opracowany w celu zmniejszenia szumu tła i stworzenia bardziej normatywnych wartości pomocnych w podejmowaniu decyzji klinicznych. W tym celu, dane z 61-heksagonalnego mfERG są podzielone na pięć stref koncentrycznych pierścieni (R1-R5).
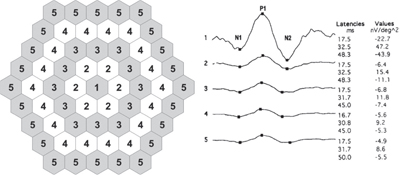
Ryc. 4. Metoda proporcji pierścieni w interpretacji wieloogniskowego elektroretinogramu. Schemat układu 61-heksagonalnego wzorca bodźców po lewej stronie przedstawia sześciokąty należące do każdego pierścienia. Po prawej stronie znajdują się uśrednione przebiegi pierścieniowe od normalnego pacjenta. (Współczynniki pierścieniowe w mfERG są zdefiniowane jako stosunek amplitudy pierścienia centralnego (R1) do amplitudy pierścienia obwodowego, co daje pięć pomiarów dla każdego oka: R1, R1/R2, R1/R3, R1/R4 i R1/R5. Ponieważ R1 ma najwyższą amplitudę pierścienia w normalnym oku, normalny stosunek pierścieni jest większy niż 1,0; jednakże, ponieważ obszary obniżonej amplitudy mfERG w toksyczności HCQ są zazwyczaj w kształcie pierścienia okołośrodkowego, a centralny obszar plamki jest zazwyczaj oszczędzany aż do późnego etapu procesu chorobowego, ci pacjenci zazwyczaj wykazują większy stosunek pierścieni niż można by się spodziewać (powyżej 99 procent granic akceptowanych norm stworzonych z podzbioru zdrowych osób).20
Chociaż badanie mfERG okazało się bardzo obiecujące jako obiektywny środek do wykrywania wczesnej toksyczności HCQ, jak również śledzenia progresji zmian plamki w znanej chorobie, jest ono ograniczone przez zależność od współpracy pacjenta, specjalistyczne szkolenie personelu w zakresie podawania i interpretacji oraz ogólny koszt. Być może najważniejsze jest to, że nie jest ono tak łatwo dostępne lub łatwe do wiarygodnego wykonania jak SD-OCT lub FAF, co ogranicza jego dotychczasowe szerokie zastosowanie.
Brak jednego „najlepszego testu”
Pomimo zwiększonej integracji tych systemów obrazowania zarówno na forach badawczych, jak i w praktyce klinicznej, nadal nie ma zgody co do tego, który test jest złotym standardem w wykrywaniu wczesnej toksyczności HCQ. Ten rozdźwięk jest widoczny w literaturze, ponieważ różni zwolennicy opowiadali się za polami widzenia, FAF, mfERG lub SD-OCT jako metodami najbardziej czułymi/specyficznymi. W niedawnym retrospektywnym badaniu przeprowadzonym w prywatnej praktyce na 219 pacjentach David J. Browning, MD, PhD, stwierdził, że zmienione wytyczne kładące nacisk na pomocnicze FAF, SD-OCT lub mfERG w rzeczywistości podniosły koszty badań przesiewowych, nie poprawiając wykrywalności toksyczności.27
Pojawienie się obrazowania z zastosowaniem optyki adaptacyjnej umożliwiło wizualizację mozaiki fotoreceptorów czopkowych in vivo z rozdzielczością ≤ 2 µm dzięki kompensacji aberracji w optyce okularowej.29-31 Dzięki tej technologii w różnych chorobach siatkówki ujawniono nieprawidłowości fotoreceptorów, które w przeciwnym razie nie byłyby możliwe do wykrycia za pomocą obrazowania SD-OCT.32,33
Zastosowanie optyki adaptacyjnej w retinopatii HCQ jest stosunkowo nowe. Kimberly E. Stepien, MD, i współpracownicy wykazali zaburzenie mozaiki fotoreceptorów czopkowych w obszarach odpowiadających defektom HVF 10-2 i nieprawidłowościom strefy elipsoidalnej SD-OCT u dwóch pacjentów poddanych długotrwałej terapii HCQ.33 Podobnie badacze koreańscy zaobserwowali zaburzony wzór mozaiki czopkowej, w którym poszczególne czopki miały nieregularne kształty i rozmiary u pacjenta z makulopatią byczego oka.34 Ponadto ogólna zmierzona gęstość czopków była zmniejszona we wszystkich uprzednio wyznaczonych punktach testowych w różnych odległościach od centrum fowarowego. Łącznie, obie grupy zaproponowały AO jako nieinwazyjną, ilościową, wysokorozdzielczą metodę obrazowania pacjentów z retinopatią HCQ, która może pozwolić na wykrycie subklinicznych nieprawidłowości poprzedzających obiektywną utratę pola widzenia. Do potwierdzenia tych ustaleń konieczne są badania na większą skalę.
Ostatnio dwie grupy opisały zastosowanie systemów mikroperymetrycznych do oceny wczesnej toksyczności HCQ.35,36 Badając perymetrię przy jednoczesnej wizualizacji dna oka, można uzyskać precyzyjny korelat anatomiczny aberracji czynnościowej.35 Lucia Martinez-Costa i współpracownicy zaobserwowali istotne różnice w pomiarach czułości siatkówki metodą mikroperymetrii między 209 pacjentami przyjmującymi HCQ lub chlorochinę w porównaniu z 204 osobami z grupy kontrolnej.36 Renu Jivrajka, MD, i współpracownicy szczegółowo opisali swoje wyniki w kohorcie 16 pacjentów stosujących terapię HCQ przez ponad pięć lat, u których nie stwierdzono oznak toksyczności w konwencjonalnych badaniach 10-2 HVF, SD-OCT, FAF lub mfERG; jednak za pomocą mikroperymetrii zauważyli znaczące ogólne zmniejszenie średniej czułości siatkówki między pacjentami a podobnymi wiekowo osobami z grupy kontrolnej.35 Dodatkową zaletą zastosowanego systemu mikroperymetrycznego była jego zdolność do jednoczesnego uzyskiwania obrazów SD-OCT i nakładania na siebie wartości czułości i grubości siatkówki, co dodatkowo wzmacnia koncepcję korelacji odpowiedzi funkcjonalnej ze strukturą anatomiczną. Przyszłe prospektywne badania podłużne są potrzebne, z seryjnym badaniem mikroperymetrycznym, w celu lepszego określenia, czy zmniejszona wrażliwość siatkówki rzeczywiście reprezentuje wczesną subkliniczną toksyczność HCQ.
Hydroksychlorochina jest cennym lekiem o ogólnie niskim profilu działań niepożądanych. Chociaż oczne działania toksyczne są rzadkie, mogą być związane z istotną i nieodwracalną chorobą pacjenta. Wczesne wykrycie toksyczności w stadium subklinicznym i odstawienie leku może zapobiec dalszemu pogorszeniu strukturalnemu i funkcjonalnemu. W związku z tym klinicyści powinni utrzymywać niski próg dla podejrzenia toksyczności HCQ. Subtelne nieprawidłowości wykryte za pomocą jednej z metod wymagają dodatkowych badań w celu potwierdzenia lub obalenia tych wyników, a ostatecznym celem jest wczesne postawienie diagnozy przed nieodwracalną utratą wzroku. REVIEW
Figura 4 reprodukowana za zgodą z: Lyons JS, Severns ML. Detection of early hydroxychloroquine retinal toxicity enhanced by ring ratio analysis of multifocal electroretinography. Am J Ophthalmol 2007. May;143(5):801-809.
Dr Rahimy jest drugorocznym stypendystą w Wills Eye Hospital i klinicznym instruktorem okulistyki w Thomas Jefferson University School of Medicine. Dr Vander jest chirurgiem prowadzącym Retina Service w Wills Eye Hospital i profesorem oftalmologii w Thomas Jefferson University School of Medicine. Z dr Rahimy można się kontaktować pod adresem [email protected]. Z dr. Vanderem można się skontaktować pod adresem jvander@midatlantic retina.com.
1. Tehrani R, Ostrowski RA, Hariman R, Jay WM. Ocular toxicity of hydroxychloroquine. Semin Ophthalmol 2008;23(3):201-209.
2. Semmer AE, Lee MS, Harrison AR, Olsen TW. Hydroxychloroquine retinopathy screening. Br J Ophthalmol 2008;92(12): 1653-1655.
3. Wolfe F, Marmor MF. Rates and predictors of hydroxychloroquine retinal toxicity in patients with rheumatoid arthritis and systemic lupus erythematosus. Arthritis Care Res (Hoboken) 2010;62(6):775-784.
4. Marmor MF, Kellner U, Lai TY, Lyons JS, Mieler WF. Revised recommendations on screening for chloroquine and hydroxychloroquine retinopathy. Ophthalmology 2011;118:415-422.
5. Michaelides M, Stover NB, Francis PJ, Weleber RG. Retinal toxicity associated with hydroxychloroquine and chloroquine: Risk factors, screening, and progression despite cessation of therapy. Arch Ophthalmol 2011;129:30-39.
6. Mititelu M, Wong BJ, Brenner M, Bryar PJ, Jampol LM, Fawzi AA. Progresja toksycznego działania hydroksychlorochiny po zaprzestaniu terapii: New evidence from multimodal imaging. JAMA Ophthalmol 2013;131:1187-1197.
7. Marmor MF. Comparison of screening procedures in hydroxychloroquine toxicity. Arch Ophthalmol 2012;130:461-469.
8. Elder M, Rahman AM, McLay J. Early paracentral visual field loss in patients taking hydroxychloroquine. Arch Ophthalmol 2006;124:1729-1733.
9. Marmor MF, Carr RE, Easterbrook M, Farjo AA, Mieler WF. Recommendations on screening for chloroquine and hydroxychloroquine retinopathy: A report by the American Academy of Ophthalmology. Ophthalmology 2002;109:1377-1382.
10. Kellner S, Weinitz S, Kellner U. Spectral domain optical coherence tomography detects early stages of chloroquine retinopathy similar to multifocal electroretinography, fundus autofluorescence and near-infrared autofluorescence. Br J Ophthalmol 2009;93(11):1444-1447.
11. Chen E, Brown DM, Benz MS, et al. Spectral domain optical coherence tomography as an effective screening test for hydroxychloroquine retinopathy (the „flying saucer” sign). Clin Ophthalmol 2010;4:1151-1158.
12. Pasadhika S, Fishman GA, Choi D, Shahidi M. Selective thinning of the perifoveal inner retina as an early sign of hydroxychloroquine retinal toxicity. Eye (Lond) 2010;24(5):756-762; quiz 763.
13. Pasadhika S, Fishman GA. Effects of chronic exposure to hydroxychloroquine or chloroquine on inner retinal structures. Eye (Lond) 2010;24(2):340-346.
14. Ulviye Y, Betul T, Nur TH, Selda C. Spectral domain optical coherence tomography for early detection of retinal alterations in patients using hydroxychloroquine. Indian J Ophthalmol 2013;61(4):168-171.
15. Kennedy CJ, Rakoczy PE, Constable IJ. Lipofuscin of the retinal pigment epithelium: A review. Eye (Lond) 1995;9 ( Pt 6)):763-771.
16. Okubo A, Rosa RH, Jr, Bunce CV, et al. The relationships of age changes in retinal pigment epithelium and Bruch’s membrane. Invest Ophthalmol Vis Sci 1999;40(2):443-449.
17. Holz FG, Bellman C, Staudt S, Schutt F, Volcker HE. Fundus autofluorescence and development of geographic atrophy in age-related macular degeneration. Invest Ophthalmol Vis Sci 2001;42(5):1051-1056.
18. Kellner U, Renner AB, Tillack H. Fundus autofluorescence and mfERG for early detection of retinal alterations in patients using chloroquine/hydroxychloroquine. Invest Ophthalmol Vis Sci 2006;47(8):3531-3538.
19. Marmor MF. Fundus autofluorescence is not the best early screen for hydroxychloroquine toxicity. JAMA Ophthalmol 2013;131:1487-1488.
20. Lyons JS, Severns ML. Detection of early hydroxychloroquine retinal toxicity enhanced by ring ratio analysis of multifocal electroretinography. Am J Ophthalmol 2007;143:801-809.
21. Maturi RK, Folk JC, Nichols B, Oetting TT, Kardon RH. Hydroxychloroquine retinopathy. Arch Ophthalmol 1999;117:1262-1263.
22. Lai TY, Chan WM, Li H, Lai RY, Lam DS. Multifocal electroretinographic changes in patients receiving hydroxychloroquine therapy. Am J Ophthalmol 2005;140:794-807.
23. Lai TY, Ngai JW, Chan WM, Lam DS. Visual field and multifocal electroretinography and their correlations in patients on hydroxychloroquine therapy. Doc Ophthalmol 2006;112(3):177-187.
24. Maturi RK, Yu M, Weleber RG. Multifocal electroretinographic evaluation of long-term hydroxychloroquine users. Arch Ophthalmol 2004;122:973-981.
25. Lyons JS, Severns ML. Using multifocal ERG ring ratios to detect and follow Plaquenil retinal toxicity: a review : Review of mfERG ring ratios in Plaquenil toxicity. Doc Ophthalmol 2009;118(1):29-36.
26. Tzekov RT, Gerth C, Werner JS. Senescence of human multifocal electroretinogram components: A localized approach. Graefes Arch Clin Exp Ophthalmol 2004;242(7):549-560.
27. Browning DJ. Impact of the revised american academy of ophthalmology guidelines regarding hydroxychloroquine screening on actual practice. Am J Ophthalmol 2013;155:418-428.e411.
28. Marmor MF, Melles RB. Disparity between Visual Fields and Optical Coherence Tomography in Hydroxychloroquine Retinopathy. Ophthalmology 2014;121:1257-62.
29. Roorda A, Romero-Borja F, Donnelly Iii W, Queener H, Hebert T, Campbell M. Adaptive optics scanning laser ophthalmoscopy. Opt Express 2002;10(9):405-412.
30. Park SP, Chung JK, Greenstein V, Tsang SH, Chang S. A study of factors affecting the human cone photoreceptor density measured by adaptive optics scanning laser ophthalmoscope. Exp Eye Res 2013;108:1-9.
31. Kim JE, Chung M. Adaptacyjna optyka do obrazowania siatkówki: Aktualny stan. Retina 2013;33:1483-1486.
32. Carroll J, Neitz M, Hofer H, Neitz J, Williams DR. Functional photoreceptor loss revealed with adaptive optics: An alternate cause of color blindness. Proc Natl Acad Sci U S A 2004;101(22):8461-8466.
33. Stepien KE, Martinez WM, Dubis AM, Cooper RF, Dubra A, Carroll J. Subclinical photoreceptor disruption in response to severe head trauma. Arch Ophthalmol 2012;130:400-402.
34. Bae EJ, Kim KR, Tsang SH, Park SP, Chang S. Retinal damage in chloroquine maculopathy, revealed by high resolution imaging: A case report utilizing adaptive optics scanning laser ophthalmoscopy. Korean J Ophthalmol 2014;28(1):100-107.
35. Jivrajka RV, Genead MA, McAnany JJ, Chow CC, Mieler WF. Microperimetric sensitivity in patients on hydroxychloroquine (Plaquenil) therapy. Eye (Lond) 2013;27(9):1044-1052.
36. Martinez-Costa L, Victoria Ibanez M, Murcia-Bello C, et al. Use of microperimetry to evaluate hydroxychloroquine and chloroquine retinal toxicity. Can J Ophthalmol 2013;48(5):400-405.