Hydroxychloroquin, das unter dem Markennamen Plaquenil (Sanofi-Aventis) verkauft wird, ist ein Malariamedikament, das bei der Behandlung verschiedener Autoimmunkrankheiten, einschließlich systemischem Lupus erythematodes und rheumatoider Arthritis, weit verbreitet ist.1 Schätzungen zufolge erhalten allein in den USA mehr als 150.000 Patienten eine Langzeittherapie mit diesem Medikament.2 Netzhauttoxizität im Zusammenhang mit der Einnahme von HCQ ist relativ selten, sie wird auf 1 Prozent nach fünf Jahren geschätzt und nimmt bei fortgesetzter Therapie zu.3 Die als Bullauge beschriebene Retinopathie ist jedoch unbehandelbar und neigt dazu, auch nach Absetzen des Medikaments weiterzugehen. Dementsprechend wurde in den letzten Jahren verstärktes Augenmerk auf wirksamere Screening-Maßnahmen gelegt, bei denen multimodale bildgebende Verfahren eingesetzt werden, um frühe Anzeichen einer Toxizität zu erkennen, bevor sich die charakteristischen fortgeschrittenen Veränderungen klinisch manifestieren. Diese Übersicht fasst die klinische Präsentation der HCQ-Retinopathie, die aktuellen von der American Academy of Ophthalmology empfohlenen Screening-Richtlinien und den Beitrag zusätzlicher bildgebender Untersuchungen zur rechtzeitigen Diagnosestellung zusammen.
Klinische Darstellung & Untersuchung
In den frühesten Stadien der HCQ-Toxizität sind die Patienten oft asymptomatisch, wobei die Sehschärfe erhalten bleibt. Aufmerksame Personen können jedoch über Schwierigkeiten beim Nachtsehen, Blendung oder parazentrale Skotome berichten, die das Lesen beeinträchtigen.4-6 Das Skotom fällt dem Patienten in der Regel auf, lange bevor bei der Untersuchung Veränderungen festgestellt werden. Zwar wurde in einigen Fällen früher Toxizität eine subtile Depigmentierung der Fovea beschrieben, jedoch erst nach Bestätigung durch ergänzende bildgebende Untersuchungen.7
Andererseits ist die sichtbare Bullaugen-Retinopathie, die durch einen Ring retinaler Pigmentepitheldegeneration gekennzeichnet ist, bei der das Foveazentrum oft ausgespart wird, ein später Befund, der auf eine fortgeschrittene Schädigung hinweist (siehe Abbildung 1). Daher reicht die Ophthalmoskopie allein nicht aus, um HCQ-Toxizität festzustellen.7,8 Dennoch ist eine detaillierte Untersuchung des vorderen und hinteren Segments zur Feststellung von Hornhautvertikillata und gleichzeitiger Makulaerkrankung (d. h. altersbedingter Makuladegeneration) für die langfristige Überwachung dieser Patienten wichtig.
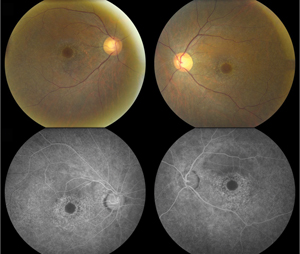
Abbildung 1. Fundusfotos (oben) zeigen eine ausgedehnte parazentrale Depigmentierung des retinalen Pigmentepithels, wobei die zentrale Fovea beidseitig verschont bleibt, was auf eine Bull’s-Eye-Makulopathie hindeutet. Die Fluoreszeinangiographie (unten) zeigt eine parafoveale granuläre Hyperfluoreszenz, die mit einer fleckigen RPE-Depigmentierung und einem anschließenden Fensterdefekt korreliert.
Richtlinien für das Screening
Im Jahr 2002 veröffentlichte die AAO ihre ersten bevorzugten Praxisleitlinien für das HCQ-Retinopathie-Screening als Reaktion auf die verschiedenen damals befürworteten Therapien.9 Diese Empfehlungen wurden 2011 überarbeitet, um der erhöhten Empfindlichkeit neuerer bildgebender Diagnoseverfahren Rechnung zu tragen.4
Wenn ein Patient als geringes Risiko für eine Retinopathie eingestuft wurde, wurden Folgeuntersuchungen ab fünf Jahren nach der Erstuntersuchung empfohlen. Wurde ein Patient als Hochrisikopatient eingestuft, wurde eine jährliche Nachuntersuchung empfohlen. Ein hohes Risiko wurde definiert als jemand mit einer HCQ-Anwendungsdauer von mehr als fünf Jahren, einem kumulativen Konsum von mehr als 1.000 Gramm, einer Tagesdosis von mehr als 6,5 mg/kg/d, einem höheren Alter (kein Grenzwert angegeben), einer gleichzeitigen Leber-/Nierenerkrankung oder einer bereits bestehenden Makulopathie anderer Ätiologie.4
Zusätzlich zu einer ophthalmologischen Untersuchung und einem automatisierten Schwellenwert-Humphrey-Gesichtsfeldtest mit einem weißen 10-2-Muster (der mit einem niedrigen Schwellenwert für Anomalien und mit Wiederholungstests bei Unregelmäßigkeiten interpretiert werden sollte) wird mindestens eine der folgenden zusätzlichen objektiven Bildgebungsstudien empfohlen: 1) optische Kohärenztomographie im Spektralbereich; 2) Fundusautofluoreszenz; oder 3) multifokale Elektroretinographie, zu Beginn und jährlich bei jedem Besuch nach fünf Jahren HCQ-Anwendung.4 Bemerkenswert ist, dass in diesen Leitlinien keine Fluoreszenzangiographie empfohlen wurde. Die FA kann zwar das Bull’s-Eye-Muster der körnigen Hyperfluoreszenz aufzeigen und möglicherweise subtile RPE-Defekte aufdecken, hat sich aber nicht als so empfindlich erwiesen wie die oben genannten Tests und ist aufgrund ihres invasiven Charakters mit zusätzlicher Morbidität verbunden.4
Spectral-Domain OCT
Durch die Erstellung von hochauflösenden Querschnittsbildern der Netzhaut in vivo kann das SD-OCT signifikante strukturelle Veränderungen erkennen, bevor sich eine sichtbare HCQ-Retinopathie entwickelt. Zu den bereits beschriebenen OCT-Befunden bei HCQ-Toxizität gehören der Verlust der äußeren Begrenzungsmembran, die Störung der äußeren ellipsoiden Zone, die parafoveale Ausdünnung der äußeren Kernschicht und die Schädigung des RPE.6,7,10 Trotz dieser verschiedenen Veränderungen haben zahlreiche Studien die Vorstellung gestützt, dass bei HCQ-Toxizität eine relative „foveale Resistenz“ üblich ist, die sich durch den Erhalt der subfovealen äußeren Netzhautschichten zeigt und für die intakte zentrale Sehschärfe verantwortlich ist, die selbst in fortgeschrittenen Krankheitsstadien beobachtet werden kann.6 Diese Schonung der Fovea dient als Grundlage für das von Dr. Eric Chen und Kollegen beschriebene „fliegende Untertasse“-Zeichen der HCQ-Retinopathie, bei dem ein eiförmiges Erscheinungsbild durch die intakten zentralen fovealen äußeren Netzhautstrukturen entsteht, die im Kontrast zu dem angrenzenden perifovealen Verlust des Photorezeptor-Ellipsoidbandes und der ONL-Atrophie stehen (siehe Abbildung 2).11
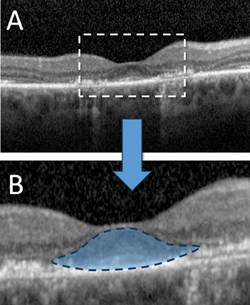
Abbildung 2. Optische Kohärenztomographie im Spektralbereich, die eine fortgeschrittene Hydroxychloroquin-Retinopathie mit parafovealem Verlust der äußeren Begrenzungsmembran, Störung der äußeren ellipsoiden Zone, Ausdünnung der äußeren Kernschicht und Störung der darunter liegenden retinalen Pigmentepithelschicht zeigt (A). Die relative Schonung der subfovealen Strukturen führt zu dem charakteristischen „fliegenden Untertassen“-Zeichen fortgeschrittener Toxizität (B).11
Während sich ein Großteil der Literatur auf die Veränderungen der äußeren Netzhaut bei HCQ-Retinopathie konzentriert hat, können die ersten SD-OCT-Befunde von Toxizität tatsächlich in der inneren Netzhaut lokalisiert sein. Sirichai Pasadhika, MD, und Kollegen beobachteten auf dem SD-OCT eine selektive Ausdünnung der perifovealen inneren Netzhaut, insbesondere der inneren plexiformen und Ganglienzellschichten, bei Patienten, die langfristig mit HCQ behandelt wurden (mehr als fünf Jahre), ohne dass strukturelle Veränderungen an der äußeren Netzhaut/RPE oder andere klinisch offensichtliche Toxizität vorlagen.12 Interessanterweise wurde bei diesen Patienten keine Ausdünnung der retinalen Nervenfaserschicht festgestellt, was nach Ansicht der Autoren erst dann der Fall ist, wenn eine signifikante Degeneration der retinalen Ganglienzellen stattgefunden hat. In einer separaten Studie, in der chronisch behandelte Patienten mit und ohne ophthalmoskopische Anzeichen von Toxizität verglichen wurden, wurde bei Patienten mit klinisch offensichtlicher Netzhauttoxizität eine signifikante Ausdünnung der inneren und äußeren Netzhaut sowie der gesamten Netzhaut beobachtet, während in der Gruppe ohne Fundusveränderungen nur eine selektive Ausdünnung der inneren Netzhaut festgestellt wurde.13 Auch hier war die RNFL-Ausdünnung bei Patienten mit chronischer HCQ-Exposition und ohne Fundusveränderungen nicht vorhanden; die Gruppe mit Fundusveränderungen im Zusammenhang mit der Medikamententoxizität wies jedoch eine peripapilläre RNFL-Ausdünnung auf. Kürzlich bestätigten Ulviye Yigit und ihre Mitautoren diese Ergebnisse, indem sie eine signifikante Ausdünnung der inneren Netzhaut während der HCQ-Therapie maßen, insbesondere in den para- und perifovealen Bereichen, ohne dass klinische Fundusveränderungen auftraten.14 Einzigartig an ihrer Studie war, dass die Patienten weniger als fünf Jahre lang mit HCQ behandelt wurden (durchschnittliche Dauer: 2,5 Jahre).
Weitere Untersuchungen mit einer größeren Anzahl von Patienten müssen durchgeführt werden, um besser bestimmen zu können, welche SD-OCT-basierten Indizes bei früher HCQ-Toxizität zuverlässig bewertet werden können. Angesichts der schnellen Bildaufnahmezeit, der nicht-invasiven Natur und der breiten Verfügbarkeit in vielen Kliniken bevorzugt die Mehrheit der Ärzte jedoch weiterhin die SD-OCT als primäre Ergänzung zur Gesichtsfeldprüfung beim HCQ-Screening.
Fundus-Autofluoreszenz
Die Bildgebung mit FAF kann dazu beitragen, toxische Veränderungen des zugrunde liegenden RPE aufgrund einer Langzeittherapie mit HCQ aufzuklären. Ein erhöhtes FAF-Signal deutet typischerweise auf eine Anhäufung von Lipofuszin, insbesondere des A2E-Fluorophors, im RPE hin, entweder aufgrund eines abnormalen Stoffwechsels mit erhöhter Phagozytose der Photorezeptoraußensegmente oder eines ererbten/erworbenen Defekts der phagozytotischen Prozesse.15,16 Ein erloschenes FAF-Signal deutet dagegen auf einen RPE-Zelltod hin.17
Der frühe Befund eines perizentralen Rings mit erhöhter FAF-Intensität, der als hyperfluoreszierendes Leuchten erscheint, kann bei HCQ-Toxizität auftreten, bevor sich eine RPE-Degeneration entwickelt, und man nimmt an, dass er Bereiche einer frühen Photorezeptorschädigung aufgrund der Ansammlung von Trümmern des äußeren Segments darstellt.4,18,19 Dies kann jedoch recht subtil sein und von einem ungeübten Untersucher leicht übersehen werden. Wenn beobachtet, wurden gleichzeitig mfERG- oder SD-OCT-Anomalien festgestellt, was auf eine pathophysiologische Grundlage für den FAF-Befund hindeutet.7,18 Trotzdem fehlt es insgesamt an Beweisen für die Nützlichkeit der FAF bei der Erkennung früher subklinischer Toxizität, was sie als primäres Screening-Instrument weniger zuverlässig macht.
Wichtiger als das Screening ist die Fähigkeit der FAF, den Verlauf bekannter Fälle von HCQ-Retinopathie zu überwachen, z. B. wenn ein Patient das Medikament abgesetzt hat, aber noch regelmäßige Nachuntersuchungen benötigt. In diesem Zusammenhang bietet die FAF einen empfindlichen Indikator für die Degeneration des RPE bei fortschreitender Toxizität, insbesondere in fortgeschrittenen Stadien. Während das RPE verkümmert, verändert sich die FAF-Intensität in der perizentralen Makula zu einem fleckigen oder gesprenkelten Aussehen und wächst schließlich zu dunklen Bereichen ohne FAF-Signal zusammen, wenn die Zellen abgestorben sind (siehe Abbildung 3).
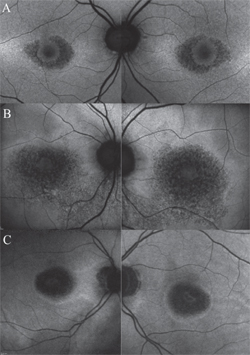
Abbildung 3. Fundus-Autofluoreszenzmuster in verschiedenen Stadien der Hydroxychloroquin-Retinopathie. Klassisches Erscheinungsbild der Bull’s-Eye-Makulopathie (A). Mit der Atrophie des RPE verändert sich die FAF-Intensität in der perizentralen Makula zu einem fleckigen oder gesprenkelten Erscheinungsbild (B), das schließlich zu dunklen Bereichen ohne FAF-Signal zusammenwächst, wenn die Zellen abgestorben sind (C). Diese dunklen Bereiche können von einem Rand mit erhöhter Autofluoreszenz begrenzt sein (A-C), was darauf hindeutet, welche RPE-Zellen als nächstes degenerieren werden.
Diese dunklen Regionen können von einem Rand mit erhöhter Autofluoreszenz umgeben sein, was darauf hindeutet, welche RPE-Zellen als nächstes degenerieren werden.17 Es ist anzumerken, dass nicht alle Fälle, die mit einer fortgeschrittenen Netzhautatrophie assoziiert sind, wie sie durch andere Techniken (z. B. SD-OCT) bestätigt werden, ein ausgeprägtes Erscheinungsbild in der FAF aufweisen. Dieser Befund unterstreicht die Bedeutung der AAO-Richtlinien, mehr als ein bildgebendes Verfahren zu verwenden, wenn toxische Wirkungen von HCQ festgestellt werden sollen.
Multifokale Elektroretinographie
Die herkömmliche Vollfeld-Elektroretinographie ist ein Test der globalen Netzhautfunktion als Reaktion auf photische Stimulation. Da sie nicht empfindlich auf funktionelle Veränderungen ist, die auf die Makula beschränkt sind, würde sie bei HCQ-Toxizität erst dann Anomalien zeigen, wenn bereits diffuse Netzhautschäden aufgetreten sind, was ihren Nutzen in Screening-Programmen einschränkt.4,9
Dagegen hat sich das multifokale ERG mit seiner Fähigkeit, lokalisierte zentrale Netzhautdefekte aufzuzeichnen, als ausgezeichneter Kandidat für die Erkennung subtiler Veränderungen in den frühen Stadien der Toxizität durchgesetzt.20 Raj Maturi, MD, und Kollegen berichteten erstmals über eine deutliche Verringerung der zentralen 16˚ mfERG-Amplitude bei einem Patienten mit manifester HCQ-Retinopathie im Rahmen eines normalen Ganzfeld-ERG.21 Ähnliche Ergebnisse wurden in nachfolgenden Studien zur Charakterisierung von HCQ-Anwendern erzielt. Timothy Y.Y. Lai, MMedSc, MRCS, und Kollegen beobachteten eine longitudinale Verschlechterung der Netzhautfunktion bei Patienten, die langfristig HCQ erhielten, und schlugen vor, dass ein serielles mfERG dazu beitragen kann, frühe Netzhautveränderungen im Zusammenhang mit der Toxizität zu erkennen.22 In einer Folgestudie zeigten sie, dass die mfERG-Antworten mit den mittleren Abweichungswerten der HVF 10-2 korrelierten und somit die Gesichtsfelduntersuchung ergänzen könnten, indem sie eine objektive Messung der Netzhautfunktion bei HCQ-Patienten ermöglichen.23
Das spezifischste Kurvenmuster, das bei Patienten mit HCQ-Toxizität beobachtet wird, ist der parazentrale Amplitudenverlust, der auf eine verminderte Netzhautfunktion in der anfälligen Perifovea hinweist. In einer anderen Studie schlugen Dr. Maturi und Kollegen vor, dass eine verlängerte implizite Zeit in Verbindung mit dem parazentralen Amplitudenverlust ein spezifischeres Merkmal der HCQ-Toxizität sein könnte.24 Darüber hinaus wiesen sie neben dem parazentralen Verlust drei weitere Konfigurationen abnormaler mfERG-Amplitudenänderungen nach: 1) zentraler fovealer Verlust; 2) peripherer Verlust; und 3) generalisierter Verlust.24 Ihr System zur Klassifizierung von Mustern von mfERG-Veränderungen wurde inzwischen von anderen Gruppen bestätigt.20,22
In dem Bestreben, die Sensitivität der mfERG-Standardinterpretation bei der Erkennung einer frühen HCQ-Toxizität zu erhöhen, entwickelten Jonathan S. Lyons, MD, und Matthew L. Severns, PhD, einen neuartigen Algorithmus für die tabellarische Erfassung von mfERG-Daten, die so genannte „Ring-Ratio-Methode“ (siehe Abbildung 4).20,25 Angesichts der Tatsache, dass die Amplitude eines einzelnen verabreichten mfERG um bis zu 30 Prozent von einem nachfolgenden Test abweichen kann,26 wurde die Ring-Ratio entwickelt, um dieses Hintergrundrauschen zu verringern und mehr normative Werte zur Unterstützung der klinischen Entscheidungsfindung zu schaffen. Zu diesem Zweck werden die Daten eines 61-Hexagon-mfERG in fünf Zonen mit konzentrischen Ringen (R1-R5) unterteilt.
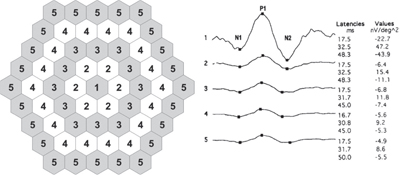
Abbildung 4. Die Ringverhältnismethode zur Interpretation des multifokalen Elektroretinogramms. Das Diagramm des 61-Hexagon-Stimulusmustersystems auf der linken Seite zeigt die Sechsecke, die zu jedem Ring gehören. Rechts sind die über die Ringe gemittelten Wellenformen eines normalen Patienten abgebildet. (Bildnachweis siehe Endnoten.)
Die Ringverhältnisse des mfERG sind definiert als das Verhältnis der zentralen Ringamplitude (R1) zu jeder der peripheren Ringamplituden, was fünf Messungen für jedes Auge ergibt: R1, R1/R2, R1/R3, R1/R4, und R1/R5. Da R1 im normalen Auge die höchste Ringamplitude hat, liegt das normale Ringverhältnis über 1,0; da jedoch die Bereiche mit verminderter mfERG-Amplitude bei HCQ-Toxizität typischerweise perizentral ringförmig sind und der zentrale Makulabereich in der Regel erst in einem späten Stadium des Krankheitsprozesses verschont bleibt, weisen diese Patienten typischerweise ein größeres Ringverhältnis auf, als zu erwarten wäre (oberhalb der 99 %-Grenzen der akzeptierten Normwerte, die aus einer Untergruppe gesunder Probanden gebildet wurden).20
Die mfERG-Untersuchung hat sich zwar als vielversprechendes objektives Mittel zur Erkennung einer frühen HCQ-Toxizität und zur Verfolgung des Fortschreitens von Makulaveränderungen bei bekannter Krankheit erwiesen, ist aber durch die Abhängigkeit von der Mitarbeit des Patienten, die Schulung des Fachpersonals für die Anwendung und Auswertung und die Gesamtkosten begrenzt. Am wichtigsten ist vielleicht, dass er nicht so leicht verfügbar oder so einfach und zuverlässig durchzuführen ist wie SD-OCT oder FAF, was seinen weit verbreiteten Einsatz bis heute einschränkt.
Kein einziger „bester Test“
Trotz der zunehmenden Integration dieser bildgebenden Systeme sowohl in der Forschung als auch in der klinischen Praxis gibt es nach wie vor keinen Konsens darüber, welcher Test der Goldstandard für die Erkennung einer frühen HCQ-Toxizität ist. Die Uneinigkeit ist in der gesamten Literatur offensichtlich, da verschiedene Befürworter für Gesichtsfelder, FAF, mfERG oder SD-OCT als die empfindlichste/spezifischste Methode plädiert haben. In einer kürzlich durchgeführten retrospektiven, privatärztlichen Studie mit 219 Patienten kam David J. Browning, MD, PhD, zu dem Schluss, dass die überarbeiteten Leitlinien, die den Schwerpunkt auf zusätzliche FAF-, SD-OCT- oder mfERG-Untersuchungen legen, die Kosten für das Screening erhöht haben, ohne die Erkennung von Toxizität zu verbessern.27
Andererseits haben andere darauf hingewiesen, dass sich bestimmte Patienten in ihrer offensichtlichen Empfindlichkeit gegenüber verschiedenen Tests unterscheiden können und daher ein sorgfältiges Screening mit mehreren Modalitäten wahrscheinlich die diagnostische Ausbeute bei der Erkennung von Toxizität vor dem Einsetzen irreversibler struktureller/funktioneller Verluste erhöht.7 Dr. Michael Marmor und Dr. Ronald Melles haben kürzlich die Notwendigkeit dieses vielschichtigen Ansatzes an einer Untergruppe von 11 Patienten veranschaulicht, die 10 Prozent ihrer Patienten mit bekannter HCQ-Toxizität ausmachten. Diese Kohorte wies pathognomonische 10-2-Feldverluste mit ausgeprägten parafovealen Ringskotomen auf, die stark auf eine Retinopathie hindeuteten; sie zeigten jedoch keine Hinweise auf strukturelle Schäden in der SD-OCT-Bildgebung.28 Die Autoren betonten die Notwendigkeit, beim HCQ-Screening einen umfassenden Ansatz zu verfolgen, sich nicht nur auf ein einziges Verfahren zu verlassen und zweideutige Ergebnisse durch zusätzliche Bestätigungstests zu überprüfen.
Future Directions
Das Aufkommen der adaptiven Optik hat die Visualisierung des Photorezeptormosaiks der Zapfen in vivo mit einer Auflösung von ≤ 2 µm ermöglicht, indem Aberrationen in der Augenoptik kompensiert wurden.29-31 Mit dieser Technologie wurden Photorezeptoranomalien bei verschiedenen Netzhauterkrankungen aufgedeckt, die mit SD-OCT-Bildgebung nicht erkennbar waren.32,33
Der Einsatz der adaptiven Optik bei HCQ-Retinopathie ist relativ neu. Dr. Kimberly E. Stepien und Kollegen wiesen bei zwei Patienten mit Langzeit-HCQ-Therapie eine Störung des Zapfen-Photorezeptor-Mosaiks in Bereichen nach, die HVF 10-2-Defekten und SD-OCT-Anomalien in der ellipsoiden Zone entsprachen.33 In ähnlicher Weise beobachteten koreanische Forscher bei einem Patienten mit Bull’s-Eye-Makulopathie ein gestörtes Zapfen-Mosaikmuster mit einzelnen Zapfen, die unregelmäßige Formen und Größen aufwiesen.34 Darüber hinaus war die gemessene Gesamt-Zapfendichte an allen vorbestimmten Testpunkten in verschiedenen Entfernungen vom fovealen Zentrum vermindert. Zusammengenommen schlagen beide Gruppen vor, dass die AO eine nicht-invasive, quantitative, hochauflösende Methode zur Bildgebung bei Patienten mit HCQ-Retinopathie darstellt und die Erkennung von subklinischen Anomalien ermöglicht, die einem objektiven Gesichtsfeldausfall vorausgehen. Größere Studien sind erforderlich, um diese Ergebnisse zu validieren.
In jüngster Zeit haben zwei Gruppen die Verwendung von Mikroperimetrie-Systemen zur Bewertung der frühen HCQ-Toxizität beschrieben.35,36 Durch die Prüfung der Perimetrie unter gleichzeitiger Fundusvisualisierung kann ein präzises anatomisches Korrelat zu einer funktionellen Abweichung erhalten werden.35 Lucia Martinez-Costa und Kollegen beobachteten signifikante Unterschiede in der mikroperimetrischen Messung der Netzhautsensibilität zwischen 209 Patienten, die entweder HCQ oder Chloroquin einnahmen, und 204 Kontrollpersonen.36 Renu Jivrajka, MD, und Kollegen beschrieben ihre Ergebnisse in einer Kohorte von 16 Patienten, die seit mehr als fünf Jahren mit HCQ behandelt wurden und bei denen konventionelle 10-2 HVF-, SD-OCT-, FAF- oder mfERG-Tests keine Anzeichen von Toxizität ergaben; bei der Mikroperimetrie stellten sie jedoch eine signifikante Gesamtverringerung der mittleren Netzhautsensitivität zwischen Patienten und altersgleichen Kontrollpersonen fest.35 Ein zusätzlicher Vorteil des verwendeten Mikroperimetriesystems war die Möglichkeit, gleichzeitig SD-OCT-Bilder zu erhalten und die Werte für die Netzhautsensitivität und -dicke zu überlagern, was den Gedanken der Korrelation zwischen funktioneller Reaktion und anatomischer Struktur weiter untermauert. Zukünftige prospektive Längsschnittstudien mit seriellen Mikroperimetrie-Tests sind erforderlich, um besser bestimmen zu können, ob die verringerte Netzhautsensitivität tatsächlich eine frühe subklinische HCQ-Toxizität darstellt.
Hydroxychloroquin ist ein wertvolles Medikament mit einem insgesamt niedrigen Nebenwirkungsprofil. Obwohl okulare toxische Wirkungen selten sind, können sie mit einer erheblichen und irreversiblen Morbidität der Patienten verbunden sein. Eine frühzeitige Erkennung der Toxizität in subklinischen Stadien und das Absetzen des Medikaments können dazu beitragen, eine weitere strukturelle und funktionelle Verschlechterung zu verhindern. Aus diesem Grund sollten Kliniker eine niedrige Schwelle für den Verdacht auf HCQ-Toxizität einhalten. Subtile Anomalien, die mit einer Methode entdeckt werden, rechtfertigen zusätzliche Folgeuntersuchungen, um diese Befunde zu bestätigen oder zu widerlegen, mit dem letztendlichen Ziel einer frühzeitigen Diagnose vor einem irreversiblen Sehverlust. REVIEW
Abbildung 4 reproduziert mit Genehmigung von: Lyons JS, Severns ML. Früherkennung von Hydroxychloroquin-Netzhauttoxizität durch Ringverhältnisanalyse der multifokalen Elektroretinographie. Am J Ophthalmol 2007. May;143(5):801-809.
Dr. Rahimy ist Stipendiat im zweiten Jahr am Wills Eye Hospital und klinischer Dozent für Augenheilkunde an der Thomas Jefferson University School of Medicine. Dr. Vander ist behandelnder Chirurg des Retina-Service am Wills Eye Hospital und Professor für Augenheilkunde an der Thomas Jefferson University School of Medicine. Dr. Rahimy kann unter [email protected] kontaktiert werden. Dr. Vander kann unter jvander@midatlantic retina.com kontaktiert werden.
1. Tehrani R, Ostrowski RA, Hariman R, Jay WM. Okuläre Toxizität von Hydroxychloroquin. Semin Ophthalmol 2008;23(3):201-209.
2. Semmer AE, Lee MS, Harrison AR, Olsen TW. Hydroxychloroquine retinopathy screening. Br J Ophthalmol 2008;92(12): 1653-1655.
3. Wolfe F, Marmor MF. Raten und Prädiktoren der Hydroxychloroquin-Netzhauttoxizität bei Patienten mit rheumatoider Arthritis und systemischem Lupus erythematodes. Arthritis Care Res (Hoboken) 2010;62(6):775-784.
4. Marmor MF, Kellner U, Lai TY, Lyons JS, Mieler WF. Überarbeitete Empfehlungen zum Screening auf Chloroquin- und Hydroxychloroquin-Retinopathie. Ophthalmology 2011;118:415-422.
5. Michaelides M, Stover NB, Francis PJ, Weleber RG. Retinale Toxizität im Zusammenhang mit Hydroxychloroquin und Chloroquin: Risikofaktoren, Screening und Progression trotz Therapieabbruch. Arch Ophthalmol 2011;129:30-39.
6. Mititelu M, Wong BJ, Brenner M, Bryar PJ, Jampol LM, Fawzi AA. Progression der toxischen Wirkungen von Hydroxychloroquin nach Beendigung der medikamentösen Therapie: New evidence from multimodal imaging. JAMA Ophthalmol 2013;131:1187-1197.
7. Marmor MF. Vergleich von Screeningverfahren bei Hydroxychloroquin-Toxizität. Arch Ophthalmol 2012;130:461-469.
8. Elder M, Rahman AM, McLay J. Early paracentral visual field loss in patients taking hydroxychloroquine. Arch Ophthalmol 2006;124:1729-1733.
9. Marmor MF, Carr RE, Easterbrook M, Farjo AA, Mieler WF. Empfehlungen zum Screening auf Chloroquin- und Hydroxychloroquin-Retinopathie: Ein Bericht der American Academy of Ophthalmology. Ophthalmology 2002;109:1377-1382.
10. Kellner S, Weinitz S, Kellner U. Spectral domain optical coherence tomography detects early stages of chloroquine retinopathy similar to multifocal electroretinography, fundus autofluorescence and near-infrared autofluorescence. Br J Ophthalmol 2009;93(11):1444-1447.
11. Chen E, Brown DM, Benz MS, et al. Spectral domain optical coherence tomography as an effective screening test for hydroxychloroquine retinopathy (the „flying saucer“ sign). Clin Ophthalmol 2010;4:1151-1158.
12. Pasadhika S, Fishman GA, Choi D, Shahidi M. Selective thinning of the perifoveal inner retina as an early sign of hydroxychloroquine retinal toxicity. Eye (Lond) 2010;24(5):756-762; quiz 763.
13. Pasadhika S, Fishman GA. Auswirkungen einer chronischen Exposition gegenüber Hydroxychloroquin oder Chloroquin auf innere Netzhautstrukturen. Eye (Lond) 2010;24(2):340-346.
14. Ulviye Y, Betul T, Nur TH, Selda C. Spectral domain optical coherence tomography for early detection of retinal alterations in patients using hydroxychloroquine. Indian J Ophthalmol 2013;61(4):168-171.
15. Kennedy CJ, Rakoczy PE, Constable IJ. Lipofuscin des retinalen Pigmentepithels: A review. Eye (Lond) 1995;9 ( Pt 6)):763-771.
16. Okubo A, Rosa RH, Jr., Bunce CV, et al. The relationships of age changes in retinal pigment epithelium and Bruch’s membrane. Invest Ophthalmol Vis Sci 1999;40(2):443-449.
17. Holz FG, Bellmann C, Staudt S, Schutt F, Volcker HE. Fundusautofluoreszenz und Entwicklung der geographischen Atrophie bei altersbedingter Makuladegeneration. Invest Ophthalmol Vis Sci 2001;42(5):1051-1056.
18. Kellner U, Renner AB, Tillack H. Fundusautofluoreszenz und mfERG zur Früherkennung von Netzhautveränderungen bei Patienten unter Chloroquin/Hydroxychloroquin. Invest Ophthalmol Vis Sci 2006;47(8):3531-3538.
19. Marmor MF. Fundusautofluoreszenz ist nicht das beste Frühscreening für Hydroxychloroquin-Toxizität. JAMA Ophthalmol 2013;131:1487-1488.
20. Lyons JS, Severns ML. Erkennung einer frühen Hydroxychloroquin-Netzhauttoxizität durch Ringverhältnisanalyse der multifokalen Elektroretinographie verbessert. Am J Ophthalmol 2007;143:801-809.
21. Maturi RK, Folk JC, Nichols B, Oetting TT, Kardon RH. Hydroxychloroquin-Retinopathie. Arch Ophthalmol 1999;117:1262-1263.
22. Lai TY, Chan WM, Li H, Lai RY, Lam DS. Multifokale elektroretinographische Veränderungen bei Patienten unter Hydroxychloroquin-Therapie. Am J Ophthalmol 2005;140:794-807.
23. Lai TY, Ngai JW, Chan WM, Lam DS. Gesichtsfeld und multifokale Elektroretinographie und ihre Korrelationen bei Patienten unter Hydroxychloroquin-Therapie. Doc Ophthalmol 2006;112(3):177-187.
24. Maturi RK, Yu M, Weleber RG. Multifokale elektroretinographische Auswertung von Langzeitanwendern von Hydroxychloroquin. Arch Ophthalmol 2004;122:973-981.
25. Lyons JS, Severns ML. Using multifocal ERG ring ratios to detect and follow Plaquenil retinal toxicity: a review : Review of mfERG ring ratios in Plaquenil toxicity. Doc Ophthalmol 2009;118(1):29-36.
26. Tzekov RT, Gerth C, Werner JS. Seneszenz von Komponenten des menschlichen multifokalen Elektroretinogramms: A localized approach. Graefes Arch Clin Exp Ophthalmol 2004;242(7):549-560.
27. Browning DJ. Auswirkungen der überarbeiteten Richtlinien der American Academy of Ophthalmology zum Hydroxychloroquin-Screening auf die tatsächliche Praxis. Am J Ophthalmol 2013;155:418-428.e411.
28. Marmor MF, Melles RB. Disparität zwischen Gesichtsfeld und optischer Kohärenztomographie bei Hydroxychloroquin-Retinopathie. Ophthalmology 2014;121:1257-62.
29. Roorda A, Romero-Borja F, Donnelly Iii W, Queener H, Hebert T, Campbell M. Adaptive optics scanning laser ophthalmoscopy. Opt Express 2002;10(9):405-412.
30. Park SP, Chung JK, Greenstein V, Tsang SH, Chang S. A study of factors affecting the human cone photoreceptor density measured by adaptive optics scanning laser ophthalmoscope. Exp Eye Res 2013;108:1-9.
31. Kim JE, Chung M. Adaptive optics for retinal imaging: Current status. Retina 2013;33:1483-1486.
32. Carroll J, Neitz M, Hofer H, Neitz J, Williams DR. Funktioneller Photorezeptorverlust mit adaptiver Optik nachgewiesen: An alternate cause of color blindness. Proc Natl Acad Sci U S A 2004;101(22):8461-8466.
33. Stepien KE, Martinez WM, Dubis AM, Cooper RF, Dubra A, Carroll J. Subclinical photoreceptor disruption in response to severe head trauma. Arch Ophthalmol 2012;130:400-402.
34. Bae EJ, Kim KR, Tsang SH, Park SP, Chang S. Retinal damage in chloroquine maculopathy, revealed by high resolution imaging: A case report utilizing adaptive optics scanning laser ophthalmoscopy. Korean J Ophthalmol 2014;28(1):100-107.
35. Jivrajka RV, Genead MA, McAnany JJ, Chow CC, Mieler WF. Mikroperimetrische Empfindlichkeit bei Patienten unter Hydroxychloroquin (Plaquenil) Therapie. Eye (Lond) 2013;27(9):1044-1052.
36. Martinez-Costa L, Victoria Ibanez M, Murcia-Bello C, et al. Use of microperimetry to evaluate hydroxychloroquine and chloroquine retinal toxicity. Can J Ophthalmol 2013;48(5):400-405.