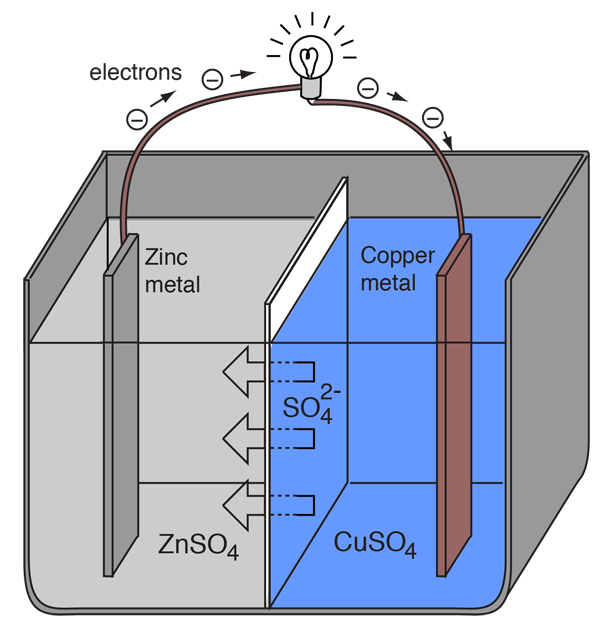
Elektrochemický článek, ve kterém protéká vnější elektrický proud, lze vytvořit ze dvou různých kovů, protože kovy se liší svou tendencí ztrácet elektrony. Zinek ztrácí elektrony snadněji než měď, takže umístění kovového zinku a mědi do roztoků jejich solí může způsobit tok elektronů vnějším vodičem, který vede od zinku k mědi.
Přidej anotaci k obrázku
Když atom zinku poskytne elektrony, stane se kladným iontem a přejde do vodného roztoku, čímž se zmenší hmotnost zinkové elektrody. Na straně mědi dva přijaté elektrony umožňují přeměnit měďnatý iont z roztoku na nenabitý atom mědi, který se usazuje na měděné elektrodě a zvyšuje její hmotnost. Obě reakce se obvykle zapisují
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Písmena v závorkách jen připomínají, že zinek přechází z pevné látky (s) do vodného roztoku (aq) a naopak pro měď. V jazyce elektrochemie je typické označovat tyto dva procesy jako „poloreakce“, které probíhají na dvou elektrodách.
Zn(s) -> Zn2+(aq) + 2e- |
„Poloreakce“ zinku se klasifikuje jako oxidace, protože ztrácí elektrony. Terminál, na kterém dochází k oxidaci, se nazývá „anoda“. U baterie je to záporný pól. |
|
Měď „poloreakce“ se klasifikuje jako redukce, protože získává elektrony. Terminál, na kterém dochází k redukci, se nazývá „katoda“. U baterie je to kladný pól. |
Cu2+(aq) + 2e- -> Cu(s) |
Aby voltážní článek mohl nadále vyrábět vnější elektrický proud, musí docházet k pohybu síranových iontů v roztoku zprava doleva, aby se vyrovnal tok elektronů ve vnějším obvodu. Samotným kovovým iontům musí být zabráněno v pohybu mezi elektrodami, takže nějaký druh porézní membrány nebo jiný mechanismus musí zajistit selektivní pohyb záporných iontů v elektrolytu zprava doleva.
Energie je potřebná k tomu, aby donutila elektrony pohybovat se od zinkové k měděné elektrodě, a množství energie připadající na jednotku náboje dostupného z voltového článku se nazývá elektromotorická síla (emf) článku. Energie na jednotku náboje se vyjadřuje ve voltech (1 volt = 1 joule/coulomb).
Je zřejmé, že abychom z článku získali energii, musí se při oxidaci zinku uvolnit více energie, než je potřeba k redukci mědi. Článek může z tohoto procesu získat konečné množství energie, přičemž proces je omezen množstvím dostupného materiálu buď v elektrolytu, nebo v kovových elektrodách. Pokud by například na straně mědi byl jeden mol síranových iontů SO42-, pak je proces omezen na přenos dvou molů elektronů přes vnější obvod. Množství elektrického náboje obsaženého v jednom molu elektronů se nazývá Faradayova konstanta a rovná se Avogadrovo číslo krát náboj elektronů:
Energetický výtěžek z voltového článku je dán napětím článku krát počet molů přenesených elektronů krát Faradayova konstanta.
Výkon elektrické energie = nFEcell
Emf článku Ecell lze předpovědět ze standardních elektrodových potenciálů pro dva kovy. Pro článek zinek/měď za standardních podmínek je vypočtený potenciál článku 1,1 voltu.
| Suché články | Olověné baterie |