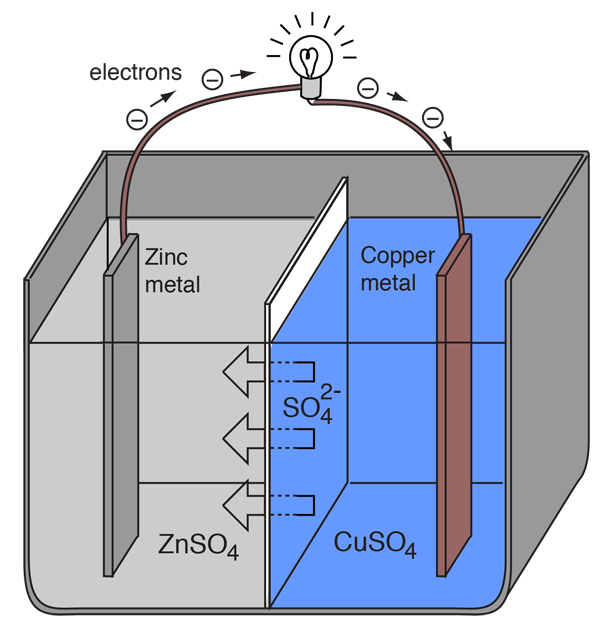
Ogniwo elektrochemiczne, które powoduje zewnętrzny przepływ prądu elektrycznego, można utworzyć przy użyciu dowolnych dwóch różnych metali, ponieważ metale różnią się skłonnością do utraty elektronów. Cynk łatwiej traci elektrony niż miedź, więc umieszczenie cynku i miedzi w roztworach ich soli może spowodować przepływ elektronów przez zewnętrzny przewód, który prowadzi od cynku do miedzi.
Dodaj adnotację do ilustracji
Ponieważ atom cynku dostarcza elektronów, staje się jonem dodatnim i przechodzi do roztworu wodnego, zmniejszając masę elektrody cynkowej. Po stronie miedzi, dwa otrzymane elektrony pozwalają jej na przekształcenie jonu miedzi z roztworu w nienaładowany atom miedzi, który osadza się na elektrodzie miedzianej, zwiększając jej masę. Te dwie reakcje zapisuje się zwykle
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Literki w nawiasach przypominają, że cynk przechodzi z ciała stałego (s) do roztworu wodnego (aq) i odwrotnie dla miedzi. W języku elektrochemii typowe jest określanie tych dwóch procesów jako „półreakcji”, które zachodzą na dwóch elektrodach.
Zn(s) -> Zn2+(aq) + 2e- |
Półreakcja” cynku jest klasyfikowana jako utlenianie, ponieważ traci on elektrony. Końcówka, na której zachodzi utlenianie nazywana jest „anodą”. W przypadku baterii jest to zacisk ujemny. |
|
Półreakcja miedzi jest klasyfikowana jako redukcja, ponieważ zyskuje ona elektrony. Końcówka, na której zachodzi redukcja nazywana jest „katodą”. W przypadku baterii jest to biegun dodatni. |
Cu2+(aq) + 2e- -> Cu(s) |
Aby ogniwo woltaiczne mogło nadal wytwarzać zewnętrzny prąd elektryczny, musi zachodzić ruch jonów siarczanowych w roztworze z prawej strony na lewą, aby zrównoważyć przepływ elektronów w obwodzie zewnętrznym. Same jony metalu muszą być pozbawione możliwości przemieszczania się pomiędzy elektrodami, więc jakiś rodzaj porowatej membrany lub inny mechanizm musi zapewniać selektywny ruch jonów ujemnych w elektrolicie z prawej strony na lewą.
Energia jest wymagana, aby zmusić elektrony do przemieszczania się z elektrody cynkowej na miedzianą, a ilość energii na jednostkę ładunku dostępnego z ogniwa woltaicznego jest nazywana siłą elektromotoryczną (emf) ogniwa. Energia na jednostkę ładunku wyrażana jest w woltach (1 wolt = 1 dżul/kulomb).
Wyraźnie, aby uzyskać energię z ogniwa, musisz uzyskać więcej energii uwolnionej z utleniania cynku niż potrzeba na redukcję miedzi. Ogniwo może dostarczyć skończoną ilość energii z tego procesu, proces jest ograniczony przez ilość materiału dostępnego albo w elektrolicie albo w metalowych elektrodach. Na przykład, jeśli po stronie miedzi znajduje się jeden mol jonów siarczanowych SO42-, to proces jest ograniczony do przeniesienia dwóch moli elektronów przez obwód zewnętrzny. Ilość ładunku elektrycznego zawartego w jednym molu elektronów nazywana jest stałą Faradaya i jest równa liczbie Avogadro pomnożonej przez ładunek elektronu:
Wydobycie energii z ogniwa woltaicznego jest dane przez napięcie ogniwa razy liczbę moli przeniesionych elektronów razy stałą Faradaya.
Wydajność energii elektrycznej = nFE ogniwa
Emf ogniwa Ecell można przewidzieć na podstawie standardowych potencjałów elektrod dla dwóch metali. Dla ogniwa cynk/miedź w warunkach standardowych, obliczony potencjał ogniwa wynosi 1,1 V.
| Ogniwa suche | Baterie kwasowo-ołowiowe |