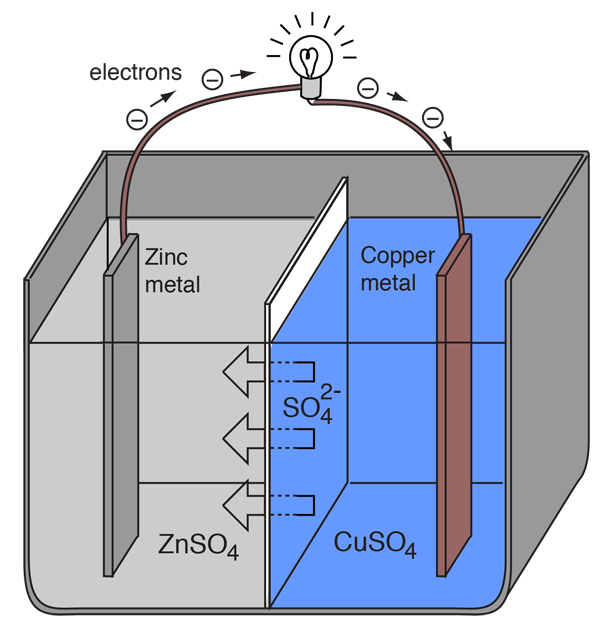
En elektrokemisk cell som orsakar ett externt elektriskt strömflöde kan skapas med hjälp av två olika metaller eftersom metaller skiljer sig åt i sin tendens att förlora elektroner. Zink förlorar lättare elektroner än koppar, så genom att placera zink- och kopparmetall i lösningar av deras salter kan man få elektroner att flöda genom en extern tråd som leder från zink till koppar.
Tillägg kommentar till illustration
När en zinkatom tillhandahåller elektronerna blir den en positiv jon och går in i en vattenlösning, vilket minskar massan hos zinkelektroden. På kopparsidan gör de två mottagna elektronerna att den kan omvandla en kopparjon från lösningen till en oladdad kopparatom som lägger sig på kopparelektroden, vilket ökar dess massa. De två reaktionerna skrivs vanligtvis
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Bokstäverna inom parentes är bara en påminnelse om att zinken går från ett fast ämne (s) till en vattenlösning (aq) och tvärtom för kopparen. Det är typiskt i elektrokemins språkbruk att hänvisa till dessa två processer som ”halvreaktioner” som sker vid de två elektroderna.
Zn(s) -> Zn2+(aq) + 2e- |
Zinkens ”halvreaktion” klassificeras som oxidation eftersom det förlorar elektroner. Den terminal vid vilken oxidation sker kallas ”anod”. För ett batteri är detta den negativa polen. |
|
Kopparns ”halvreaktion” klassificeras som reduktion eftersom den får elektroner. Den terminal vid vilken reduktion sker kallas ”katod”. För ett batteri är detta den positiva polen. |
Cu2+(aq) + 2e- -> Cu(s) |
För att voltacellen ska kunna fortsätta att producera en extern elektrisk ström måste det ske en förflyttning av sulfatjonerna i lösningen från höger till vänster för att balansera elektronflödet i den externa kretsen. Metalljonerna själva måste hindras från att röra sig mellan elektroderna, så något slags poröst membran eller annan mekanism måste sörja för den selektiva rörelsen av de negativa jonerna i elektrolyten från höger till vänster.
Energi krävs för att tvinga elektronerna att förflytta sig från zink- till kopparelektroden, och den mängd energi per laddningsenhet som är tillgänglig från voltacellen kallas cellens elektromotoriska kraft (emf). Energi per laddningsenhet uttrycks i volt (1 volt = 1 joule/coulomb).
För att få energi från cellen måste man tydligen få mer energi frigjord från oxidationen av zinken än vad som krävs för att reducera kopparen. Cellen kan ge en ändlig mängd energi från denna process, eftersom processen begränsas av den mängd material som finns tillgängligt antingen i elektrolyten eller i metallelektroderna. Om det till exempel finns en mol av sulfatjonerna SO42- på kopparsidan är processen begränsad till att överföra två mol elektroner genom den externa kretsen. Mängden elektrisk laddning som ingår i ett mol elektroner kallas Faradaykonstanten och är lika med Avogadros tal gånger elektronens laddning:
Energieutbytet från en voltaiccell ges av cellspänningen gånger antalet mol överförda elektroner gånger Faradaykonstanten.
Elektriskt energiutbyte = nFEcell
Cellens emf Ecell kan förutsägas från standardelektrodpotentialen för de två metallerna. För zink/koppercellen under standardförhållanden är den beräknade cellpotentialen 1,1 volt.
| Torkceller | Blybatterier |