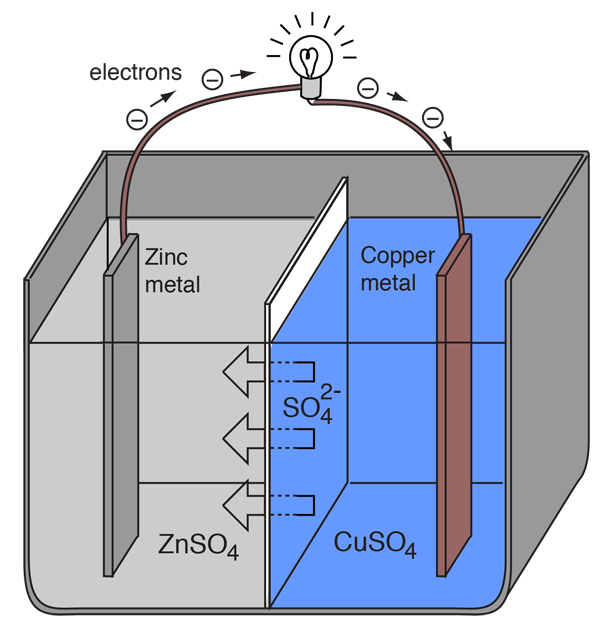
Elektrokémiai cellát, amely külső elektromos áram folyását okozza, két különböző fém felhasználásával lehet létrehozni, mivel a fémek elektronvesztési hajlamukban különböznek. A cink könnyebben veszít elektronokat, mint a réz, ezért a cink és a réz fémeket sóik oldatába helyezve elektronok áramlását idézhetjük elő egy külső vezetéken keresztül, amely a cinkről a rézre vezet.
Jegyzet hozzáadása az ábrához
Mivel a cinkatom elektronokat szolgáltat, pozitív ionná válik, és vizes oldatba kerül, csökkentve a cinkelektród tömegét. A rézoldalon a kapott két elektron lehetővé teszi, hogy egy réziont az oldatból töltés nélküli rézatommá alakítson át, amely lerakódik a rézelektródra, növelve annak tömegét. A két reakciót jellemzően így írjuk le
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
A zárójelben lévő betűk csak arra emlékeztetnek, hogy a cink szilárd anyagból (s) vízoldatba (aq) megy, és fordítva a réz esetében. Az elektrokémia nyelvében jellemző, hogy ezt a két folyamatot “félreakciónak” nevezzük, amelyek a két elektródon játszódnak le.
Zn(s) -> Zn2+(aq) + 2e- |
A cink “félreakciója” oxidációnak minősül, mivel elektronokat veszít. Azt a terminált, ahol az oxidáció bekövetkezik, “anódnak” nevezzük. Egy akkumulátor esetében ez a negatív pólus. |
|
A réz “félreakciója” redukciónak minősül, mivel elektronokat nyer. Azt a terminált, ahol a redukció bekövetkezik, “katódnak” nevezzük. Egy akkumulátor esetében ez a pozitív pólus. |
Cu2+(aq) + 2e- -> Cu(s) |
Hogy a voltacella továbbra is külső elektromos áramot termeljen, az oldatban lévő szulfátionoknak jobbról balra kell mozogniuk, hogy a külső áramkörben az elektronáramlás egyensúlyban legyen. Magukat a fémionokat meg kell akadályozni abban, hogy az elektródák között mozogjanak, ezért valamilyen porózus membránnak vagy más mechanizmusnak kell gondoskodnia az elektrolitban lévő negatív ionok szelektív mozgásáról jobbról balra.
Energiára van szükség ahhoz, hogy az elektronok a cinkelektródáról a rézelektródára kényszerüljenek, és a voltaelem egy töltésegységre jutó energiamennyiségét a cella elektromotoros erejének (emf) nevezzük. Az egységnyi töltésre jutó energiát volttal fejezzük ki (1 volt = 1 joule/koulomb).
A cellából származó energia kinyeréséhez nyilvánvalóan több energiát kell felszabadítani a cink oxidációjából, mint amennyi a réz redukciójához szükséges. A cella ebből a folyamatból véges mennyiségű energiát tud kinyerni, a folyamatot az elektrolitban vagy a fémelektródákban rendelkezésre álló anyag mennyisége korlátozza. Ha például a rézoldalon egy mól SO42- szulfátion lenne, akkor a folyamat két mól elektron átvitelére korlátozódik a külső áramkörön keresztül. Az egy mól elektronban lévő elektromos töltés mennyiségét Faraday-állandónak nevezzük, és egyenlő az Avogadro-szám és az elektrontöltés szorzatával:
A voltaelem energiakihozatalát a cellafeszültség szorozva az átvitt elektronok mólszámának szorozva a Faraday-állandóval adja meg.
Elektromos energiakihozatal = nFEcell
A cella emf-je Ecell a két fém szabványos elektródpotenciáljaiból megjósolható. A cink/réz cella esetében a standard körülmények között a számított cellapotenciál 1,1 volt.
| Száraz cellák | Ólomsavas akkumulátorok |