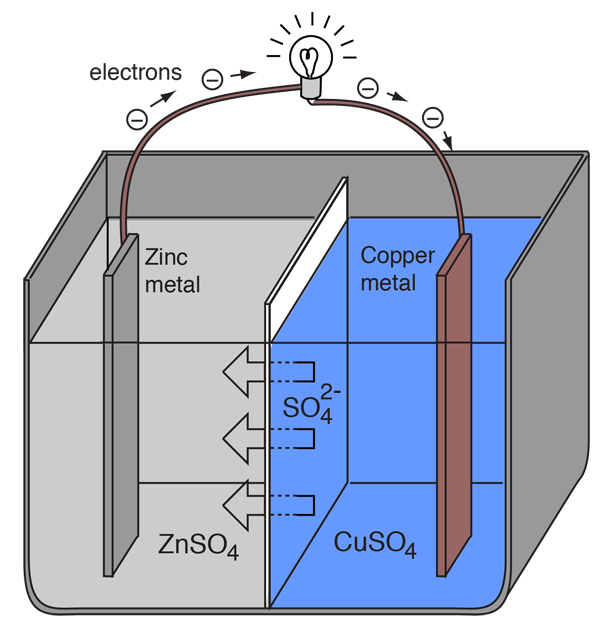
Una célula electroquímica que provoque un flujo de corriente eléctrica externa puede crearse utilizando dos metales diferentes, ya que los metales difieren en su tendencia a perder electrones. El zinc pierde electrones más fácilmente que el cobre, por lo que colocar el zinc y el cobre metálicos en soluciones de sus sales puede hacer que los electrones fluyan a través de un cable externo que lleve del zinc al cobre.
Añadir anotación a la ilustración
Como un átomo de zinc proporciona los electrones, se convierte en un ion positivo y pasa a la solución acuosa, disminuyendo la masa del electrodo de zinc. En el lado del cobre, los dos electrones recibidos le permiten convertir un ion de cobre de la solución en un átomo de cobre sin carga que se deposita en el electrodo de cobre, aumentando su masa. Las dos reacciones se escriben típicamente
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Las letras entre paréntesis sólo recuerdan que el zinc pasa de un sólido (s) a una solución acuosa (aq) y viceversa para el cobre. Es típico en el lenguaje de la electroquímica referirse a estos dos procesos como «semirreacciones» que ocurren en los dos electrodos.
Zn(s) -> Zn2+(aq) + 2e- |
La «semirreacción» del zinc se clasifica como oxidación ya que pierde electrones. El terminal en el que se produce la oxidación se llama «ánodo». Para una pila, éste es el terminal negativo. |
|
La «semirreacción» del cobre se clasifica como reducción ya que gana electrones. El terminal en el que se produce la reducción se denomina «cátodo». En el caso de una pila, es el terminal positivo. |
Cu2+(aq) + 2e- -> Cu(s) |
Para que la célula voltaica continúe produciendo una corriente eléctrica externa, debe haber un movimiento de los iones de sulfato en solución de la derecha a la izquierda para equilibrar el flujo de electrones en el circuito externo. Los propios iones metálicos deben ser impedidos de moverse entre los electrodos, así que algún tipo de membrana porosa u otro mecanismo debe proporcionar el movimiento selectivo de los iones negativos en el electrolito de la derecha a la izquierda.
Se requiere energía para obligar a los electrones a moverse del electrodo de zinc al de cobre, y la cantidad de energía por unidad de carga disponible de la célula voltaica se llama fuerza electromotriz (emf) de la célula. La energía por unidad de carga se expresa en voltios (1 voltio = 1 julio/culombio).
Claramente, para obtener energía de la célula, se debe obtener más energía liberada de la oxidación del zinc que la que se necesita para reducir el cobre. La célula puede producir una cantidad finita de energía de este proceso, siendo el proceso limitado por la cantidad de material disponible en el electrolito o en los electrodos metálicos. Por ejemplo, si hubiera un mol de los iones sulfato SO42- en el lado del cobre, entonces el proceso está limitado a transferir dos moles de electrones a través del circuito externo. La cantidad de carga eléctrica contenida en un mol de electrones se denomina constante de Faraday, y es igual al número de Avogadro por la carga del electrón:
El rendimiento energético de una célula voltaica viene dado por el voltaje de la célula por el número de moles de electrones transferidos por la constante de Faraday.
La producción de energía eléctrica = nFEcell
La emf de la célula Ecell puede predecirse a partir de los potenciales de electrodo estándar para los dos metales. Para la célula de zinc/cobre en las condiciones estándar, el potencial de célula calculado es de 1,1 voltios.
| Células secas | Baterías de plomo |