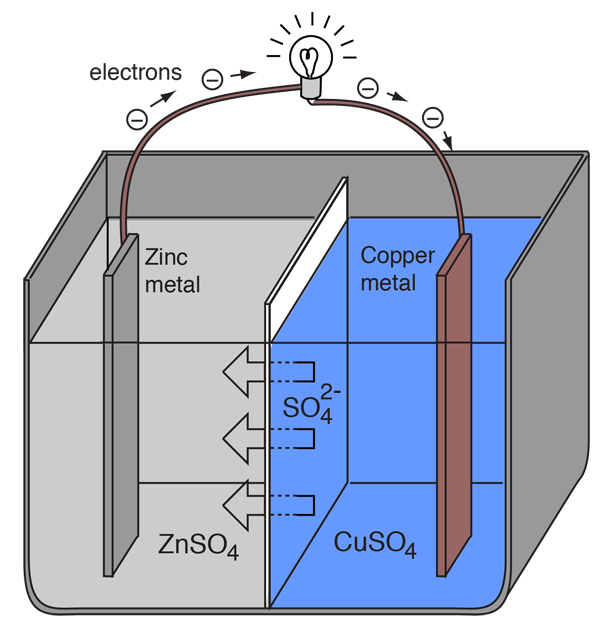
Elektrokemiallinen kenno, joka aiheuttaa ulkoisen sähkövirran kulun, voidaan luoda käyttämällä mitä tahansa kahta eri metallia, koska metalleilla on erilainen taipumus menettää elektroneja. Sinkki menettää helpommin elektroneja kuin kupari, joten sinkki- ja kuparimetallien sijoittaminen niiden suolojen liuoksiin voi aiheuttaa elektronien virtauksen ulkoisen johtimen läpi, joka johtaa sinkistä kupariin.
Lisää kommentti kuvaan
Kun sinkkiatomi luovuttaa elektroneja, siitä tulee positiivinen ioni ja se menee vesiliuokseen, jolloin sinkkielektrodin massa pienenee. Kuparin puolella saadut kaksi elektronia mahdollistavat sen, että se muuttaa liuoksesta tulevan kupari-ionin varauksettomaksi kupariatomiksi, joka laskeutuu kuparielektrodille, jolloin sen massa kasvaa. Nämä kaksi reaktiota kirjoitetaan tyypillisesti
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Sulkeissa olevat kirjaimet ovat vain muistutuksia siitä, että sinkki siirtyy kiinteästä aineesta (s) vesiliuokseksi (aq) ja kupari päinvastoin. Sähkökemian kielessä on tyypillistä kutsua näitä kahta prosessia ”puolireaktioiksi”, jotka tapahtuvat kahdessa elektrodissa.
Zn(s) -> Zn2+(aq) + 2e- |
Sinkin ”puolireaktio” luokitellaan hapettumiseksi, koska se menettää elektroneja. Päätettä, jossa hapettuminen tapahtuu, kutsutaan ”anodiksi”. Paristossa tämä on negatiivinen napa. |
|
Kuparin ”puolireaktio” luokitellaan pelkistymiseksi, koska se saa elektroneja. Pääte, jossa pelkistyminen tapahtuu, on nimeltään ”katodi”. Paristossa tämä on positiivinen napa. |
Cu2+(aq) + 2e- -> Cu(s) |
Jotta volttikenno jatkaisi ulkoisen sähkövirran tuottamista, on liuoksessa olevien sulfaatti-ionien liikuttava oikealta vasemmalle tasapainottaakseen ulkoisen sähkövirran elektronivirtaa. Itse metalli-ioneja on estettävä liikkumasta elektrodien välillä, joten jonkinlaisen huokoisen kalvon tai muun mekanismin on huolehdittava elektrolyytin negatiivisten ionien valikoivasta liikkumisesta oikealta vasemmalle.
Energiaa tarvitaan, jotta elektronit saadaan siirtymään sinkkielektrodilta kuparielektrodille, ja volttikennosta saatavaa energiamäärää varauksen yksikköä kohti kutsutaan kennon sähkömotoriseksi voimaksi (emf). Energia latausyksikköä kohti ilmaistaan voltteina (1 voltti = 1 joule/coulomb).
Yksiselitteisesti, jotta kennosta saataisiin energiaa, täytyy sinkin hapettumisesta vapautua enemmän energiaa kuin kuparin pelkistymiseen kuluu. Kennosta voidaan saada rajallinen määrä energiaa tästä prosessista, sillä prosessia rajoittaa joko elektrolyytissä tai metallielektrodeissa olevan materiaalin määrä. Jos esimerkiksi kuparin puolella olisi yksi mooli sulfaatti-ioneja SO42-, prosessi rajoittuu kahden moolin elektronien siirtämiseen ulkoisen virtapiirin kautta. Elektronimoolin sisältämää sähkövarauksen määrää kutsutaan Faradayn vakioksi, ja se on yhtä suuri kuin Avogadron luku kertaa elektronin varaus:
Volttokennon energiantuotto saadaan kertomalla kennon jännite kertaa siirrettyjen elektronimoolien määrä kertaa Faradayn vakio.
Sähköenergian tuotto = nFEcell
Kennon emf Ecell voidaan ennustaa kahden metallin vakioelektrodipotentiaalien perusteella. Sinkki-kupari-kennolle vakio-olosuhteissa laskettu kennopotentiaali on 1,1 volttia.
| Kuivakennot | Lyijyakut |