O celulă electrochimică care provoacă un flux extern de curent electric poate fi creată folosind oricare două metale diferite, deoarece metalele diferă în tendința lor de a pierde electroni. Zincul pierde mai ușor electroni decât cuprul, astfel încât plasarea zincului și a cuprului metalic în soluții de săruri ale acestora poate face ca electronii să circule printr-un fir extern care duce de la zinc la cupru.
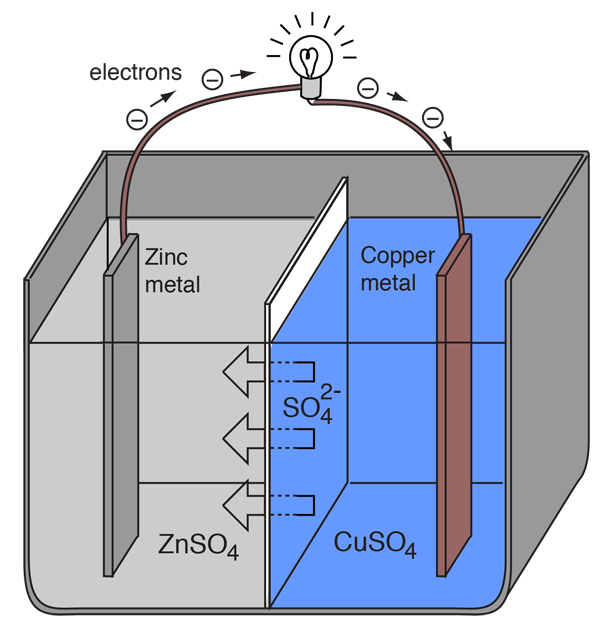
Adaugați o adnotare la ilustrație
Pe măsură ce un atom de zinc furnizează electroni, acesta devine un ion pozitiv și intră în soluție apoasă, scăzând masa electrodului de zinc. Pe partea de cupru, cei doi electroni primiți îi permit să transforme un ion de cupru din soluție într-un atom de cupru neîncărcat care se depune pe electrodul de cupru, mărindu-i masa. Cele două reacții se scriu în mod obișnuit
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Letrele din paranteze amintesc doar faptul că zincul trece de la solid (s) la o soluție apoasă (aq) și invers pentru cupru. Este tipic în limbajul electrochimiei să ne referim la aceste două procese ca fiind „jumătăți de reacție” care au loc la cei doi electrozi.
Zn(s) -> Zn2+(aq) + 2e- |
„Semi-reacția” zincului este clasificată drept oxidare, deoarece pierde electroni. Terminalul la care are loc oxidarea se numește „anod”. Pentru o baterie, acesta este terminalul negativ. |
|
„Semi-reacția” cuprului este clasificată ca reducere deoarece câștigă electroni. Terminalul la care are loc reducerea se numește „catod”. Pentru o baterie, acesta este terminalul pozitiv. |
Cu2+(aq) + 2e- -> Cu(s) |
Pentru ca celula voltaică să continue să producă un curent electric extern, trebuie să existe o mișcare a ionilor de sulfat din soluție de la dreapta la stânga pentru a echilibra fluxul de electroni din circuitul extern. Ionii metalici înșiși trebuie să fie împiedicați să se deplaseze între electrozi, astfel încât un fel de membrană poroasă sau un alt mecanism trebuie să asigure deplasarea selectivă a ionilor negativi din electrolit de la dreapta la stânga.
Este necesară energie pentru a forța electronii să se deplaseze de la electrodul de zinc la cel de cupru, iar cantitatea de energie pe unitate de sarcină disponibilă din celula voltaică se numește forța electromotoare (emf) a celulei. Energia pe unitate de sarcină se exprimă în volți (1 volt = 1 joule/coulomb).
Evident, pentru a obține energie din celulă, trebuie să obțineți mai multă energie eliberată din oxidarea zincului decât este nevoie pentru a reduce cuprul. Celula poate produce o cantitate finită de energie din acest proces, procesul fiind limitat de cantitatea de material disponibil fie în electrolit, fie în electroliți, fie în electrozii metalici. De exemplu, dacă ar exista un mol de ioni de sulfat SO42- pe partea de cupru, atunci procesul este limitat la transferul a doi moli de electroni prin circuitul extern. Cantitatea de sarcină electrică conținută într-un mol de electroni se numește constanta Faraday și este egală cu numărul lui Avogadro înmulțit cu sarcina electronică:
Energia produsă de o celulă voltaică este dată de tensiunea celulei înmulțită cu numărul de moli de electroni transferați înmulțit cu constanta Faraday.
Dezvoltarea de energie electrică = nFEcelulă
Celula emf Ecell poate fi prezisă pornind de la potențialele standard de electrod pentru cele două metale. Pentru celula zinc/cupru în condiții standard, potențialul calculat al celulei este de 1,1 volți.
| Pile uscate | Baterii plumb-acid |