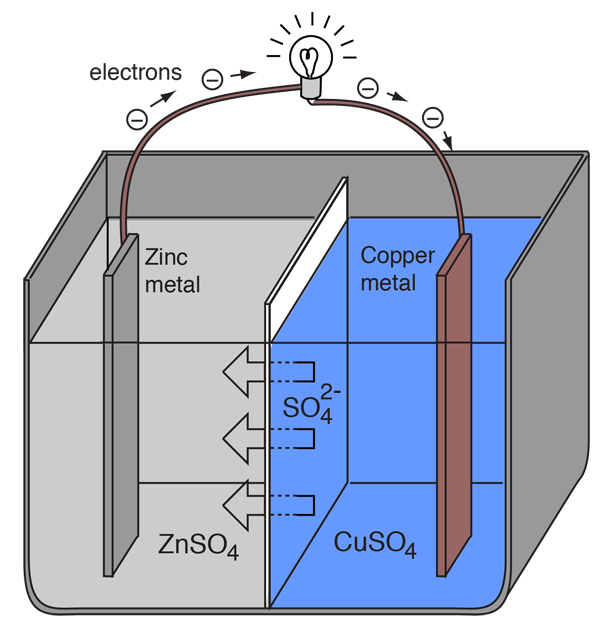
金属は電子を失いやすい性質が異なるので、任意の2種類の金属を用いて、外部に電流を流す電気化学セルを作ることができる。 亜鉛は銅よりも電子を失いやすいので、亜鉛と銅をその塩の溶液に入れると、亜鉛から銅につながる外線を通して電子が流れるようになる。
イラストに注釈を追加
亜鉛原子は電子を提供すると正イオンになって水溶液に入り、亜鉛電極の質量が減少する。 銅のほうは、受け取った2個の電子によって、溶液中の銅イオンを電荷のない銅原子に変換し、銅電極に析出させて質量を増加させる。 この2つの反応は通常
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e -> Cu(s)
括弧内の文字は、亜鉛が固体(s)から水溶液(aq)、銅は逆になることを示しているだけで、この反応は、銅が固体から水になることを意味しています。 電気化学の用語では、この2つの過程を、2つの電極で起こる「半反応」と呼ぶのが一般的です。
Zn(s) -> Zn2+(aq) + 2e- |
亜鉛の「半反応」は電子を失うため酸化と区分される。 酸化が起こる端子を「陽極」と呼びます。 |
|
銅の「半反応」は電子を獲得するため、還元に分類される。 還元が起こる端子を「カソード」と呼びます。 電池の場合は正極にあたります。 |
Cu2+(aq) + 2e- -> Cu(s) |
ボルタ電池が外部電流を作り続けるために、溶液中の硫酸イオンが右から左に移動して外部回路の電子流と釣り合う必要がある。 金属イオンそのものは電極間を移動できないようにしなければならないので、電解液中のマイナスイオンを右から左へ選択的に移動させる多孔質膜などの機構が必要である。
電子を亜鉛電極から銅電極に移動させるためにはエネルギーが必要で、ボルタ電池の単位電荷あたりのエネルギー量を電池の起電力と呼びます。 単位電荷あたりのエネルギーはボルトで表される(1ボルト=1ジュール/クーロン)。
明らかに、セルからエネルギーを得るには、銅を還元するのに必要なエネルギーよりも、亜鉛を酸化することで放出されるエネルギーを多く得る必要があります。 セルがこのプロセスから得られるエネルギーは有限であり、プロセスは電解質または金属電極のどちらかで利用可能な材料の量によって制限されます。 例えば、銅側に1モルの硫酸イオンSO42-があった場合、外部回路を通して2モルの電子を移動させるのが限界である。 電子1モルに含まれる電荷の量をファラデー定数といい、アボガドロ数×電子の電荷量に等しい。
ボルタ電池から得られるエネルギーは、電池電圧に移動する電子のモル数、ファラデー定数で与えられる。
電気エネルギー出力=nFEcell
セル起電力Ecellは二つの金属の標準電極電位から予測することができる。 標準的な条件下での亜鉛/銅セルでは、計算上のセル電位は1.1ボルトである。
| 乾電池 | 鉛蓄電池 |