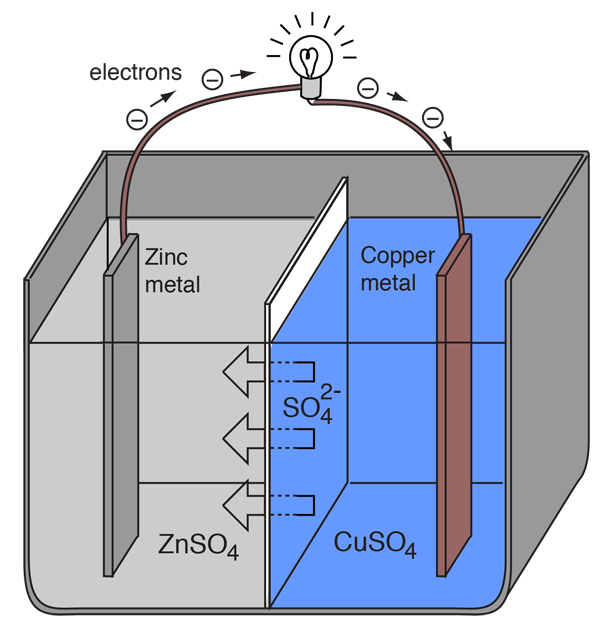
Une cellule électrochimique qui provoque un flux de courant électrique externe peut être créée en utilisant n’importe quels deux métaux différents puisque les métaux diffèrent dans leur tendance à perdre des électrons. Le zinc perd plus facilement des électrons que le cuivre, donc en plaçant le zinc et le cuivre métalliques dans des solutions de leurs sels, on peut faire circuler des électrons dans un fil externe qui va du zinc au cuivre.
Ajouter une annotation à l’illustration
Comme un atome de zinc fournit les électrons, il devient un ion positif et passe en solution aqueuse, diminuant la masse de l’électrode de zinc. Du côté du cuivre, les deux électrons reçus lui permettent de transformer un ion cuivre de la solution en un atome de cuivre non chargé qui se dépose sur l’électrode de cuivre, augmentant sa masse. Les deux réactions s’écrivent typiquement
Zn(s) -> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- -> Cu(s)
Les lettres entre parenthèses rappellent simplement que le zinc passe d’un solide (s) à une solution aqueuse (aq) et inversement pour le cuivre. Il est typique dans le langage de l’électrochimie de désigner ces deux processus comme des « demi-réactions » qui se produisent aux deux électrodes.
Zn(s) -> Zn2+(aq) + 2e- |
La « demi-réaction » du zinc est classée comme une oxydation puisqu’il perd des électrons. La borne sur laquelle se produit l’oxydation est appelée « anode ». Pour une batterie, c’est la borne négative. |
|
La « demi-réaction » du cuivre est classée comme une réduction puisqu’il gagne des électrons. La borne sur laquelle se produit la réduction est appelée la « cathode ». Pour une batterie, il s’agit de la borne positive. |
Cu2+(aq) + 2e- -> Cu(s) |
Pour que la pile voltaïque continue à produire un courant électrique externe, il doit y avoir un mouvement des ions sulfate en solution de droite à gauche pour équilibrer le flux d’électrons dans le circuit externe. Les ions métalliques eux-mêmes doivent être empêchés de se déplacer entre les électrodes, donc une sorte de membrane poreuse ou un autre mécanisme doit assurer le mouvement sélectif des ions négatifs dans l’électrolyte de la droite vers la gauche.
Il faut de l’énergie pour forcer les électrons à se déplacer de l’électrode de zinc à l’électrode de cuivre, et la quantité d’énergie par unité de charge disponible dans la cellule voltaïque est appelée force électromotrice (emf) de la cellule. L’énergie par unité de charge est exprimée en volts (1 volt = 1 joule/coulomb).
En clair, pour obtenir de l’énergie de la pile, il faut obtenir plus d’énergie libérée par l’oxydation du zinc qu’il n’en faut pour réduire le cuivre. La pile peut produire une quantité finie d’énergie à partir de ce processus, le processus étant limité par la quantité de matière disponible soit dans l’électrolyte, soit dans les électrodes métalliques. Par exemple, s’il y avait une mole d’ions sulfate SO42- du côté du cuivre, le processus serait limité au transfert de deux moles d’électrons à travers le circuit externe. La quantité de charge électrique contenue dans une mole d’électrons est appelée constante de Faraday, et est égale au nombre d’Avogadro multiplié par la charge de l’électron :
Le rendement énergétique d’une pile voltaïque est donné par la tension de la pile multipliée par le nombre de moles d’électrons transférés multiplié par la constante de Faraday.
Production d’énergie électrique = nFEcellule
La force électromotrice de la cellule Ecell peut être prédite à partir des potentiels d’électrode standard des deux métaux. Pour la cellule zinc/cuivre dans les conditions standard, le potentiel de cellule calculé est de 1,1 volt.
| Piles sèches | Batteries plomb-acide |