Generický název: halobetasol propionát
Dávkovací forma: krém
Medicínsky přezkoumáno Drugs.com. Naposledy aktualizováno 21. dubna 2020.
- Přehled
- Nežádoucí účinky
- Dávkování
- Odborné
- Interakce
- Další
- Ultravate krém Popis
- Ultravate krém – klinická farmakologie
- Farmakokinetika
- Indikace a použití krému Ultravate
- Kontraindikace
- Bezpečnostní opatření
- Všeobecně
- Informace pro pacienty
- Laboratorní testy
- Karcinogeneze, mutageneze a poškození fertility
- Těhotenství
- Kojící matky
- Pediatrické použití
- Geriatrické použití
- Nežádoucí účinky
- Předávkování
- Dávkování a způsob podání přípravku Ultravate krém
- Jak se krém Ultravate dodává
- SCHOVÁVÁNÍ
- Označení na obalu.PRINCIPOVÝ VYSTAVOVACÍ PANEL
- Často kladené otázky
- Další informace o přípravku Ultravate (halobetasol topical)
- Zdroje pro spotřebitele
- Zdroje pro odborníky
- Související průvodce léčbou
Ultravate krém Popis
Ultravate® (halobetasol propionát krém) krém, 0.05% obsahuje halobetasol propionát, syntetický kortikosteroid pro lokální dermatologické použití. Kortikosteroidy tvoří skupinu převážně syntetických steroidů používaných lokálně jako protizánětlivý a antipruritický prostředek.
Chemicky je halobetasol-propionát 21-chlor-6α, 9-difluoro-11β, 17-dihydroxy-16β-methylpregna-1, 4-dien-3-20-dion, 17-propionát, C25H31ClF2O5. Má následující strukturní vzorec:
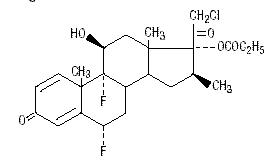
Halobetasol-propionát má molekulovou hmotnost 485 mg. Je to bílý krystalický prášek nerozpustný ve vodě.
Každý gram krému Ultravate obsahuje 0,5 mg/g halobetasol propionátu v krémovém základu z cetylalkoholu, glycerinu, isopropyl isostearátu, isopropyl palmitátu, steareth-21, diazolidinyl močoviny, methylchloroisothiazolinonu, (a) methylisothiazolinonu a vody.
Ultravate krém – klinická farmakologie
Stejně jako ostatní lokální kortikosteroidy má halobetasol-propionát protizánětlivé, antipruritické a vazokonstrikční účinky. Mechanismus protizánětlivé aktivity topických kortikosteroidů je obecně nejasný. Předpokládá se však, že kortikosteroidy působí indukcí proteinů inhibujících fosfolipázu A2, souhrnně nazývaných lipokortin. Předpokládá se, že tyto proteiny řídí biosyntézu silných mediátorů zánětu, jako jsou prostaglandiny a leukotrieny, tím, že inhibují uvolňování jejich společného prekurzoru kyseliny arachidonové. Kyselina arachidonová se uvolňuje z membránových fosfolipidů pomocí fosfolipázy A2.
Farmakokinetika
Rozsah perkutánní absorpce lokálních kortikosteroidů je dán mnoha faktory včetně vehikula a integrity epidermální bariéry. Nebylo prokázáno, že by okluzivní obvazy s hydrokortizonem po dobu až 24 hodin zvyšovaly penetraci; okluze hydrokortizonu po dobu 96 hodin však penetraci výrazně zvyšuje. Lokální kortikosteroidy se mohou vstřebávat z normální neporušené kůže. Zánět a/nebo jiné chorobné procesy v kůži mohou zvýšit perkutánní absorpci.
Studie na lidech a zvířatech ukazují, že méně než 6 % aplikované dávky halobetasol-propionátu se dostane do oběhu během 96 hodin po lokálním podání krému.
Studie provedené s krémem Ultravate naznačují, že se ve srovnání s jinými lokálními kortikosteroidy pohybuje v oblasti supervysoké účinnosti.
Indikace a použití krému Ultravate
Krém Ultravate 0,05% je kortikosteroid se supervysokou účinností určený ke zmírnění zánětlivých a pruritických projevů dermatóz reagujících na kortikosteroidy. Léčba přesahující dva po sobě jdoucí týdny se nedoporučuje a celková dávka by neměla překročit 50 g/týden z důvodu možnosti potlačení osy hypotalamus-hypofýza-nadledviny (HPA). Použití u dětí mladších 12 let se nedoporučuje.
Stejně jako u jiných vysoce účinných kortikosteroidů by měla být léčba po dosažení kontroly ukončena. Pokud nedojde ke zlepšení do 2 týdnů, může být nutné přehodnocení diagnózy.
Kontraindikace
Ultravate krém je kontraindikován u pacientů s anamnézou přecitlivělosti na některou ze složek přípravku.
Bezpečnostní opatření
Všeobecně
Systémová absorpce lokálních kortikosteroidů může způsobit reverzibilní supresi osy hypotalamus-hypofýza-nadledviny (HPA) s možností vzniku glukokortikosteroidní insuficience po ukončení léčby. Projevy Cushingova syndromu, hyperglykémie a glykosurie mohou být u některých pacientů vyvolány také systémovou absorpcí topických kortikosteroidů během léčby.
Pacienti, kteří aplikují topický steroid na velkou plochu nebo na místa pod okluzí, by měli být pravidelně vyšetřováni na známky suprese osy HPA. To lze provést pomocí ACTH stimulačního testu, A.M. plazmatického kortizolu a testu volného kortizolu v moči. Pacienti, kteří dostávají supersilné kortikosteroidy, by neměli být léčeni déle než 2 týdny v kuse a současně by měly být léčeny pouze malé oblasti kvůli zvýšenému riziku suprese HPA.
Ultravate Cream vyvolal supresi osy HPA, pokud byl u pacientů s psoriázou používán v rozdělených dávkách 7 g denně po dobu jednoho týdne. Tyto účinky byly reverzibilní po přerušení léčby.
Pokud je zaznamenána suprese osy HPA, je třeba se pokusit přípravek vysadit, snížit frekvenci aplikace nebo jej nahradit méně účinným kortikosteroidem. Obnova funkce osy HPA je po vysazení lokálních kortikosteroidů obvykle rychlá. Zřídka se mohou objevit známky a příznaky glukokortikosteroidní insuficience vyžadující doplňkové systémové kortikosteroidy. Informace o systémové suplementaci viz preskripční informace těchto přípravků.
Pediatričtí pacienti mohou být náchylnější k systémové toxicitě ekvivalentních dávek vzhledem k jejich většímu poměru povrchu kůže k tělesné hmotnosti (viz PRECAUTIONS: Pediatrické použití).
Pokud se objeví podráždění, je třeba přípravek Ultravate Cream vysadit a zahájit vhodnou léčbu. Alergická kontaktní dermatitida s kortikosteroidy se obvykle diagnostikuje spíše pozorováním nehojení než zaznamenáním klinické exacerbace jako u většiny lokálních přípravků neobsahujících kortikosteroidy. Takové pozorování by mělo být potvrzeno vhodným diagnostickým náplasťovým testem.
Pokud jsou přítomny nebo se rozvinou souběžné kožní infekce, měl by být použit vhodný antimykotický nebo antibakteriální přípravek. Pokud se příznivá odpověď nedostaví okamžitě, mělo by být používání Ultravate krému přerušeno, dokud nebude infekce adekvátně zvládnuta.
Ultravate krém by neměl být používán při léčbě rosacey nebo periorální dermatitidy a neměl by být používán na obličej, do třísel nebo do podpaží.
Informace pro pacienty
Pacienti používající lokální kortikosteroidy by měli obdržet následující informace a pokyny:
- Lék se má používat podle pokynů lékaře. Je určen pouze k zevnímu použití. Vyhněte se kontaktu s očima.
- Léčivý přípravek by neměl být používán na jiné onemocnění, než na které byl předepsán.
- Ošetřovaná oblast kůže by neměla být obvazována, jinak zakrývána nebo zabalována tak, aby byla okluzivní, pokud tak neurčí lékař.
- Pacienti by měli hlásit lékaři jakékoli známky lokálních nežádoucích účinků.
Laboratorní testy
Při hodnocení pacientů z hlediska suprese osy HPA mohou být užitečné následující testy:
Karcinogeneze, mutageneze a poškození fertility
Dlouhodobé studie na zvířatech, které by hodnotily karcinogenní potenciál halobetasol-propionátu, nebyly provedeny. Pozitivní mutagenní účinky byly pozorovány ve dvou testech genotoxicity. Halobetasol-propionát byl pozitivní v mikrojádrovém testu na čínském křečkovi a v testu mutace genů myšího lymfomu in vitro.
Studie na potkanech po perorálním podání v dávkách do 50 µg/kg/den nenaznačily žádné poškození plodnosti nebo celkové reprodukční výkonnosti.
Při dalších testech genotoxicity nebyl halobetasol-propionát shledán genotoxickým v Amesově/Salmonelovém testu, v testu výměny sesterských chromatid v somatických buňkách čínského křečka, ve studiích chromozomových aberací zárodečných a somatických buněk hlodavců a v bodovém testu savců pro stanovení bodových mutací.
Těhotenství
Teratogenní účinky: Kategorie těhotenství C
Bylo prokázáno, že kortikosteroidy jsou u laboratorních zvířat teratogenní, pokud jsou podávány systémově v relativně nízkých dávkách. U některých kortikosteroidů byla prokázána teratogenita po dermální aplikaci u laboratorních zvířat.
U potkanů SPF a králíků typu činčila byla prokázána teratogenita halobetasol-propionátu při systémovém podávání během březosti v dávkách 0,04 až 0,1 mg/kg u potkanů a 0,01 mg/kg u králíků. Tyto dávky jsou přibližně 13násobkem, 33násobkem a 3násobkem lidské lokální dávky krému Ultravate. Halobetasol-propionát byl embryotoxický u králíků, ale ne u potkanů.
U potkanů i králíků byla pozorována levá patra. Omfalokéla byla pozorována u potkanů, ale ne u králíků.
Neexistují žádné adekvátní a dobře kontrolované studie teratogenního potenciálu halobetasol-propionátu u těhotných žen. Ultravate krém by měl být během těhotenství používán pouze v případě, že potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojící matky
Systémově podávané kortikosteroidy se objevují v lidském mléce a mohly by potlačit růst, narušit endogenní produkci kortikosteroidů nebo způsobit jiné nežádoucí účinky. Není známo, zda by lokální podávání kortikosteroidů mohlo vést k dostatečné systémové absorpci, která by vedla ke vzniku detekovatelných množství v lidském mléce. Vzhledem k tomu, že mnoho léčivých látek se vylučuje do lidského mléka, je třeba dbát zvýšené opatrnosti při podávání krému Ultravate kojícím ženám.
Pediatrické použití
Bezpečnost a účinnost krému Ultravate u pediatrických pacientů nebyla stanovena a použití u pediatrických pacientů mladších 12 let se nedoporučuje. Vzhledem k vyššímu poměru plochy kožního povrchu k tělesné hmotnosti jsou dětští pacienti při léčbě lokálními kortikosteroidy vystaveni většímu riziku suprese HPA osy a Cushingova syndromu než dospělí. Jsou proto také více ohroženi adrenální insuficiencí během léčby nebo po jejím vysazení. Při nevhodném užívání lokálních kortikosteroidů u kojenců a dětí byly hlášeny nežádoucí účinky včetně strumy.
U dětí užívajících lokální kortikosteroidy byla hlášena suprese osy HPA, Cushingův syndrom, lineární růstová retardace, opožděný přírůstek hmotnosti a intrakraniální hypertenze. Mezi projevy suprese nadledvin u dětí patří nízké plazmatické hladiny kortizolu a absence odpovědi na stimulaci ACTH. Projevy intrakraniální hypertenze zahrnují vyboulení fontanel, bolesti hlavy a oboustranný edém papily.
Geriatrické použití
Z přibližně 400 pacientů léčených přípravkem Ultravate Cream v klinických studiích bylo 25 % pacientů starších 61 let a 6 % pacientů starších 71 let. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti; ani další hlášené klinické zkušenosti nezjistily rozdíly v reakcích mezi staršími a mladšími pacienty, nelze však vyloučit větší citlivost některých starších jedinců.
Nežádoucí účinky
V kontrolovaných klinických studiích patřilo mezi nejčastější nežádoucí účinky hlášené u krému Ultravate píchání, pálení nebo svědění u 4,4 % pacientů. Méně často hlášenými nežádoucími účinky byly suchá kůže, erytém, atrofie kůže, leukodermie, vezikuly a vyrážka.
Následující další lokální nežádoucí účinky jsou u lokálních kortikosteroidů hlášeny vzácně a mohou se vyskytovat častěji u vysoce účinných kortikosteroidů, jako je Ultravate krém. Tyto reakce jsou uvedeny v přibližném sestupném pořadí výskytu: folikulitida, hypertrichóza, akneiformní erupce, hypopigmentace, periorální dermatitida, alergická kontaktní dermatitida, sekundární infekce, striae a miliaria.
Předávkování
Topicky aplikovaný Ultravate krém může být absorbován v dostatečném množství, aby vyvolal systémové účinky (viz bodPŘÍPRAVEK).
Dávkování a způsob podání přípravku Ultravate krém
Naneste tenkou vrstvu přípravku Ultravate krém na postiženou kůži jednou nebo dvakrát denně podle pokynů lékaře a jemně a úplně ji rozetřete.
Přípravek Ultravate (halobetasol-propionát krém) krém je lokální kortikosteroid se supervysokou účinností, proto by léčba měla být omezena na dva týdny a nemělo by se používat množství větší než 50 g/den. Stejně jako u jiných kortikosteroidů by měla být léčba po dosažení kontroly ukončena. Pokud nedojde ke zlepšení během 2 týdnů, může být nutné přehodnotit diagnózu.
Krém Ultravate by se neměl používat s okluzivními obvazy.
Jak se krém Ultravate dodává
Ultravate® (halobetasol propionát krém) krém, 0.05% se dodává v následujících velikostech tuby:
15 g (NDC 10631-103-15)
50 g (NDC 10631-103-50)
SCHOVÁVÁNÍ
Uchovávejte při teplotě od 15 °C do 30 °C.
RANBAXY
Jacksonville, FL 32257 USA
09-0085 (plochý), 09-0086 (složený)
Revize květen 2010
Označení na obalu.PRINCIPOVÝ VYSTAVOVACÍ PANEL

Štítek na 15gramový obal

Štítek na 15gramový karton

Štítek na 50gramový obal

Štítek na 50gramový karton
| ULTRAVATE halobetasol propionát krém |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Označovatel – Ranbaxy Laboratories Inc. (169932519)
Registrant – Ranbaxy Laboratories Inc. (169932519)
| Zařízení | |||
| Jméno | Adresa | ID/FEI | Provoz |
| Contract Pharmaceuticals Limited | 248761249 | výroba | |
Často kladené otázky
- Halobetasol vs. klobetasol – jak se porovnávají?
- Může se použít na jedovatý břečťan?
- Může se použít na pokožku hlavy?
Další informace o přípravku Ultravate (halobetasol topical)
- Nežádoucí účinky
- V průběhu těhotenství nebo kojení
- Dávkování Informace
- Lékové interakce
- Cena &Kupóny
- En Español
- 6 Recenze
- Generická dostupnost
- Třída léků: Lokální steroidy
Zdroje pro spotřebitele
- Informace pro pacienty
- Ultravate (Pokročilé čtení)
Zdroje pro odborníky
- Předpisové informace
Další značky Lexette, Bryhali, Halonate
Související průvodce léčbou
- Poriáza
- Atopická dermatitida
- Dermatitida
- Ekzém
Vyjádření lékařské odpovědnosti