Nome genérico: halobetasol propionato
Forma de dosagem: creme
Revisado medicamente por Drugs.com. Última atualização em 21 de abril de 2020.
- Visão geral
- Efeitos colaterais
- Dosagem
- Profissional
- Interações
- Outros
- Creme de creme de halobetasol Descrição
- Cremeltravate – Farmacologia Clínica
- Farmacocinética
- Indicações e Uso do Creme Ultraprivado
- Contraindicações
- Precauções
- Geral
- Informações para os doentes
- Testes Laboratoriais
- Carcinogênese, Mutagênese e Imparidade da Fertilidade
- Gravidez
- Mães Amamentadoras
- Uso Pediátrico
- Uso Geriátrico
- Reações adversas
- Overdose
- Dose e Administração do Creme Ultraprivado
- Como é fornecido o Ultravate Cream
- SISTÓRIO
- PACKAGE LABEL.PAINEL PRINCIPAL DE DISPLAY PANEL
- Perguntas frequentes
- Mais sobre o Ultravate (halobetasol tópico)
- Recursos do consumidor
- Recursos profissionais
- Guias de tratamento relacionadas
Creme de creme de halobetasol Descrição
>
Creme de creme de propionato de halobetasol, 0.05% contém propionato de halobetasol, um corticosteróide sintético para uso dermatológico tópico. Os corticosteróides constituem uma classe de esteróides principalmente sintéticos utilizados topicamente como agente anti-inflamatório e antiprurítico.
Propionato de halobetasol quimicamente é 21-cloro-6α, 9-difluoro-11β, 17-dihidroxi-16β-metilpregna-1, 4-dieno-3-20-diona, 17-propionato, C25H31ClF2O5. Tem a seguinte fórmula estrutural:
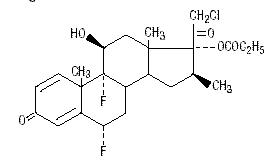
Halobetasol propionato tem o peso molecular de 485. É um pó cristalino branco insolúvel em água.
Cada grama de creme Ultravate contém 0,5 mg/g de propionato de halobetasol numa base creme de álcool cetílico, glicerina, isopropil isostearato de isopropilo, palmitato de isopropilo, estearet-21, diazolidinil ureia, metilcloroisotiazolinona, (e) metilisotiazolinona e água.
Cremeltravate – Farmacologia Clínica
Como outros corticosteróides tópicos, o propionato de halobetasol tem acções anti-inflamatórias, antipruríticas e vasoconstritoras. O mecanismo da atividade anti-inflamatória dos corticosteróides tópicos, em geral, não é claro. Entretanto, acredita-se que os corticosteróides atuam por indução de proteínas inibitórias da fosfolipase A2, chamadas coletivamente de lipocortinas. Postula-se que estas proteínas controlam a biossíntese de mediadores potentes da inflamação, como prostaglandinas e leucotrienos, inibindo a liberação de seu ácido araquidônico precursor comum. O ácido araquidônico é liberado dos fosfolipídeos de membrana pela fosfolipase A2.
Farmacocinética
A extensão da absorção percutânea dos corticosteróides tópicos é determinada por muitos fatores, incluindo o veículo e a integridade da barreira epidérmica. Pensos oclusivos com hidrocortisona por até 24 horas não demonstraram aumentar a penetração; no entanto, a oclusão da hidrocortisona por 96 horas aumenta acentuadamente a penetração. Os corticosteróides tópicos podem ser absorvidos da pele normal intacta. Inflamação e/ou outros processos de doença na pele podem aumentar a absorção percutânea.
Estudos humanos e animais indicam que menos de 6% da dose aplicada de propionato de halobetasol entra na circulação dentro de 96 horas após a administração tópica do creme.
Estudos realizados com Creme Ultraprivado indicam que está na faixa de potência super-alta em comparação com outros corticosteróides tópicos.
Indicações e Uso do Creme Ultraprivado
Creme Ultraprivado 0,05% é um corticosteróide de potência super-alta indicado para o alívio das manifestações inflamatórias e pruriginosas das dermatoses corticosteróides-responsivas. Não é recomendado tratamento após duas semanas consecutivas, e a dosagem total não deve exceder 50 g/semana devido ao potencial do medicamento para suprimir o eixo hipotálamo-hipófise-adrenal (HPA). O uso em crianças menores de 12 anos não é recomendado.
Como com outros corticosteróides altamente ativos, o tratamento deve ser interrompido quando o controle tiver sido alcançado. Se nenhuma melhora for observada dentro de 2 semanas, pode ser necessária uma reavaliação do diagnóstico.
Contraindicações
Cremeltravate está contra-indicado naqueles pacientes com histórico de hipersensibilidade a qualquer um dos componentes do preparo.
Precauções
Geral
A absorção sistêmica de corticosteróides tópicos pode produzir supressão hipotálamo-hipófise-adrenal (HPA) reversível com potencial para insuficiência glucocorticosteróide após a retirada do tratamento. Manifestações de síndrome de Cushing, hiperglicemia e glucosúria também podem ser produzidas em alguns pacientes por absorção sistêmica de corticosteroides tópicos durante o tratamento.
As pacientes que aplicam um esteróide tópico a uma grande área superficial ou a áreas sob oclusão devem ser avaliadas periodicamente para evidência de supressão do eixo HPA. Isto pode ser feito usando a estimulação do ACTH, cortisol plasmático A.M. e testes de cortisol livre urinário. Os pacientes que recebem corticosteróides super potentes não devem ser tratados por mais de 2 semanas de cada vez e apenas pequenas áreas devem ser tratadas de cada vez devido ao risco aumentado de supressão do HPA.
Cremeltravate Cream produzido supressão do eixo HPA quando usado em doses divididas a 7 gramas por dia durante uma semana em pacientes com psoríase. Esses efeitos foram reversíveis com a interrupção do tratamento.
Se a supressão do eixo HPA for notada, deve-se tentar retirar o medicamento, reduzir a freqüência de aplicação ou substituir um corticosteróide menos potente. A recuperação da função do eixo HPA é geralmente imediata após a descontinuação dos corticosteróides tópicos. Poucas vezes, podem ocorrer sinais e sintomas de insuficiência glucocorticosteróide que necessitem de corticosteróides sistêmicos suplementares. Para informações sobre a suplementação sistêmica, veja informações sobre prescrição desses produtos.
Pacientes pediátricos podem ser mais suscetíveis à toxicidade sistêmica a partir de doses equivalentes, devido à sua maior superfície cutânea em relação à massa corporal (veja PRECAUÇÕES: Uso Pediátrico).
Se a irritação se desenvolver, o Ultravate Cream deve ser descontinuado e deve ser instituída a terapia apropriada. A dermatite de contato alérgica com corticosteróides é geralmente diagnosticada pela observação de falha na cicatrização, ao invés de observar uma exacerbação clínica como na maioria dos produtos tópicos que não contêm corticosteróides. Tal observação deve ser corroborada com testes de adesivos diagnósticos apropriados.
Se infecções cutâneas concomitantes estiverem presentes ou se desenvolverem, deve ser usado um agente antifúngico ou antibacteriano apropriado. Se não ocorrer uma resposta favorável de imediato, a utilização do Ultravate Cream deve ser interrompida até a infecção ter sido adequadamente controlada.
Ultravate Cream não deve ser utilizado no tratamento da rosácea ou dermatite perioral, e não deve ser utilizado na face, virilha ou axila.
Informações para os doentes
Os doentes que utilizam corticosteróides tópicos devem receber as seguintes informações e instruções:
- A medicação deve ser utilizada de acordo com as instruções do médico. É apenas para uso externo. Evite o contato com os olhos.
- O medicamento não deve ser usado para qualquer distúrbio que não aquele para o qual foi prescrito.
- A área da pele tratada não deve ser enfaixada, coberta ou embrulhada, de modo a ser oclusiva, a menos que seja indicado pelo médico.
- Os pacientes devem informar ao médico qualquer sinal de reação adversa local.
Testes Laboratoriais
Os seguintes testes podem ser úteis na avaliação de pacientes para supressão do eixo HPA: Teste de estimulação do ACTH; teste de cortisol plasmático A.M.; teste de cortisol livre urinário.
Carcinogênese, Mutagênese e Imparidade da Fertilidade
Não foram realizados estudos a longo prazo em animais para avaliar o potencial cancerígeno do propionato de halobetasol. Efeitos mutagênicos positivos foram observados em dois ensaios de genotoxicidade. O propionato de halobetasol foi positivo em um teste de micronúcleo de hamster chinês, e em um ensaio de mutação do gene do linfoma em camundongos in vitro.
Estudos no rato após administração oral em níveis de dose de até 50 µg/kg/dia indicaram nenhum comprometimento da fertilidade ou desempenho reprodutivo geral.
Em outros testes de genotoxicidade, o propionato de halobetasol não foi encontrado genotóxico no ensaio Ames/Salmonella, no teste de troca de cromatídeos irmãos em células somáticas do hamster chinês, em estudos de aberração cromossômica de células germinativas e somáticas de roedores, e em um teste pontual de mamíferos para determinar mutações pontuais.
Gravidez
Efeitos teratogênicos: Categoria de Gravidez C
Corticosteróides demonstraram ser teratogênicos em animais de laboratório quando administrados sistemicamente em níveis de dosagem relativamente baixos. Alguns corticosteróides mostraram ser teratogênicos após aplicação dérmica em animais de laboratório.
Propionato de Palobetasol mostrou ser teratogênico em ratos SPF e coelhos tipo chinchila quando administrado sistemicamente durante a gestação nas doses de 0,04 a 0,1 mg/kg em ratos e 0,01 mg/kg em coelhos. Estas doses são aproximadamente 13, 33 e 3 vezes, respectivamente, a dose tópica humana de Ultravate Cream. Halobetasol propionato foi embriotóxico em coelhos mas não em ratos.
Palato esquerdo foi observado tanto em ratos quanto em coelhos. A onfalocele foi observada em ratos, mas não em coelhos.
Não há estudos adequados e bem controlados do potencial teratogênico do propionato de halobetasol em mulheres grávidas. O Creme Ultra Privado só deve ser usado durante a gravidez se o benefício potencial justificar o risco potencial para o feto.
Mães Amamentadoras
Os corticosteróides administrados sistematicamente aparecem no leite humano e podem suprimir o crescimento, interferir com a produção endógena de corticosteróides, ou causar outros efeitos adversos. Não se sabe se a administração tópica de corticosteroides poderia resultar em absorção sistêmica suficiente para produzir quantidades detectáveis no leite humano. Como muitos medicamentos são excretados no leite humano, deve-se ter cuidado quando o Ultravate Cream é administrado a uma mulher lactante.
Uso Pediátrico
Segurança e eficácia do Ultravate Cream em pacientes pediátricos não foram estabelecidas e o uso em pacientes pediátricos menores de 12 anos não é recomendado. Devido a uma maior proporção de área de superfície da pele em relação à massa corporal, os pacientes pediátricos correm um risco maior do que os adultos de supressão do eixo HPA e síndrome de Cushing quando são tratados com corticosteróides tópicos. Portanto, eles também têm maior risco de insuficiência adrenal durante ou após a retirada do tratamento. Efeitos adversos, incluindo estrias, têm sido relatados com uso inadequado de corticosteroides tópicos em bebês e crianças.
Supressão do eixo HPA, síndrome de Cushing, retardo linear de crescimento, ganho de peso retardado e hipertensão intracraniana têm sido relatados em crianças que recebem corticosteroides tópicos. Manifestações de supressão adrenal em crianças incluem baixos níveis plasmáticos de cortisol e ausência de resposta à estimulação do ACTH. Manifestações de hipertensão intracraniana incluem fontanelas salientes, dores de cabeça e papiledema bilateral.
Uso Geriátrico
De aproximadamente 400 pacientes tratados com Ultravate Cream em estudos clínicos, 25% tinham 61 anos ou mais e 6% tinham 71 anos ou mais. Não foram observadas diferenças gerais de segurança ou eficácia entre estes pacientes e pacientes mais jovens; e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes mais velhos e mais jovens, mas não se pode descartar maior sensibilidade de alguns indivíduos mais velhos.
Reações adversas
Em ensaios clínicos controlados, os eventos adversos mais frequentes relatados para o Ultravate Cream incluíram picadas, queimaduras ou prurido em 4,4% dos pacientes. As reacções adversas menos frequentemente relatadas foram pele seca, eritema, atrofia cutânea, leucodermia, vesículas e erupção cutânea.
As seguintes reacções adversas locais adicionais são raramente relatadas com corticosteróides tópicos, e podem ocorrer mais frequentemente com corticosteróides de alta potência, como o Ultravate Cream. Estas reacções estão listadas numa ordem decrescente aproximada de ocorrência: foliculite, hipertricose, erupções acneiformes, hipopigmentação, dermatite perioral, dermatite de contacto alérgica, infecção secundária, estrias e miliaria.
Overdose
O Ultravate Cream aplicado ciclicamente pode ser absorvido em quantidades suficientes para produzir efeitos sistémicos (ver PRECAUÇÕES).
Dose e Administração do Creme Ultraprivado
Aplique uma camada fina de Creme Ultraprivado na pele afectada uma ou duas vezes por dia, conforme indicado pelo seu médico, e esfregue suavemente e completamente.
Creme Ultraprivado (creme de propionato de halobetasol) O Creme é um corticosteróide tópico de super alta potência; portanto, o tratamento deve ser limitado a duas semanas, e quantidades superiores a 50 g/wk não devem ser usadas. Como com outros corticosteróides, a terapia deve ser descontinuada quando o controle for alcançado. Se nenhuma melhora for observada dentro de 2 semanas, pode ser necessária uma reavaliação do diagnóstico.
Oltravate Cream não deve ser usado com curativos oclusivos.
Como é fornecido o Ultravate Cream
Ultravate® (creme propionato de halobetasol) Cream, 0.05% é fornecido nos seguintes tamanhos de tubo:
15 g (NDC 10631-103-15)
50 g (NDC 10631-103-50)
SISTÓRIO
Corre entre 15°C e 30°C (59°F e 86°F).
RANBAXY
Jacksonville, FL 32257 USA
09-0085 (Flat), 09-0086 (Folded)
Revisado Maio 2010
PACKAGE LABEL.PAINEL PRINCIPAL DE DISPLAY PANEL

Etiqueta de embalagem de 15 gramas

etiqueta de embalagem de 15 gramas

etiqueta de embalagem de 50 gramas

etiqueta de embalagem de 50 gramas
| ULTRAVATE Creme de propionato dehalobetasol |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
> |
||||||||||||||||||||
Etiquetadora – Ranbaxy Laboratories Inc. (169932519)
Registado – Ranbaxy Laboratories Inc. (169932519)
Registado – Ranbaxy Laboratories Inc. (169932519)
| Estabelecimento | |||
| Nome | Endereço | ID/FEI | Operações |
| Contrato Farmacêutico Limitado | 248761249 | Fabricação | |
Perguntas frequentes
- Halobetasol vs. clobetasol – como se compara?
- Pode ser usado para hera venenosa?
- Pode ser usado no couro cabeludo?
Mais sobre o Ultravate (halobetasol tópico)
- Efeitos secundários
- Durante a gravidez ou amamentação
- Dosagem Informação
- Interacções de Drogas
- Preço& Cupões
- En Español
- 6 Revisões
- Disponibilidade Genérica
- Classe de Drogas: esteróides tópicos
Recursos do consumidor
- Informação de doentes
- Ultravate (Leitura avançada)
Recursos profissionais
- >
- Informação de prescrição
Outras marcas Lexette, Bryhali, Halonate
Guias de tratamento relacionadas
- Psoríase
- Dermatite atópica
- Dermatite
- Eczema
Relatação de responsabilidade médica